- 764.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第八章 化学与可持续发展
第一节 自然资源的开发利用
第1课时 金属矿物的开发利用
课前自主预习
一、金属元素的存在
金属元素在自然界中的存在形态除了金、铂等少数金属以游离态外,绝大多数金属以化合态形式存在于自然界,在这些化合物中金属元素都显正价。
二、金属的冶炼
1.(1)金属的冶炼是指将金属从其化合物中还原出来用于生产和制造各种金属材料的过程。
(2)金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au。
(3)金属冶炼的常用方法有热分解法、热还原法、电解法。
(4)铝热反应是指铝粉与某些金属氧化物在较高温度下,发生剧烈反应并放出大量的热的化学反应,用途为焊接钢轨、冶炼难熔金属。
2.由于金属的化学活动性不同,金属离子得到电子还原成金属原子的能力也就不同,因此必须采用不同的冶炼方法。
(1)热分解法:适用于冶炼金属活动性较差的金属,如汞和银。
(2)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适合于金属活动性介于Zn~Cu之间的大多数金属的冶炼。如:
Fe2O3+3CO2Fe+3CO2
2CuO+C2Cu+CO2↑
2Al+Cr2O32Cr+Al2O3
WO3+3H2W+3H2O
这类金属中若金属以硫化物或碳酸盐形式存在时,首先将其转化成氧化物后再还原,如:
2ZnS+3O22ZnO+2SO2
2ZnO+C2Zn+CO2↑
(3)电解法:适合冶炼金属活动性很强的金属(一般是在金属活动顺序表中排在铝前边的金属)。如:2NaCl(熔融)2Na+Cl2↑
2Al2O3(熔融)4Al+3O2↑
MgCl2(熔融)Mg+Cl2↑
3.合理开发和利用金属矿物资源
地球上的金属矿物资源是有限的,我们必须学会合理开发和利用这些矿物资源。达到此目的的主要途径有:
(1)有效地使用金属产品、材料;
(2)提高金属矿物的利用率;
(3)用其他材料代替金属材料,减少金属的使用量;
(4)加强金属资源的回收和再利用。
课堂互动探究
金属的冶炼
将矿石中的金属从其化合物中还原出来用于生产和制造各种金属材料,这一过程在工业上称为金属的冶炼。
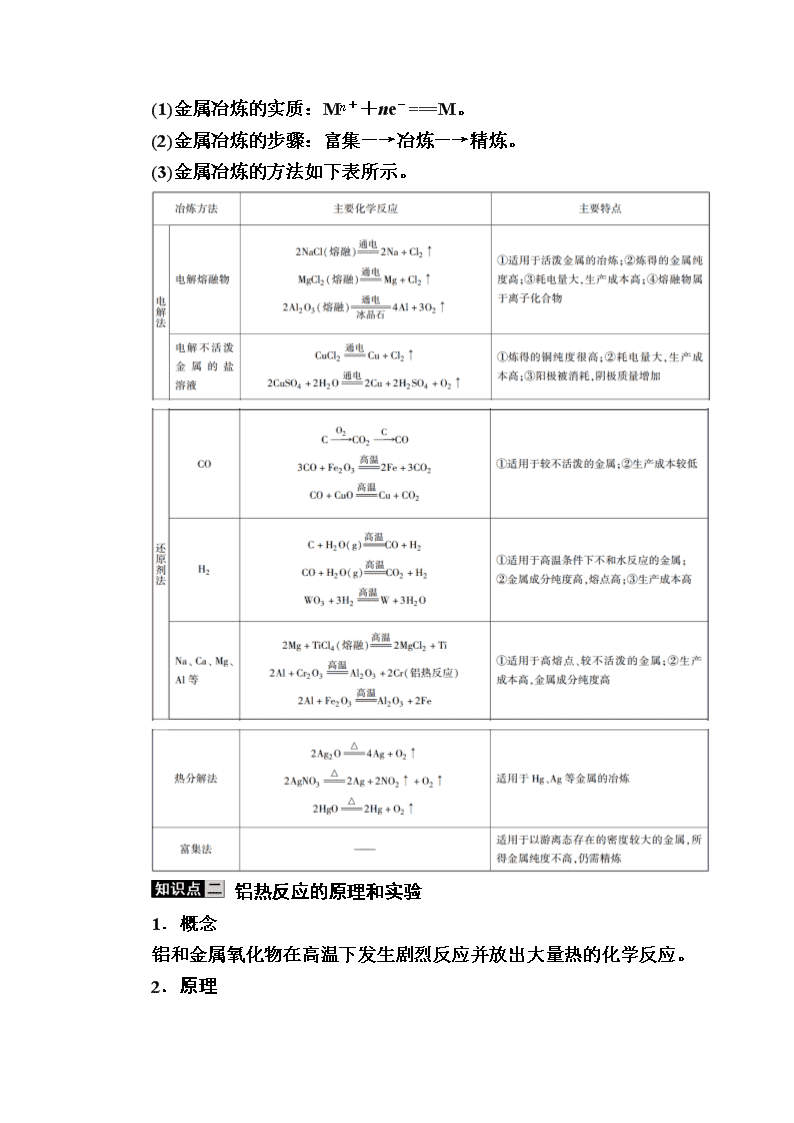
(1)金属冶炼的实质:Mn++ne-===M。
(2)金属冶炼的步骤:富集―→冶炼―→精炼。
(3)金属冶炼的方法如下表所示。
铝热反应的原理和实验
1.概念
铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
2.原理
Al作还原剂,另一种氧化物作氧化剂,用铝将氧化物中的金属置换出来。
3.铝热剂
铝粉和某些金属氧化物(Fe3O4、Cr2O3、V2O5等)组成的混合物。
4.反应特点
在高温下进行,反应迅速并放出大量的热,新生成的金属单质呈熔融态且易与Al2O3分离。
5.应用
冶炼难熔的相对较不活泼的金属,如V、Cr、Mn等;焊接钢轨等。
6.实验
典例题组训练
题组一 金属的冶炼
1.冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2或CO)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。其中对它们的冶炼方法的分析中不正确的是( B )
A.(Ⅰ)① B.(Ⅱ)②
C.(Ⅲ)③ D.(Ⅳ)④
解析:(Ⅰ
)孔雀石的主要成分是碱式碳酸铜,灼热分解的产物CuO,可用①焦炭还原成Cu,Cu2(OH)2CO32CuO+CO2↑+H2O,2CuO+C2Cu+CO2↑,(Ⅱ)将铜盐溶液中的Cu2+,用③活泼的金属置换出来:Fe+CuSO4===FeSO4+Cu,(Ⅲ)将三氧化二铬中的铬,用③活泼金属Al置换出来:Cr2O3+2AlAl2O3+2Cr,(Ⅳ)光卤石的主要成分是KCl·MgCl2·6H2O,从中得到MgCl2,再用④电解熔融的MgCl2得到Mg,MgCl2(熔融)Mg+Cl2↑。
2.(双选)下列金属冶炼的反应原理,错误的是( AB )
A.2AlCl3(熔融)2Al+3Cl2↑
B.MgO+H2Mg+H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
解析:Al、Mg很活泼,应用电解法,但应该选用电解Al2O3的方法制备Al,A错误,B错误;铁属较活泼金属,可用热还原法,C正确;较不活泼金属汞可用热分解法,D正确。
(1)金属冶炼与金属活动性的关系:
(2)热还原法中使用的还原剂通常是碳单质、一氧化碳和氢气等。在高炉炼铁中,加入的还原剂是焦炭,但真正作还原剂的是CO。
题组二 铝热反应
3.如图所示,用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:Fe2O3+2AlAl2O3+2Fe,在该反应中Fe2O3是氧化剂,Al是还原剂,该反应称为铝热反应。
(2)选出该实验的实验现象(填写在横线上):①②③④。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:
使熔融物易于落下;蒸发皿盛沙:防止溅落物炸裂蒸发皿;镁条:Mg燃烧放出大量的热使氯酸钾分解;氯酸钾:引发铝热反应。
解析:(1)铝热反应为2Al+Fe2O32Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
(2)①②③④全为该铝热反应的现象。
(3)铝热反应实验中①为使熔融物易落下通常在内层纸漏斗底部剪一个孔;②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙子;③反应中镁条引起氯酸钾分解;④氯酸钾引发铝热反应。
4.如图是铝热反应(2Al+Fe2O3Al2O3+2Fe)的实验装置,有关该反应的下列说法中正确的是( AB )
A.a为镁条
B.b为KClO3
C.2 mol氧化剂参与反应则转移6NA个电子
D.还原剂与氧化产物的物质的量之比为12
解析:a为镁条,起引燃作用,故A正确;b为氯酸钾,故B正确;在铝热反应中氧化剂是氧化铁,2 mol氧化剂参与反应则转移12NA个电子,故C错误;该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为21,故D错误。
(1)Fe2O3与Al的反应叫做“铝热反应”,Fe2O3和Al的混合物叫做“铝热剂”。与三氧化二铁性质相似的氧化亚铁(FeO)、四氧化三铁(Fe3O4)、氧化铜(CuO)、二氧化钛(TiO2)、五氧化二钒(V2O5)、三氧化二铬(Cr2O3)、二氧化锰(MnO2)、四氧化三钴(Co3O4)、三氧化钨(WO3)等氧化物,也都能与金属铝在高温下发生氧化还原反应,生成三氧化二铝和新的金属单质,放出大量的热,这样的反应都属于铝热反应。
3Fe3O4+8Al4Al2O3+9Fe
3CuO+2AlAl2O3+3Cu
3MnO2+4Al2Al2O3+3Mn
3V2O5+10Al5Al2O3+6V
3Co3O4+8Al4Al2O3+9Co
3TiO2+4Al2Al2O3+3Ti
Cr2O3+2AlAl2O3+2Cr
(2)铝热反应一般有两个方面的重要应用:一是冶炼高熔点的金属;二是焊接金属,如用Fe2O3和Al的混合物做焊药(“铝热剂”)焊接铁路钢轨等(如图)。
核心素养
金属冶炼的方法
提醒:①冶炼Mg时电解熔融MgCl2而不电解MgO,原因是MgO的熔点高,熔融时耗费更多能源,增加生产成本。
②冶炼Al时只能电解熔融Al2O3而不能电解AlCl3,原因是AlCl3是共价化合物,熔融态不导电;加入冰晶石(Na3AlF6)的目的是降低Al2O3的熔化温度。
③用热还原法得到的铜还要经过电解精炼才能得到精铜。
【例1】 下表中金属的冶炼原理与方法不完全正确的是( )
选项
冶炼原理
方法
A
2HgO2Hg+O2↑
热分解法
B
2Al2O3(熔融)4Al+3O2↑
电解法
(续表)
选项
冶炼原理
方法
C
Cu2S+O22Cu+SO2
热分解法
D
Fe2O3+3CO2Fe+3CO2
热还原法
【解析】 Hg为不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,A正确;Al为活泼金属,通常用电解熔融的金属化合物的方法冶炼,但氧化铝的熔点较高,加入冰晶石的目的是降低熔点,B正确;Cu2S+O22Cu+SO2,该反应不属于分解反应,所以采用的不是热分解法,C错误;高温下用CO作还原剂冶炼铁,属于热还原法,D正确。
【答案】 C
【例2】 (双选)科学家研制出了一种新型的贮氢材料,这种镁铝合金的成分可表示为Mg17Al12;其贮氢和释氢的原理可表示为Mg17Al12+17H217MgH2+12Al,下列有关说法正确的是( )
A.Mg17Al12是合金而不是离子化合物
B.为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气
C.732 g的合金能吸收380.8 L氢气
D.该合金的熔点比镁和铝的熔点低
【解析】 合金是加热熔合而成的,不存在阴阳离子,不属于离子化合物,A项正确;Mg、Al为较活泼金属,加热时易和氮气发生反应,可以通入氩气来防止金属被氧化,不可以通氮气做保护气,B项错误;氢气所处的状况未知,不能计算出氢气的具体体积,C项错误;合金的熔点比各成分的熔点低,该合金的熔点低于金属镁、金属铝的熔点,D项正确。
【答案】 AD
相关文档
- 2020高中化学 期末君之讲稿(十一)海2021-07-024页
- 2020高中化学 研究有机化合物的一2021-07-026页
- 人教版高中化学必修一知识点总结2021-07-0219页
- 2020版高中化学 第三章学业分层测2021-07-026页
- 高中化学人教版必修2(练习)1_3 化学2021-07-0215页
- 高中化学必修2同步巩固练习解析:2-12021-07-028页
- 高中化学人教版选修一(学业分层测评2021-07-027页
- 人教版高中必修一化学课件:4_4_2硝2021-07-0215页
- 高中化学第1章化学反应与能量转化2021-07-0264页
- 高中化学教案新人教版必修2 元素周2021-07-024页