- 172.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
铁和铁的化合物 综合
班级:___________ 姓名:______________ 小组:_______________
【学习目标】了解铁和铁的化合物的相互转换
【重点难点】了解铁和铁的化合物的相互转换
【导学流程】
一、 基础感知
铁位于元素周期表中第4周期,第Ⅷ族,失电子情况: Fe-2e-→Fe2+或Fe-3e-→Fe3+。
因而铁是中等活动性的金属,具有可变化合价(+2或+3),在学习中,要牢牢抓住铁的变价特征。
铁及其重要化合物的转化关系:
一、铁的单质化学性质
铁是比较活泼的金属,当铁跟弱氧化剂反应时:Fe-2e-=Fe2+;当跟强氧化剂反应时:Fe-3e-=Fe3+。
1.铁跟氧气等其它非金属单质的反应:
Fe+O2 (一定要注意产物)
Fe+Cl2 Fe+Br2= Fe+I2= Fe+S
2.铁跟水的反应:Fe+H2O 钠与水 镁与水
3.铁跟酸的反应:
①与非氧化性酸:Fe+2H+=
②足量强氧化性酸:Fe+HNO3(稀)= 与少量稀硝酸
铁和冷浓硝酸、冷浓H2SO4
3
发生钝化,但在加热条件下,钝化作用立即遭到破坏:
4.铁和某些盐溶液的作用:
Fe+Cu2+= Fe+Fe3+=
二、铁的氧化物
铁的氧化物
FeO
Fe3O4
Fe2O3
铁的化合价
+2价
+2价(1/3),+3价(2/3)
+3价
俗 称
——
磁性氧化铁
铁红
状态和颜色
黑色固体
黑色晶体
红棕色固体
与H2O的关系
不反应,不溶解
与非氧化性酸的反应
FeO+2H+=Fe2++H2O Fe3O4+8H+=Fe2++2Fe3++4H2O Fe2O3+6H+=2Fe3++3H2O
氧化性
高温下被CO、H2、Al、C、Si等还原
还原性
被热空气氧化成Fe3O4等
可被氧化性酸、盐等氧化
一般不再被氧化
主要用途
——
炼铁
炼铁、作热剂、颜料
说 明
Fe3O4可以看作由FeO、Fe2O3所组成的化合物,其中是Fe2+,是Fe3+
三、铁的氢氧化物
1.Fe(OH)2可由易溶性的亚铁盐跟碱溶液起反应制得。Fe(OH)2为白色絮状沉淀,易被空气中O2迅速氧化成Fe(OH)3。因此,白色絮状沉淀能迅速变成灰绿色,最终变成红褐色。
Fe2++2OH-=Fe(OH)2↓,Fe(OH)2+O2+H2O=
制备时:
(1)要将滴管口插入硫酸亚铁液面下,再滴入NaOH溶液;
(2)配液时可用加热的方法尽可能除去溶解氧;
(3)可在液面加少许汽油或苯等有机溶剂,以隔绝空气。
2.Fe(OH)3可由易溶性的铁盐跟碱液起反应制得。Fe(OH)3为红褐色沉淀
3
,可溶于强酸,受热易分解。
Fe3++3OH-=Fe(OH)3↓,Fe(OH)3+3H+=Fe3++3H2O,2Fe(OH)3Fe2O3+3H2O
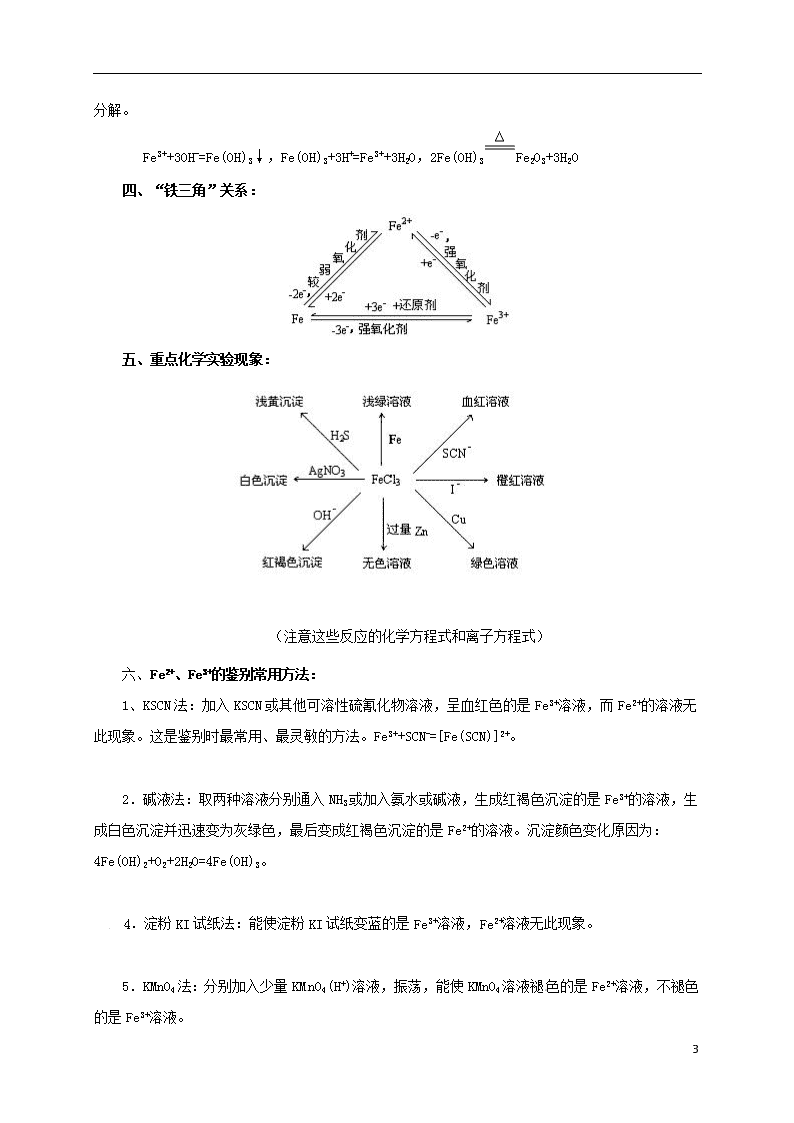
四、“铁三角”关系:
五、重点化学实验现象:
(注意这些反应的化学方程式和离子方程式)
六、 Fe2+、Fe3+的鉴别常用方法:
1、KSCN法:加入KSCN或其他可溶性硫氰化物溶液,呈血红色的是Fe3+溶液,而Fe2+的溶液无此现象。这是鉴别时最常用、最灵敏的方法。Fe3++SCN-=[Fe(SCN)]2+。
2.碱液法:取两种溶液分别通入NH3或加入氨水或碱液,生成红褐色沉淀的是Fe3+的溶液,生成白色沉淀并迅速变为灰绿色,最后变成红褐色沉淀的是Fe2+的溶液。沉淀颜色变化原因为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
4.淀粉KI试纸法:能使淀粉KI试纸变蓝的是Fe3+溶液,Fe2+溶液无此现象。
5.KMnO4法:分别加入少量KMnO4(H+)溶液,振荡,能使KMnO4溶液褪色的是Fe2+溶液,不褪色的是Fe3+溶液。
3
相关文档
- 新教材高中化学第二章海水中的中盐2021-07-026页
- 2020高中化学 期末君之讲稿(十一)海2021-07-024页
- 2020高中化学 研究有机化合物的一2021-07-026页
- 人教版高中化学必修一知识点总结2021-07-0219页
- 2020版高中化学 第三章学业分层测2021-07-026页
- 高中化学人教版必修2(练习)1_3 化学2021-07-0215页
- 高中化学必修2同步巩固练习解析:2-12021-07-028页
- 高中化学人教版选修一(学业分层测评2021-07-027页
- 人教版高中必修一化学课件:4_4_2硝2021-07-0215页
- 高中化学第1章化学反应与能量转化2021-07-0264页