- 1.70 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
讲
离子反应
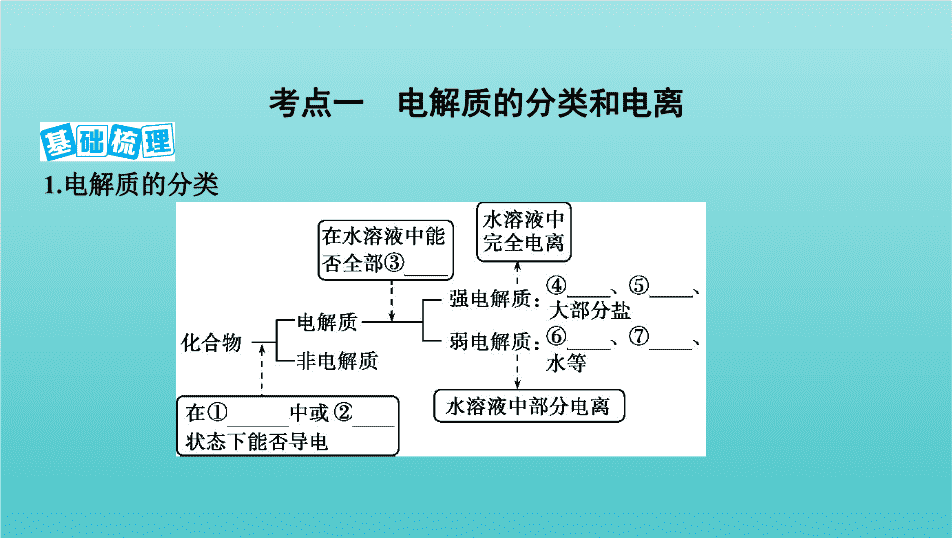
1.电解质的分类
考点一 电解质的分类和电离
2.电解质的电离
(1)电离
电解质在水溶液中或熔融状态下,离解成⑧
自由移动
的离子的过程。
(2)电离方程式
1.
易错易混辨析(正确的画“√”,错误的画“
✕
”)。
(1)氨水导电,液氨不导电,所以氨水是电解质
(
✕
)
(2)液氯不导电,氯水导电是因为氯气与水反应生成的电解质电离,故氯气是
非电解质
(
✕
)
(3)强电解质都是离子化合物,弱电解质都是共价化合物
(
✕
)
(4)HClO是弱酸,故NaClO是弱电解质
(
✕
)
(5)H
2
SO
4
是强电解质,故浓硫酸具有很强的导电性
(
✕
)
(6)盐酸的导电性一定强于醋酸溶液的导电性
(
✕
)
(7)NaCl溶液在电流的作用下电离成钠离子和氯离子
(
✕
)
2.
【深度思考】
今有15种物质:①Fe ②稀硝酸 ③HNO
3
④液氨 ⑤SO
2
⑥空气 ⑦NaCl ⑧BaSO
4
⑨Na
2
CO
3
⑩乙醇
Al
2
O
3
石墨
NaOH
氨水
Na
2
O
2
。
按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
序号
符合的条件
物质的序号
(1)
混合物
(2)
电解质,但熔融状态下并不导电
(3)
电解质,熔融状态下能导电
(4)
电解质,但难溶于水
(5)
非电解质
(6)
既不是电解质,也不是非电解质,但能导电
答案 (1)②⑥
(2)③ (3)⑦⑧⑨
(4)⑧
(5)④⑤⑩ (6)①②
1.
下表中物质的分类组合完全正确的是
(
A
)
选项
A
B
C
D
强电解质
KNO
3
H
2
SO
4
BaSO
4
HClO
4
弱电解质
HF
CaCO
3
HClO
CH
3
COONH
4
非电解质
SO
2
Al
H
2
O
C
2
H
5
OH
答案
A B项中的CaCO
3
属于强电解质,Al为单质,既不属于电解质,也不属
于非电解质;C项中H
2
O为弱电解质;D项中CH
3
COONH
4
为强电解质。
2.
下列物质在指定条件下电离方程式书写正确的是
(
D
)
A.Na
2
CO
3
溶于水 Na
2
CO
3
N
+C
B.Al(OH)
3
酸式电离 Al(OH)
3
H
+
+Al
+H
2
O
C.NaHS溶于水后HS
-
的电离 HS
-
+H
2
O
H
2
S+OH
-
D.NaHSO
4
加热熔化 NaHSO
4
Na
+
+HS
答案
D A项,应为Na
2
CO
3
2Na
+
+C
;B项,应用可逆符号;C项是HS
-
的
水解方程式。
3.
写出下列物质的电离方程式。
(1)H
2
SO
4
:
;
(2)H
2
SO
3
:
;
(3)HF:
;
(4)Ca(OH)
2
:
;
(5)Mg(OH)
2
:
;
(6)CH
3
COOH:
;
(7)NaHS(溶于水):
;
(8)Ca(HSO
4
)
2
(溶于水):
;
(9)Al
2
O
3
(熔融):
;
(10)KAl(SO
4
)
2
:
。
答案
(1)H
2
SO
4
2H
+
+S
(2)H
2
SO
3
H
+
+HS
、HS
H
+
+S
(3)HF
H
+
+F
-
(4)Ca(OH)
2
Ca
2+
+2OH
-
(5)Mg(OH)
2
Mg
2+
+2OH
-
(6)CH
3
COOH
H
+
+CH
3
COO
-
(7)NaHS
Na
+
+HS
-
、HS
-
H
+
+S
2-
(8)Ca(HSO
4
)
2
Ca
2+
+2H
+
+2S
(9)Al
2
O
3
2Al
3+
+3O
2-
(10)KAl(SO
4
)
2
K
+
+Al
3+
+2S
规律方法
书写电离方程式“三注意”
(1)注意符合客观事实,不能随意书写离子符号。
(2)注意质量守恒:电离方程式两边原子种类、数目不变。
(3)注意电荷守恒:电离方程式右侧的电荷总数等于左侧的电荷总数。
4.
今有下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后
面括号中。
题组二 溶液导电性变化分析
(1)向H
2
SO
4
溶液中加入等体积、等物质的量浓度的Ba(OH)
2
溶液
( )
(2)向H
2
SO
3
溶液中通入Cl
2
直至过量
( )
(3)向AgNO
3
溶液中通入少量HBr
( )
(4)向氨水中通入HCl直至过量
( )
(5)向NaOH溶液中通入少量Cl
2
( )
(6)向饱和石灰水中不断通入SO
2
( )
答案
(1)④ (2)② (3)③ (4)② (5)③ (6)①
5.
在两份相同的Ba(OH)
2
溶液中,分别滴入物质的量浓度相等的H
2
SO
4
、NaH-
SO
4
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正
确的是
(
C
)
A.①代表滴加H
2
SO
4
溶液的变化曲线
B.b点,溶液中大量存在的离子是Na
+
、OH
-
C.c点,两溶液中含有相同量的OH
-
D.a、d两点对应的溶液均显中性
答案
C 本题考查溶液混合时酸碱性的判断、溶液的导电能力判断。两
个过程涉及的反应有Ⅰ:Ba(OH)
2
+H
2
SO
4
BaSO
4
↓+2H
2
O,Ⅱ:Ba(OH)
2
+
NaHSO
4
BaSO
4
↓+NaOH+H
2
O,Ⅲ:NaHSO
4
+NaOH
Na
2
SO
4
+H
2
O。从
反应Ⅰ知,当氢氧化钡和硫酸恰好反应完全时,溶液的导电能力最弱,故曲线
①表示滴加硫酸的变化曲线,A正确。反应至b点时等物质的量的氢氧化钡和
硫酸氢钠恰好完全反应,B正确。曲线①c点溶液中溶质为硫酸,溶液呈酸性,
曲线②c点溶液中溶质为NaOH和Na
2
SO
4
,溶液呈碱性,故两溶液中不可能含有
相同量的OH
-
,C错误。a点对应的“溶液”为水,d点对应的溶液为Na
2
SO
4
溶
液,均显中性,D正确。
技法总结
金属导电与电解质溶液导电的原因
(1)金属能导电是因为自由电子在电场作用下定向移动,温度升高,金属阳离
子振动幅度增大,自由电子定向移动阻力增大,金属导电性变弱。
(2)电解质溶液能导电是因为溶液中有自由移动的离子存在。电解质溶液导
电能力的强弱,取决于溶液中自由移动离子的浓度和离子所带的电荷数,和电
解质的强弱没有必然联系。对于弱电解质溶液,温度升高时,弱电解质电离程
度增大,离子浓度增大,导电性会增强。
考点二 离子方程式的书写及正误判断
1.离子反应
(1)定义:有①
离子参加
或有②
离子生成
的反应。
(2)类型:
2.离子方程式
(1)书写步骤(以CaCO
3
与盐酸的反应为例)
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离
子反应,如氢氧化钠溶液和盐酸反应、氢氧化钙溶液和硝酸反应的离子方程
式都可用
H
+
+OH
-
H
2
O
来表示。
(3)物质“拆分”原则
书写离子方程式时,氧化物、过氧化物、弱电解质、多元弱酸的酸根离子、
沉淀、气体、非电解质在离子方程式中均不能拆分,易电离的强电解质(强
酸、强碱、大多数可溶性盐)拆成离子形式。
(2)意义
强酸
HNO
3
、H
2
SO
4
、HClO
4
、HCl、HBr、HI(浓盐酸、浓硝酸在离子方程式中可拆,浓硫酸一般不拆)
弱酸
H
2
CO
3
、H
2
SiO
3
、CH
3
COOH、H
2
C
2
O
4
、HClO、HF、H
2
S、H
2
SO
3
A.常见的强酸、弱酸
B.常见的强碱、弱碱
强碱
NaOH、KOH、Ba(OH)
2
、Ca(OH)
2
弱碱
NH
3
·H
2
O、Mg(OH)
2
、Fe(OH)
3
C.酸式盐
a.弱酸的酸式酸根离子不能拆开,如HC
、HS
-
、HS
等。
b.强酸的酸式酸根离子在水溶液中写成拆分形式。如NaHSO
4
应写成Na
+
、H
+
和S
;而NaHSO
4
在熔融状态下应写成Na
+
和HS
。
D.微溶物在离子方程式中的书写方法
微溶物出现在反应物中时,澄清溶液可以拆,悬浊液不可拆;微溶物出现在生
成物中时当沉淀处理,不可拆。
如:澄清石灰水与盐酸反应的离子方程式:H
+
+OH
-
H
2
O;用石灰乳制漂白
粉的离子方程式:Ca(OH)
2
+Cl
2
Ca
2+
+Cl
-
+ClO
-
+H
2
O。
及时提醒 ①盐类水解的离子方程式用“
”而不用“
”。
②熟记四种常见的微溶物是Ag
2
SO
4
、CaSO
4
、MgCO
3
、Ca(OH)
2
。
1.
(1)在稀硫酸中分别加入下列物质,能发生反应的请写出有关反应的离子方程式。
①加入Zn粒:
;
②加入NaOH溶液:
;
③加入BaCl
2
溶液:
;
④加入CH
3
COONa溶液:
;
⑤加入Na
2
CO
3
溶液:
。
(2)①~⑤中,混合后溶液中S
的物质的量减少的是
(填序号,
下同);H
+
的物质的量减少的是
。
答案
(1)①Zn+2H
+
Zn
2+
+H
2
↑
②H
+
+OH
-
H
2
O
③Ba
2+
+S
BaSO
4
↓
④CH
3
COO
-
+H
+
CH
3
COOH
⑤C
+2H
+
CO
2
↑+H
2
O
(2)③ ①②④⑤
2.
【深度思考】
向0.1 mol·L
-1
的KHSO
4
溶液中逐滴加入0.1 mol·L
-1
的Ba(OH)
2
溶液。
(1)当S
恰好完全沉淀时的离子方程式:
。
(2)当溶液呈中性时的离子方程式:
。
答案
(1)H
+
+S
+Ba
2+
+OH
-
BaSO
4
↓+H
2
O
(2)2H
+
+S
+Ba
2+
+2OH
-
BaSO
4
↓+2H
2
O
1.
写出下列典型反应的离子方程式。
(1)氯化铝溶液中加入过量氨水:
。
(2)小苏打与乙酸溶液混合:
。
(3)澄清石灰水中加入盐酸:
。
(4)Cl
2
通入水中:
。
(5)实验室用浓盐酸与MnO
2
共热制Cl
2
:
。
(6)在石灰乳中加入Na
2
CO
3
溶液:
。
题组一 离子方程式的书写
(7)NaHCO
3
溶液与稀盐酸混合:
。
(8)FeCl
3
溶液与Cu反应:
。
(9)Ba(OH)
2
溶液与(NH
4
)
2
SO
4
溶液混合:
。
(10)Fe
2
O
3
溶于HI溶液中:
。
(11)FeO溶于稀HNO
3
中:
。
(12)磁性氧化铁溶于稀硝酸中:
。
答案
(1)Al
3+
+3NH
3
·H
2
O
Al(OH)
3
↓+3N
(2)HC
+CH
3
COOH
CH
3
COO
-
+CO
2
↑+H
2
O
(3)OH
-
+H
+
H
2
O
(4)Cl
2
+H
2
O
H
+
+Cl
-
+HClO
(5)4H
+
+2Cl
-
+MnO
2
Cl
2
↑+2H
2
O+Mn
2+
(6)Ca(OH)
2
+C
CaCO
3
+2OH
-
(7)HC
+H
+
H
2
O+CO
2
↑
(8)2Fe
3+
+Cu
2Fe
2+
+Cu
2+
(9)Ba
2+
+2OH
-
+2N
+S
BaSO
4
↓+2NH
3
·H
2
O
(10)Fe
2
O
3
+6H
+
+2I
-
2Fe
2+
+I
2
+3H
2
O
(11)3FeO+10H
+
+N
3Fe
3+
+NO↑+5H
2
O
(12)3Fe
3
O
4
+28H
+
+N
9Fe
3+
+NO↑+14H
2
O
2.
写出下列与量有关的反应的离子方程式。
(1)酸性氧化物与碱溶液反应。如CO
2
通入澄清石灰水中:
CO
2
少量:
;
CO
2
过量:
。
(2)多元弱酸盐与强酸反应。如Na
2
CO
3
溶液与稀盐酸反应:
盐酸少量:
;
盐酸过量:
。
(3)铝盐溶液与强碱溶液反应。如AlCl
3
溶液与NaOH溶液反应:
NaOH溶液少量:
;
NaOH溶液过量:
。
(4)NaAlO
2
溶液与强酸溶液反应。如NaAlO
2
溶液与盐酸反应:
盐酸少量:
;
盐酸过量:
。
(5)CO
2
通入NaAlO
2
溶液中:
CO
2
少量:
;
CO
2
过量:
。
(6)Fe与稀硝酸反应:
Fe少量:
;
Fe过量:
。
(7)FeI
2
溶液与Cl
2
反应:
Cl
2
少量:
;
Cl
2
过量:
。
(8)Ca(HCO
3
)
2
溶液与NaOH溶液混合:
NaOH少量:
;
NaOH过量:
。
(9)NH
4
Al(SO
4
)
2
溶液与Ba(OH)
2
溶液反应:
①
n
[NH
4
Al(SO
4
)
2
]∶
n
[Ba(OH)
2
]=1∶1:
。
②
n
[NH
4
Al(SO
4
)
2
]∶
n
[Ba(OH)
2
]=1∶2:
。
③
n
[NH
4
Al(SO
4
)
2
]∶
n
[Ba(OH)
2
]=1∶3:
。
(10)向含有H
+
、Al
3+
、N
的溶液中,逐滴加入NaOH溶液至过量,反应的离子
方程式依次为:
;
;
;
。
答案
(1)CO
2
+Ca
2+
+2OH
-
CaCO
3
↓+H
2
O CO
2
+OH
-
HC
(2)C
+H
+
HC
C
+2H
+
H
2
O+CO
2
↑
(3)Al
3+
+3OH
-
Al(OH)
3
↓ Al
3+
+4OH
-
Al
+2H
2
O
(4)Al
+H
+
+H
2
O
Al(OH)
3
↓
Al
+4H
+
Al
3+
+2H
2
O
(5)2Al
+CO
2
+3H
2
O
2Al(OH)
3
↓+C
Al
+CO
2
+2H
2
O
Al(OH)
3
↓
+HC
(6)Fe+N
+4H
+
Fe
3+
+NO↑+2H
2
O 3Fe+2N
+8H
+
3Fe
2+
+2NO↑+4H
2
O
(7)2I
-
+Cl
2
2Cl
-
+I
2
2Fe
2+
+4I
-
+3Cl
2
2Fe
3+
+2I
2
+6Cl
-
(8)HC
+OH
-
+Ca
2+
CaCO
3
↓+H
2
O 2HC
+2OH
-
+Ca
2+
CaCO
3
↓+C
+2H
2
O
(9)2Al
3+
+3S
+3Ba
2+
+6OH
-
3BaSO
4
↓+2Al(OH)
3
↓
N
+Al
3+
+2S
+2Ba
2+
+4OH
-
2BaSO
4
↓+Al(OH)
3
↓+NH
3
·H
2
O N
+Al
3+
+2S
+2Ba
2+
+5OH
-
2BaSO
4
↓+NH
3
·H
2
O+Al
+2H
2
O
(10)H
+
+OH
-
H
2
O Al
3+
+3OH
-
Al(OH)
3
↓ N
+OH
-
NH
3
·H
2
O
Al(OH)
3
+OH
-
Al
+2H
2
O
题后悟道
与量有关的离子方程式的种类与书写思路
(1)先后型:向FeBr
2
溶液中通入氯气,氯气少量时Fe
2+
首先反应,Cl
2
过量时Fe
2+
和
Br
-
均反应;向FeI
2
溶液中通入氯气,氯气少量时I
-
首先反应,Cl
2
过量时Fe
2+
和I
-
均
反应。向NH
4
HCO
3
溶液中加入NaOH溶液,首先是HC
与OH
-
发生中和反应,
然后是N
与OH
-
反应。
(2)配比型:两种物质比例不同,反应的离子方程式不同。这种离子反应的书
写可用“定一法”书写,将量少的物质化学计量数定为1,如向Ca(HCO
3
)
2
溶液
中加入过量NaOH溶液的离子方程式的书写:
题组二 离子方程式的正误判断
3.
反应是否符合客观事实,判断正误(正确的画“√”,错误的画“
✕
”)。
(1)将Na投入到CuSO
4
溶液中:2Na+Cu
2+
2Na
+
+Cu
(
✕
)
(2)Fe和稀盐酸反应:2Fe+6H
+
2Fe
3+
+3H
2
↑
(
✕
)
(3)Zn和浓硫酸反应:Zn+2H
+
H
2
↑+Zn
2+
(
✕
)
(4)Fe(OH)
3
和HI的反应:Fe(OH)
3
+3H
+
Fe
3+
+3H
2
O
(
✕
)
(5)NaHCO
3
的水解:HC
+H
2
O
H
2
CO
3
+OH
-
(
✕
)
(6)向NaClO溶液中通入少量SO
2
:2ClO
-
+H
2
O+SO
2
2HClO+S
(
✕
)
(7)向稀HNO
3
中滴加Na
2
SO
3
溶液:S
+2H
+
SO
2
↑+H
2
O(
✕
)
(8)AlCl
3
溶液中加入过量稀氨水:Al
3+
+4NH
3
·H
2
O
Al
+4N
+2H
2
O
(
✕
)
4.
化学式拆分是否正确,判断正误(正确的画“√”,错误的画“
✕
”)。
(1)向CuSO
4
溶液中通入H
2
S气体:Cu
2+
+S
2-
CuS↓
(
✕
)
(2)氯气溶于水:Cl
2
+H
2
O
2H
+
+Cl
-
+ClO
-
(
✕
)
(3)NaHCO
3
溶液中加入稀盐酸:C
+2H
+
CO
2
↑+H
2
O
(
✕
)
(4)硫酸铝溶液中加入过量氨水:Al
3+
+3OH
-
Al(OH)
3
↓
(
✕
)
(5)Na
2
O
2
固体与水反应:2
+2H
2
O
4OH
-
+O
2
↑
(
✕
)
(6)Mg(OH)
2
与醋酸的反应:OH
-
+H
+
H
2
O
(
✕
)
(7)碳酸锌溶于稀硝酸:C
+2H
+
H
2
O+CO
2
↑
(
✕
)
5.
反应是否符合守恒,判断正误(正确的画“√”,错误的画“
✕
”)。
(1)锌片插入硝酸银溶液中:Zn+Ag
+
Zn
2+
+Ag
(
✕
)
(2)向FeCl
2
溶液中通入Cl
2
:Fe
2+
+Cl
2
Fe
3+
+2Cl
-
(
✕
)
(3)向水中加入一小块钠:Na+2H
2
O
Na
+
+2OH
-
+H
2
↑
(
✕
)
(4)向稀硝酸中加入铜片:Cu+2H
+
+N
Cu
2+
+NO↑+H
2
O(
✕
)
(5)Fe
2+
与H
2
O
2
在酸性溶液中的反应:2Fe
2+
+H
2
O
2
+2H
+
2Fe
3+
+2H
2
O
(
√
)
(6)MnO
2
和浓盐酸混合加热:MnO
2
+4H
+
+2Cl
-
Mn
2+
+2H
2
O+Cl
2
↑
(
√
)
(7)Na
2
O
2
与H
2
O反应制备O
2
:Na
2
O
2
+H
2
O
2Na
+
+2OH
-
+O
2
↑
(
✕
)
(8)用
过氧化氢从酸化的海带灰浸出液中提取碘
:2I
-
+H
2
O
2
+2H
+
I
2
+2H
2
O (
√
)
6.
反应物的用“量”对产物有何影响,判断正误(正确的画“√”,错误的画
“
✕
”。
(1)向FeI
2
溶液中通入少量Cl
2
:2Fe
2+
+Cl
2
2Fe
3+
+2Cl
-
(
✕
)
(2)向Ca(ClO)
2
溶液中通入少量CO
2
:ClO
-
+CO
2
+H
2
O
HClO+HC
(
✕
)
(3)向NaAlO
2
溶液中通入少量CO
2
:2Al
+CO
2
+3H
2
O
2Al(OH)
3
↓+C
(
√
)
(4)向盐酸中滴加少量NaAlO
2
溶液:H
+
+Al
+H
2
O
Al(OH)
3
↓
(
✕
)
(5)少量SO
2
和NaOH溶液反应:SO
2
+OH
-
HS
(
✕
)
(6)向Na
2
CO
3
溶液中滴入少量盐酸:C
+2H
+
H
2
O+CO
2
↑(
✕
)
(7)少量Ca(OH)
2
溶液和NaHCO
3
溶液反应:Ca
2+
+OH
-
+HC
CaCO
3
↓+H
2
O
(
✕
)
(8)NH
4
HSO
3
溶液与NaOH溶液等物质的量反应:N
+HS
+2OH
-
NH
3
·H
2
O
+S
(
✕
)
题后悟道
离子方程式正误判断的一般思路
考点三 离子共存
1.离子共存的条件
几种离子在同一溶液中大量共存,指离子之间①
不反应
;若离子之间能
②
发生反应
,则不能大量共存。
2.分析离子能否大量共存必备知识
(1)中学常见的四种有颜色的离子
③
Mn
(紫红色)、④
Cu
2+
(蓝色)、⑤
Fe
3+
(棕黄色)、⑥
Fe
2+
(浅绿色)。
(2)常见的表示溶液呈酸性的表述
a.pH=1的溶液(常温下);
b.使pH试纸变⑦
红
的溶液;
c.使甲基橙呈⑧
红色
的溶液;
d.与镁粉反应放出⑨
氢气
的溶液;
e.
c
(OH
-
)=1
×
10
-14
mol/L的溶液(常温下)。
(3)常见的表示溶液呈碱性的表述
a.pH=14的溶液(常温下);
b.使pH试纸变⑩
蓝
的溶液;
c.使酚酞试液变
红
的溶液;
d.
c
(H
+
)=1
×
10
-14
mol/L的溶液(常温下)。
(4)常见的表示溶液可能呈酸性也可能呈碱性的表述
a.与铝粉反应放出
氢气
的溶液;
b.由水电离出的
c
(OH
-
)=1
×
10
-12
mol/L的溶液(常温下);
c.与NH
4
HCO
3
反应能产生气体的溶液。
3.判断离子能否大量共存的“四个要点”
(1)一色——溶液颜色,无色溶液中不存在有色离子。
(2)二性——溶液的酸、碱性
a.在强酸性溶液中,OH
-
及
弱酸根
离子(如C
、S
、S
2-
、CH
3
COO
-
等)均不能大量存在;
b.在强碱性溶液中,H
+
及
弱碱
阳离子(如N
、Al
3+
、Mg
2+
、Fe
3+
等)均不
能大量存在;
c.弱酸的
酸式酸根
离子(如HC
、HS
、HS
-
等)在强酸性和强碱性溶
液中均不能大量存在。
(3)三特殊——三种特殊情况
a.Al
与HC
不能大量共存,发生反应的离子方程式为
Al
+HC
+H
2
O
Al(OH)
3
↓+C
。
b.“N
+H
+
”组合具有强氧化性,能与S
2-
、Fe
2+
、I
-
、S
等具有还原性的离
子发生
氧化还原
反应而不能大量共存。
c.N
与CH
3
COO
-
、C
,Mg
2+
与HC
等组合中,虽然两种离子都能水解且水
解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存。
(4)四反应——四种反应类型
a.复分解反应,如Ba
2+
与S
、N
与OH
-
、H
+
与CH
3
COO
-
等不能大量共存。
b.氧化还原反应:如Fe
3+
与I
-
、S
2-
,N
(H
+
)与Fe
2+
等不能大量共存。
c.相互促进水解的反应:如Al
3+
与C
、HC
、Al
等不能大量共存。
d.配合反应:如Fe
3+
与SCN
-
等不能大量共存。
1.
易错易混辨析(正确的画“√”,错误的画“
✕
”)。
(1)
c
(H
+
)=0.1 mol·L
-1
的溶液中可能大量存在Na
+
、N
、S
、S
2
(
✕
)
(2)与铝粉反应放出H
2
的无色溶液中可能大量存在N
、Fe
2+
、Na
+
、S
(
✕
)
(3)使红色石蕊试纸变蓝的溶液中可能大量存在S
、C
、Na
+
、K
+
(
√
)
(4)常温下,
=1
×
10
-12
的溶液中可能大量存在K
+
、Al
、C
、Na
+
(
√
)
(5)使甲基橙变红色的溶液中可能大量存在Mg
2+
、K
+
、S
、S
(
✕
)
(6)0.1 mol·L
-1
的Na
2
CO
3
溶液中可能大量存在Al
3+
、S
、Cl
-
、K
+
(
✕
)
2.
【深度思考】
(1)OH
-
与N
不能大量共存是因为反应生成
;OH
-
与Fe
2+
、Fe
3+
、
Cu
2+
、Zn
2+
、Mg
2+
、Cr
3+
不能大量共存,是因为反应生成
;OH
-
与HC
、
HS
-
、HS
、HP
不能大量共存是因为分别生成
和H
2
O。
(2)H
+
不能与C
(HC
)、S
2-
(HS
-
)、S
(HS
)、ClO
-
、F
-
、CH
3
COO
-
大量共
存是因为生成
;H
+
与Si
不能大量共存是因为生成
沉淀;H
+
与Al
不能大量共存是因为生成
。
(3)C
不能和Ba
2+
、Ca
2+
大量共存是因为生成
;C
与Fe
3+
、Al
3+
不
能大量共存是因为
。
(4)S
与Ba
2+
不能大量共存主要是因为生成
沉淀;S
与Al
3+
不能大
量共存是因为
;S
与Mn
(H
+
)、N
(H
+
)、Fe
3+
不能大量共存是因为
。
答案
(1)NH
3
·H
2
O 沉淀 C
、S
2-
、S
、P
(2)弱电解质或弱离子 H
2
SiO
3
Al(OH)
3
或Al
3+
(3)沉淀 相互促进水解生成沉淀和气体
(4)BaSO
3
相互促进水解生成沉淀和气体 S
被氧化
题组一 无限制条件的离子共存的判断
1.
(2019河北唐山模拟)下列能大量共存的离子组是
(
A
)
A.K
+
、Al
、N
、Ba
2+
B.Na
+
、N
、Cl
-
、OH
-
C.K
+
、Mg
2+
、S
、C
D.H
+
、Na
+
、HC
、S
答案
A B项中的N
与OH
-
反应生成弱碱NH
3
·H
2
O而不能大量共存,错误;
C项中的Mg
2+
与C
反应生成MgCO
3
沉淀而不能大量共存,错误;D项中的H
+
与HC
反应生成CO
2
气体和弱电解质H
2
O而不能大量共存,错误。
2.
(2019湖北八校联考)下列各组澄清溶液中离子能大量共存,且加入(或滴入)
X试剂后发生反应的离子方程式书写正确的是(
B
)
选项
离子组
X试剂
离子方程式
A
K
+
、Na
+
、ClO
-
、S
少量SO
2
SO
2
+ClO
-
+H
2
O
S
+Cl
-
+2H
+
B
N
、Fe
3+
、Br
-
、S
过量H
2
S
2Fe
3+
+H
2
S
2Fe
2+
+S↓+2H
+
C
N
、Na
+
、
Fe
3+
、Al
过量铜粉
2Fe
3+
+Cu
2Fe
2+
+Cu
2+
D
K
+
、Na
+
、
HC
、Al
少量盐酸
H
+
+Al
+H
2
O
Al(OH)
3
↓
答案
B A项,由于SO
2
少量,ClO
-
相对过量,反应生成的H
+
会与过量的ClO
-
结
合成HClO,离子方程式应是SO
2
+3ClO
-
+H
2
O
S
+Cl
-
+2HClO;C项,N
、
Fe
3+
与Al
因相互促进水解而不能大量共存;D项,HC
与Al
不能大量共存,
二者可发生反应:HC
+Al
+H
2
O
Al(OH)
3
↓+C
。
技法总结
常见离子的性质归纳
颜色
Mn
(紫红)、Cu
2+
(蓝)、Fe
2+
(浅绿)、Fe
3+
(棕黄)
氧化性
ClO
-
、Mn
、N
(H
+
)、Fe
3+
、Cr
2
还原性
S
2-
(HS
-
)、S
(HS
)、I
-
、Br
-
、Cl
-
、Fe
2+
水解使溶液显酸性
N
、Mg
2+
、Al
3+
、Cu
2+
、Fe
2+
、Fe
3+
水解使溶液显碱性
Al
、S
2-
、S
、C
、Si
、ClO
-
、CH
3
COO
-
酸式酸根离子
HC
、HS
-
、HS
、HP
、H
2
P
3.
(2019福建泉州质检)在溶液中加入过量Na
2
O
2
后仍能大量共存的是
(
B
)
A.N
、Ba
2+
、Cl
-
、N
B.K
+
、Si
、Al
、S
C.Fe
2+
、Mg
2+
、SCN
-
、Cl
-
D.Na
+
、HC
、S
、I
-
题组二 题干中有限制条件的离子共存
答案
B 在溶液中加入过量Na
2
O
2
,发生反应:2Na
2
O
2
+2H
2
O
4Na
+
+4OH
-
+
O
2
↑。N
、OH
-
发生反应,不能大量共存,A错误;K
+
、Si
、Al
、S
、
OH
-
之间不反应,能大量共存,B正确;Na
2
O
2
可氧化Fe
2+
,且Fe
2+
、Mg
2+
均与OH
-
发
生反应,氧化生成的Fe
3+
还可与SCN
-
发生反应,不能大量共存,C错误;HC
、
OH
-
发生反应,Na
2
O
2
会氧化S
、I
-
,不能大量共存,D错误。
4.
(2019天津南开中学月考)常温下,下列各组离子能大量共存,当溶液中
c
(H
+
)=
10
-1
mol·L
-1
时,有气体产生;而当溶液中
c
(H
+
)=10
-13
mol·L
-1
时,又能生成沉淀。
该组离子可能是
(
A
)
A.Na
+
、Mg
2+
、N
、HC
、S
B.Pb
2+
、Ba
2+
、K
+
、Cl
-
、S
2-
C.Pb
2+
、Fe
2+
、Na
+
、S
、N
D.Al
3+
、N
、S
、Cl
-
、C
答案
A 常温下,在酸性溶液中HC
与H
+
反应放出二氧化碳,在碱性溶液
中,Mg
2+
与OH
-
反应生成氢氧化镁沉淀,A正确;Pb
2+
与S
2-
能够反应生成沉淀,不
能大量共存,B错误;Pb
2+
、S
能够反应生成沉淀,不能大量共存,C错误;Al
3+
与
C
相互促进水解而不能大量共存,D错误。
5.
(2019山东临沂一模)常温下,下列各组离子在指定溶液中一定能大量共存
的是
(
A
)
A.“84”消毒液中:Si
、C
、Na
+
、K
+
B.
=10
-12
的溶液中:N
、Ca
2+
、Cl
-
、N
C.0.1 mol·L
-1
NaAlO
2
溶液中:HC
、N
、S
、Fe
3+
D.pH=1的溶液中:Na
+
、K
+
、Cl
-
、S
2
题组三 选项中有限制条件的离子共存
答案
A “84”消毒液显碱性,在碱性溶液中,Si
、C
、Na
+
、K
+
可以
大量共存,A项正确;
=10
-12
的溶液显碱性,在碱性溶液中,OH
-
与N
会发
生反应生成NH
3
·H
2
O,B项错误;0.1 mol·L
-1
NaAlO
2
溶液中:HC
、Al
反应生
成C
和Al(OH)
3
沉淀,不能大量共存,C项错误;pH=1的溶液显酸性,在酸性溶
液中H
+
、S
2
会发生氧化还原反应生成S、SO
2
、H
2
O,D项错误。
6.
(2019河南实验中学预测)制备(NH
4
)
2
Fe(SO
4
)
2
·6H
2
O的实验中,需对过滤出产
品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应
后的溶液中主要存在的一组离子正确的是
(
D
)
A.通入过量Cl
2
:Fe
2+
、H
+
、N
、Cl
-
、S
B.加入少量NaClO溶液:N
、Fe
2+
、H
+
、S
、ClO
-
C.加入过量NaOH溶液:Na
+
、Fe
2+
、N
、S
、OH
-
D.加入过量NaClO和NaOH的混合溶液:Na
+
、S
、Cl
-
、ClO
-
、OH
-
答案
D Cl
2
会氧化Fe
2+
,A项错误;ClO
-
会氧化Fe
2+
,且H
+
会与ClO
-
结合成弱电
解质HClO,B项错误;OH
-
会与Fe
2+
反应生成Fe(OH)
2
沉淀,OH
-
也会与N
反应
生成NH
3
·H
2
O,C项错误;加入过量的ClO
-
会氧化Fe
2+
生成Fe
3+
和Cl
-
,过量的OH
-
会除去Fe
3+
和N
,最终溶液中含Na
+
、S
和Cl
-
,且ClO
-
和OH
-
均是过量的,故
D项正确。
1.
写出下列反应的离子方程式:
(1)(2019课标Ⅰ)pH=6.5时,用碳酸铵溶液与Mg
2+
反应生成Mg(OH)
2
·MgCO
3
沉
淀的离子反应为:
。
(2)(2019课标Ⅱ)硫化钡溶液与硫酸锌溶液发生反应制取立德粉(ZnS·BaSO
4
)
的离子方程式:
。
(3)(2019课标Ⅲ)硫酸锰与碳酸氢铵反应“沉锰”的离子方程式:
。
真题演练
·
模拟预测
答案
(1)2Mg
2+
+2H
2
O+3C
Mg(OH)
2
·MgCO
3
↓+2HC
[或2Mg
2+
+H
2
O+
2C
Mg(OH)
2
·MgCO
3
↓+CO
2
↑]
(2)S
2-
+Ba
2+
+Zn
2+
+S
ZnS·BaSO
4
↓
(3)Mn
2+
+2HC
MnCO
3
↓+CO
2
↑+H
2
O
2.
(不定项)含下列离子组的溶液中加入相应试剂后,发生反应的离子方程式
正确的是
(
BD
)
离子组
加入试剂
离子方程式
A
Cu
2+
、S
Ba(OH)
2
溶液
Ba
2+
+S
BaSO
4
↓
B
Al
3+
、N
过量氨水
Al
3+
+3NH
3
·H
2
O
Al(OH)
3
↓+3N
C
Fe
3+
、Cl
-
铁粉
Fe
3+
+Fe
2Fe
2+
D
Fe
2+
、I
-
足量新制氯水
3Cl
2
+2Fe
2+
+4I
-
6Cl
-
+2Fe
3+
+2I
2
答案
BD 离子方程式为Ba
2+
+S
+Cu
2+
+2OH
-
BaSO
4
↓+Cu(OH)
2
↓,故
A错误;电荷不守恒,离子方程式应为2Fe
3+
+Fe
3Fe
2+
,故C错误。
相关文档
- 化学理卷·2019届福建省厦门市湖滨2021-07-028页
- 湖南省娄底市娄星区2019-2020学年2021-07-026页
- 2017-2018学年安徽省六安市舒城中2021-07-028页
- 黄冈第一轮化学_第八章镁铝2021-07-029页
- 【化学】福建省永泰县第一中学20192021-07-0210页
- 辽宁省六校协作体2020届高三上学期2021-07-0212页
- 【化学】河北省张家口市尚义县第一2021-07-0212页
- 2021版化学名师讲练大一轮复习鲁科2021-07-027页
- 2017-2018学年江西省南康中学高二2021-07-029页
- 2020届高考化学二轮复习综合实验设2021-07-0219页