- 958.04 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题十 氮及其化合物
考点 1 氮及氮的氧化物
1.[2020 江西南昌摸底测试]一种新型的合成氨的方法如图所示,下列说法正确的是 ( )
A.反应①属于氮的固定
B.反应②属于氧化还原反应
C.反应③可通过电解 LiOH 溶液实现
D.上述三步循环的总反应为 N2+3H2 2NH3
本题考查新型合成氨的方法,解答本题的关键是结合图示和箭头方向确定反应物和生成物,然后根据图示写
出其化学方程式并进行分析判断。
解题模型:链接考法 1 命题角度 1
2.[2019 江苏,16,12 分]N2O、NO 和 NO2 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O 的处理。N2O 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 N2O 分解。NH3 与 O2 在加热和
催化剂作用下生成 N2O 的化学方程式为 。
(2)NO 和 NO2 的处理。已除去 N2O 的硝酸尾气可用 NaOH 溶液吸收,主要反应为
NO+NO2+2OH- 2N
O2
-
+H2O
2NO2+2OH- N
O2
-
+N
O3
-
+H2O
①下列措施能提高尾气中 NO 和 NO2 去除率的有 (填标号)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 NaOH 溶液
②吸收后的溶液经浓缩、结晶、过滤,得到 NaNO2 晶体,该晶体中的主要杂质是 (填化
学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。
(3)NO 的氧化吸收。用 NaClO 溶液吸收硝酸尾气,可提高尾气中 NO 的去除率。其他条件相同,NO 转化为
N
O3
-
的转化率随 NaClO 溶液初始 pH(用稀盐酸调节)的变化如图所示。
①在酸性 NaClO 溶液中,HClO 氧化 NO 生成 Cl-和 N
O3
-
,其离子方程式为 。
②NaClO 溶液的初始 pH 越小,NO 转化率越高。其原因是 。
本题以尾气中氮氧化物的净化处理为载体,考查考生对陌生化学方程式和离子方程式的书写等知识。
解题模型:链接考法 1 命题角度 2
3.[2018 天津,9,18 分]烟道气中的 NOx 是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。
回答下列问题:
Ⅰ.采样
采样系统简图
采样步骤:
①检验系统气密性;②加热器将烟道气加热至 140 ℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气
样;⑤关闭系统,停止采样。
(1)A 中装有无碱玻璃棉,其作用为 。
(2)C 中填充的干燥剂是 (填标号)。
a.碱石灰 b.无水 CuSO4 c.P2O5
(3)用实验室常用仪器组装一套装置,其作用与 D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体
的流向及试剂。
(4)采样步骤②加热烟道气的目的是 。
Ⅱ.NOx 含量的测定
将 v L 气样通入适量酸化的 H2O2 溶液中,使 NOx 完全被氧化成 N
O3
-
,加水稀释至 100.00 mL。量取 20.00 mL
该溶液,加入 v1 mL c1 mol·L-1FeSO4 标准溶液(过量),充分反应后,用 c2 mol·L-1K2Cr2O7 标准溶液滴定剩余的
Fe2+,终点时消耗 v2 mL。
(5)NO 被 H2O2 氧化为 N
O3
-
的离子方程式为 。
(6)滴定操作使用的玻璃仪器主要有 。
(7)滴定过程中发生下列反应:
3Fe2++N
O3
-
+4H+ NO↑+3Fe3++2H2O
Cr2
O7
2-
+6Fe2++14H+ 2Cr3++6Fe3++7H2O
则气样中 NOx 折合成 NO2 的含量为 mg·m-3。
(8)判断下列情况对 NOx 含量测定结果的影响(填“偏高”“偏低”或“无影响”)
若缺少采样步骤③,会使测定结果 。
若 FeSO4 标准溶液部分变质,会使测定结果 。
本题以烟道气中 NOx 含量的监测为切入点,考查过滤知识的迁移、干燥剂的选择、有毒气体的吸收、气体溶
解度随温度升高而减小等基础必备知识在解决实际问题中的应用,体现基础性、综合性、应用性的命题新理
念。
解题模型:链接考法 1 命题角度 2
考点 2 氨及铵盐
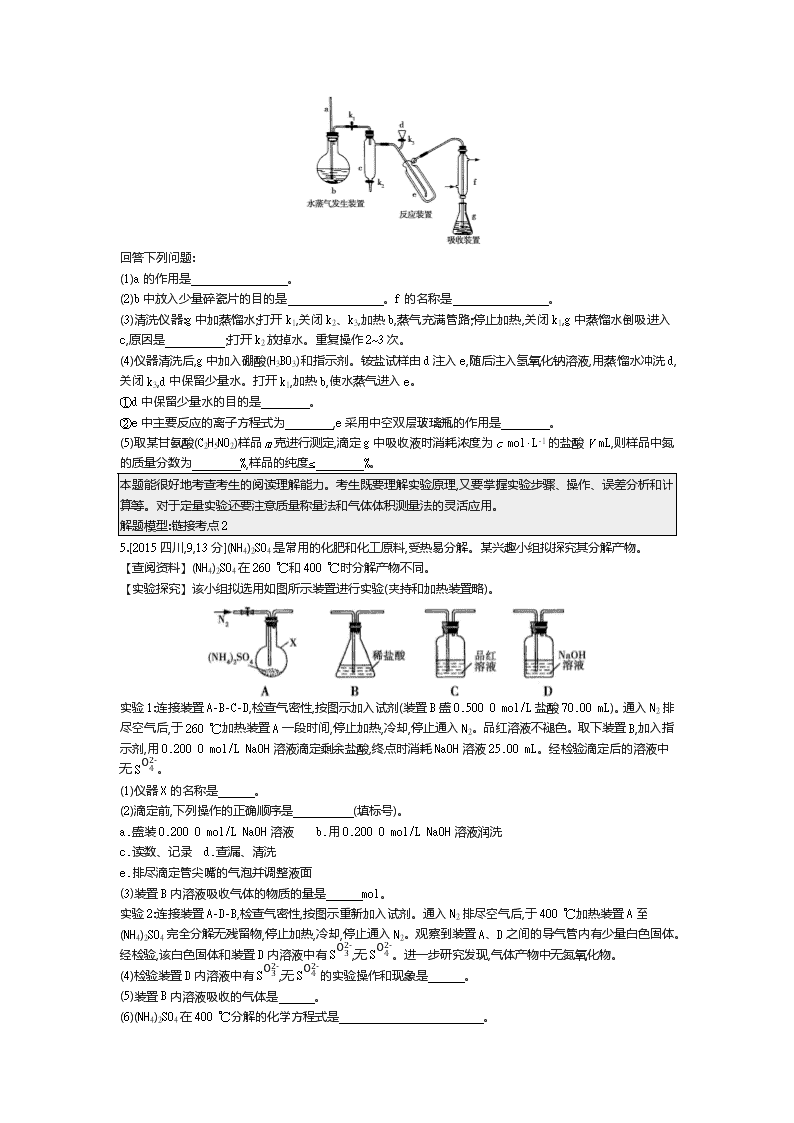
4.[2017 全国卷Ⅰ,26,15 分]凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在
下 将 样 品 中 有 机 氮 转 化 成 铵 盐 , 利 用 如 图 所 示 装 置 处 理 铵 盐 , 然 后 通 过 滴 定 测 量 。 已
知:NH3+H3BO3 NH3·H3BO3;NH3·H3BO3+HCl NH4Cl+H3BO3。
回答下列问题:
(1)a 的作用是 。
(2)b 中放入少量碎瓷片的目的是 。f 的名称是 。
(3)清洗仪器:g 中加蒸馏水;打开 k1,关闭 k2、k3,加热 b,蒸气充满管路;停止加热,关闭 k1,g 中蒸馏水倒吸进入
c,原因是 ;打开 k2 放掉水。重复操作 2~3 次。
(4)仪器清洗后,g 中加入硼酸(H3BO3)和指示剂。铵盐试样由 d 注入 e,随后注入氢氧化钠溶液,用蒸馏水冲洗
d,关闭 k3,d 中保留少量水。打开 k1,加热 b,使水蒸气进入 e。
①d 中保留少量水的目的是 。
②e 中主要反应的离子方程式为 ,e 采用中空双层玻璃瓶的作用是 。
(5)取某甘氨酸(C2H5NO2)样品 m 克进行测定,滴定 g 中吸收液时消耗浓度为 c mol·L-1 的盐酸 V mL,则样品中
氮的质量分数为 %,样品的纯度≤ %。
本题能很好地考查考生的阅读理解能力。考生既要理解实验原理,又要掌握实验步骤、操作、误差分析和计
算等。对于定量实验还要注意质量称量法和气体体积测量法的灵活应用。
解题模型:链接考点 2
5.[2015 四川,9,13 分](NH4)2SO4 是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4 在 260 ℃和 400 ℃时分解产物不同。
【实验探究】该小组拟选用如图所示装置进行实验(夹持和加热装置略)。
实验 1:连接装置 A-B-C-D,检查气密性,按图示加入试剂(装置 B 盛 0.500 0 mol/L 盐酸 70.00 mL)。通入 N2
排尽空气后,于 260 ℃加热装置 A 一段时间,停止加热,冷却,停止通入 N2。品红溶液不褪色。取下装置 B,加
入指示剂,用 0.200 0 mol/L NaOH 溶液滴定剩余盐酸,终点时消耗 NaOH 溶液 25.00 mL。经检验滴定后的
溶液中无 S
O4
2-
。
(1)仪器 X 的名称是 。
(2)滴定前,下列操作的正确顺序是 (填标号)。
a.盛装 0.200 0 mol/L NaOH 溶液 b.用 0.200 0 mol/L NaOH 溶液润洗
c.读数、记录 d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置 B 内溶液吸收气体的物质的量是 mol。
实验 2:连接装置 A-D-B,检查气密性,按图示重新加入试剂。通入 N2 排尽空气后,于 400 ℃加热装置 A 至
(NH4)2SO4 完全分解无残留物,停止加热,冷却,停止通入 N2。观察到装置 A、D 之间的导气管内有少量白色
固体。经检验,该白色固体和装置 D 内溶液中有 S
O3
2-
,无 S
O4
2-
。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置 D 内溶液中有 S
O3
2-
,无 S
O4
2-
的实验操作和现象是 。
(5)装置 B 内溶液吸收的气体是 。
(6)(NH4)2SO4 在 400 ℃分解的化学方程式是 。
本题利用定性与定量相结合的方法考查硫酸铵分解产物的探究。高考题多次关注硫酸盐或其他盐分解产物
的探究,如 2017 年全国卷Ⅲ第 26 题考查硫酸亚铁分解产物的探究、2018 年全国卷Ⅱ第 28 题考查
K3[Fe(C2O4)3]·3H2O 的热分解产物的探究,这一动向值得考生关注。
解题模型:链接考点 2
考点 3 硝酸
6.[2017 北京,12,6 分]下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
① ② ③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出 CO2,由此说明木炭一定与浓硝酸发生了反应
考查考生对比分析问题的能力,是控制变量法的一种创新运用。本题考查了浓硝酸的不稳定性、强氧化性和
易挥发性。
解题模型:链接考点 3
考点 1 氮及氮的氧化物
考法 1 氮及氮的氧化物的性质和应用
命题角度 1 氮气的性质及应用
1[2020 辽宁葫芦岛模拟]中国科学院科研团队研究表明,在常温常压和可见光下,基于 LDH(一种固体
催化剂)合成 NH3 的原理示意图如图所示。下列说法错误的是
A.氧化剂与还原剂的物质的量之比为 3∶1
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于 LDH 合成 NH3 的过程属于氮的固定
D.工业中,氨经一系列反应可以得到硝酸
该反应的化学方程式为 2N2+6H2O 4NH3+3O2,氮气是氧化剂,水是还原剂,氧化剂与还原剂
的物质的量之比为 1∶3,A 错误;该过程中,既有极性键的断裂(O—H)与生成(N—H),也有非极性键的断裂
( )与生成(O O),B 正确;基于 LDH 合成 NH3 的过程是将氮气转化为氨气的过程,属于氮的固定,C 正
确;工业中,氨经催化氧化得到 NO,NO 被氧化为 NO2,NO2 与水反应可得到硝酸,D 正确。
A
考点扫描
1.[2017 全国卷Ⅲ,26 改编]绿矾(FeSO4·xH2O)易被氧化,在测定其结晶水含量或探究 FeSO4 的分解产物时,
应先缓缓通入 N2,目的是 。
2.[2017 北京,27(1)改编]NH3 在催化剂作用下还原 NO2 生成 N2 和 H2O 的化学方程式为 。
提示:1.排尽装置中的空气 2.8NH3+6NO2 7N2+12H2O
命题角度 2 结合环保问题考查氮及其化合物的性质(热点角度)
2[2016 全国卷Ⅰ,26,14 分]氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用
NH3 将 NOx 还原生成 N2。某同学在实验室中对 NH3 与 NO2 反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择图中的 ,反应的化学方程式为 。
②欲收集一瓶干燥的氨气,选择图中的装置,其连接顺序为发生装置➝ (按气流方向,用小写字母表
示)。
(2)氨气与二氧化氮的反应
将上述收集到的 NH3 充入注射器 X 中,硬质玻璃管 Y 中加入少量催化剂,充入 NO2(两端用夹子 K1、K2 夹好)。
在一定温度下按图示装置进行实验。
操作步骤 实验现象 解释原因
打开 K1,推动注射器
活塞,使 X 中的气体
缓慢通入 Y 管中
①Y 管中 ②反应的化学方程式
将注射器活塞退回原
处并固定,待装置恢
复到室温
Y 管中有少量水珠 生成的气态水凝聚
打开 K2 ③ ④
(1)①观察装置知,A 装置适合加热固体制备气体,B 装置适合加热液体与固体制备气体或加热液体制备
气体。实验室通过氯化铵和消石灰共热制备氨气,可以选择 A 装置作发生装置,化学方程式为
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。实验室还可以通过加热浓氨水制备氨气,故也可以选择 B 装置
作发生装置,化学方程式为 NH3·H2O NH3↑+H2O。②实验室用碱石灰干燥氨气,用向下排空气法收集氨气,
用水吸收尾气中的氨气并注意防倒吸。故选择 C、D、F 装置,注意连接球形干燥管时应大口进气,小口出气。
所以,连接顺序为 a、d、c、f、e、i 或 b、d、c、f、e、i。(2)NO2 呈红棕色,氨气与二氧化氮发生反
应:8NH3+6NO2 7N2+12H2O,故观察到 Y 管中红棕色气体慢慢变浅。NH3 与 NO2 反应后生成的气态
水凝聚,反应后气体分子数减少,装置内压强减小,故打开 K2,NaOH 溶液会产生倒吸现象。
(1)①A 2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O(或 B NH3·H2O NH3↑+H2O) ②d c f e i
(2)①红棕色气体慢慢变浅 ②8NH3+6NO2 7N2+12H2O ③Z 中 NaOH 溶液产生倒吸现象 ④反
应后气体分子数减少,Y 管中压强小于外压
考法点睛·分析解释
本题可利用多种实验方法制备氨气,考查考生思维的发散性;通过氨气与 NO2 的归中反应实验,考查考生对实
验现象的预测能力和解释能力。
考点扫描
1.[2018 天津,9(5),2 分]NO 被 H2O2 氧化为 N
O3
-
的离子方程式为 。
2.[2018 江苏,20 改编](1)用稀硝酸吸收 NOx,得到 HNO3 和 HNO2 的混合溶液,电解该混合溶液可获得较浓的
硝酸。写出电解时阳极的电极反应式: 。
(2)用酸性(NH2)2CO 水溶液吸收 NOx,吸收过程中存在 HNO2 与(NH2)2CO 生成 N2 和 CO2 的反应。写出该反
应的化学方程式: 。
(3)在有氧条件下,某新型催化剂能催化 NH3 与 NOx 反应生成 N2。写出 NH3 与 NO2 反应的化学方程
式: 。当生成 1molN2 时,转移的电子数为 mol。
3.[2017 北京,12A 改编]浓硝酸受热分解产生红棕色气体,推断产生的气体一定是混合物( )
4.[2017 北京,27(2)改编]在有氧条件下,15NO 与 NH3 以一定比例反应时,得到的笑气几乎都是 15NNO。写出
该反应的化学方程式: 。
5.[2016 江苏,5A 改编]将铜丝插入稀硝酸中反应的离子方程式为
Cu+4H++2N
O3
-
Cu2++2NO2↑+H2O( )
提示:1.2NO+3H2O2 2H++2N
O3
-
+2H2O
2.(1)HNO2-2e-+H2O 3H++N
O3
-
(2)2HNO2+(NH2)2CO 2N2↑+CO2↑+3H2O
(3)8NH3+6NO2 7N2+12H2O
24
7
3.√ 4.415NO+4NH3+3O2 415NNO+6H2O 5.✕
考点 2 氨及铵盐
考法 2 氨的制备和性质探究
命题角度 1 结合物质制备装置考查氨的实验室制法
3[2019 湖北鄂州、黄冈两市联考]某化学学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装
置如图所示(部分夹持装置已略)。
已知:①CS2 不溶于水,比水重;NH3 不溶于 CS2。②三颈烧瓶内盛有 CS2、水和催化剂。
实验步骤如下:
(1)制备 NH4SCN:CS2+2NH3 NH4SCN+H2S(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层 CS2 液体必须浸没导气管口,目的是 。
②实验开始时打开 K1,加热 A,使 A 中产生的气体缓缓通入 D 中,至 CS2 消失。则 A 中反应的化学方程式
是 ;C 的作用是 。
(2)制备 KSCN 溶液:熄灭 A 处的酒精灯,关闭 K1,打开 K2,再缓缓滴加适量的 KOH 溶液,发生反
应:NH4SCN+KOH KSCN+NH3↑+H2O。
小组讨论后认为:实验中滴加相同浓度的 K2CO3 溶液比 KOH 溶液更好,理由是 。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶, ,干燥,得到硫氰
化钾晶体。
(4)测定晶体中 KSCN 的含量:称取 10.0 g 样品配成 1 000 mL 溶液,量取 20.00 mL 于锥形瓶中,加入适量稀
硝酸,再加入几滴 Fe(NO3)3 溶液作指示剂,用 0.100 0 mol/L AgNO3 标准溶液滴定,达到滴定终点时消耗
AgNO3 标准溶液 20.00 mL。
①滴定时发生的反应:SCN-+Ag+ AgSCN↓。则判断达到滴定终点时的方法是 。
②晶体中 KSCN 的质量分数为 。
(1)①导气管口在下层液体 CS2 中,可以使反应物充分接触,防倒吸;②实验室用氯化铵与氢氧化钙来制
备氨气,其化学方程式为 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O,C 是为了观察气泡产生的速率,以便控
制 A 中的加热温度。(2)K2CO3 碱性弱于 KOH,且与 NH4SCN 反应产生更多气体
(K2CO3+2NH4SCN 2KSCN+2NH3↑+CO2↑+H2O),有利于溶液中残留的 H2S 逸出。(3)实验室制备硫氰
化钾晶体的操作:减压蒸发浓缩,冷却结晶,过滤,洗涤,干燥。(4)①Fe3+与 SCN-发生络合反应,显红色,因此当最
后一滴 AgNO3 溶液滴入时,红色恰好褪去,且半分钟内颜色不恢
复;②n(KSCN)=n(AgNO3)=0.1000mol/L×20.00×10-3L×
1000mL
20.00mL
=0.1mol,m(KSCN)=97g/mol×0.1mol=9.7g,故
KSCN 的质量分数为
9.7g
10.0g
×100%=97.0%。
(1)①使反应物充分接触,防倒吸 ②2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 观察气泡产生的速
率,以便控制加热温度 (2)K2CO3 碱性弱于 KOH,且与 NH4SCN 反应能产生更多气体,有利于溶液中残留的
H2S 逸出 (3)过滤,洗涤 (4)①当滴入最后一滴 AgNO3 溶液时,红色恰好褪去,且半分钟内颜色不恢复
②97.0%
考点扫描
1.[2017 江苏,3D 改编]由于 NH3 易溶于水,故可用作制冷剂( )
2.[2016 全国卷Ⅲ,26(4)改编]利用氯化钙溶液、氨水、H2O2 溶液在冰浴条件下制备过氧化钙,该反应的化学
方程式为 。
3.[2016 四川,11(4)改编]在浸取液(溶质主要为硫酸镁)中通入 NH3,发生反应的化学方程式
是 。
提 示 : 1 . ✕ 2 . C a C l 2 + 2 N H 3 · H 2 O + H 2 O 2 + 6 H 2 O C a O 2 · 8 H 2 O ↓ + 2 N H 4 C l ( 或
C a C l 2 + 2 N H 3 · H 2 O + H 2 O 2 C a O 2 ↓ + 2 N H 4 C l +
2H2O) 3.MgSO4+2NH3+2H2O Mg(OH)2↓+(NH4)2SO4
命题角度 2 火箭燃料——联氨的结构与性质(热点角度)
4[2016 全国卷Ⅱ,26 节选,11 分]联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭
燃料。回答下列问题:
(1)联氨分子的电子式为 ,其中氮的化合价为 。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
(3)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为 (已
知:N2H4+H+ N2
H5
+
的 K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
(4)联氨是一种常用的还原剂。向装有少量 AgBr 的试管中加入联氨溶液,观察到的现象是 。
联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上 1 kg 的联氨可除去水中溶解的 O2 kg;
与使用 Na2SO3 处理水中溶解的 O2 相比,联氨的优点是 。
(1)N2H4 中原子间以共价键结合,其电子式为 H∶ ∶ ∶H。N2H4 中 H 为+1 价,由化合物中各元素化合
价代数和为 0,可确定 N 为-2 价。(2)反应中 NaClO 和 NH3 分别作氧化剂和还原剂,根据得失电子守恒和原子
守恒可写出并配平相应的化学方程式。(3)N2H4 的第一步电离的离子方程式为 N2H4+H2O N2
H5
+
+OH-,则
电离常数 Kb=
�(N2H5
+)
·
�(OH-)
�(N2H4)
=
�(N2H5
+)
·
�(OH-)
·
�(H+)
�(N2H4)
·
�(H+)
=
�(N2H5
+)
·
�w
�(N2H4)
·
�(H+)
=K·Kw=8.7×107×1.0×10-14=8.7×10-7。联氨是二
元弱碱,其与硫酸形成的酸式盐为 N2H6(HSO4)2。(4)联氨具有还原性,能将 AgBr 中的 Ag+还原为 Ag,可看到
固体逐渐变黑,联氨被氧化为 N2,可看到溶液中有气泡产生。1mol 联氨在反应中失去 4mol 电子,而 1molO2
能得到 4mol 电子,且联氨与 O2 的相对分子质量相等,故参加反应的联氨与 O2 的物质的量和质量均相等,故
1kg 的联氨可除去水中溶解的 O2 的质量为 1kg。使用联氨处理水中溶解的 O2,消耗联氨的质量小,且产物为
N2 和 H2O,对环境无污染,而用 Na2SO3 处理水中溶解的 O2 时,Na2SO3 被氧化为 Na2SO4,产生新杂质。
(1)H∶ ∶ ∶H -2 (2)2NH3+NaClO N2H4+NaCl+H2O (3)8.7×10-7 N2H6(HSO4)2 (4)固体逐
渐变黑,并有气泡产生 1 N2H4 的用量少,不产生其他杂质(还原产物为 N2 和 H2O,而 Na2SO3 产生 Na2SO4)
考法归纳·迁移创新
类比 NH3 的性质类推 N2H4 的性质
1.碱性:二元弱碱,碱性比 NH3·H2O 的弱。
(1)电离:在水中的电离方式与氨相似,分两步进行:N2H4+H2O N2
H5
+
+OH-,N2
H5
+
+H2O N2
H6
2+
+OH-。
(2)水解:N2
H5
+
+H2O N2H4·H2O+H+,N2
H6
2+
+2H2O N2H4·2H2O+2H+。
(3)与硫酸反应,2N2H4+H2SO4 (N2H5)2SO4,N2H4+2H2SO4(过量) N2H6(HSO4)2(酸式盐)。
2.强还原性:(1)水合肼在碱性溶液中能将银、镍等金属离子还原成金属单质,如
Ag++N2H4·H2O Ag↓+N
H4
+
+
1
2
N2↑+H2O;(2)能被氧气、H2O2 等氧化,可用作喷气式发动机推进剂、火箭燃
料等。
命题角度 3 利用现代传感技术认识喷泉原理(预测角度)
5 现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是
A.制取氨气时烧瓶中的 X 固体常用 CaO 或 CaCl2
B.将湿润的蓝色石蕊试纸置于三颈烧瓶口 c 处,试纸变红,说明 NH3 已收集满
C.关闭 a,用单孔塞(插有吸入水的胶头滴管)塞紧三颈烧瓶口 c,打开 b,挤压胶头滴管完成喷泉实验,电脑绘制
三颈烧瓶内压强变化曲线如图 2 所示,则 C 点时喷泉最剧烈
D.工业上,若出现液氨泄漏,喷洒 NaHCO3 溶液比喷洒稀盐酸效果好
CaO 能与水反应,使 c(OH-)增大,同时放出大量的热,有利于氨气的逸出,而 CaCl2 虽然具有吸水性,但易
与产生的氨气反应生成 CaCl2·8NH3,不能用于制备或干燥氨气,A 错误;红色石蕊试液遇碱显蓝色,所以检验
三颈烧瓶集满 NH3 的方法是将湿润的红色石蕊试纸靠近三颈烧瓶口 c,试纸变蓝,证明 NH3 已收集满,B 错误;
三颈烧瓶内气体压强与外界大气压差值越大,喷泉越剧烈,C 点压强最小、外界大气压不变,所以大气压和 C
点压强差值最大,则喷泉最剧烈,C 正确;稀盐酸显酸性,碳酸氢钠溶液显碱性,氨水溶液显碱性,因此在酸性溶
液中吸收氨气的效率高于在碱性溶液中吸收氨气的效率,D 错误。
C
考法归纳·迁移创新
本题结合氨的制备与人教版《化学》(必修 1)第 97 页“实验 4-8 氨溶于水的喷泉实验”进行综合命题,创新融
入传感技术测定压强变化的装置和图像,试题新颖。喷泉装置在命题中还可能被改装成如图所示装置:
图甲 图乙
其中图甲引发喷泉的操作为“打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空
气,与水接触,即产生喷泉”;图乙的锥形瓶中盛放“碳酸氢铵与稀盐酸”或“过氧化钠与水”等均能形成喷泉。图甲
所示为负压喷泉(圆底烧瓶中压强小于烧杯中水面上外界大气压),图乙所示为正压喷泉(锥形瓶内压强大于
外界大气压),城市喷泉装置的原理与图乙所示装置相同,属于正压喷泉。
考点 3 硝酸
考法 3 金属与硝酸反应的性质探究与计算
命题角度 1 硝酸与金属反应的实验探究
6[2015 北京,12,6 分]在通风橱中进行下列实验:
步骤
现象
Fe表面产生大量无色气泡,
液面上方变为红棕色
Fe 表面产生少量红棕色气泡后,迅速停
止
Fe、Cu 接触后,其表面均产生红棕色气泡
下列说法不正确的是
A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2 2NO2
B.Ⅱ中的现象说明 Fe 表面形成致密的氧化层,阻止 Fe 进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀 HNO3 的氧化性强于浓 HNO3
D.针对Ⅲ中现象,在 Fe、Cu 之间连接电流计,可判断 Fe 是否被氧化
稀硝酸与铁反应可生成 NO,NO 在空气中被氧化为 NO2,A 项正确。浓硝酸能使铁钝化,B 项正确。Ⅱ中
铁钝化,反应停止,不能比较稀硝酸与浓硝酸氧化性的强弱,C 项错误。构成原电池后可以根据电流的方向判
断正、负极,从而判断 Fe 是否被氧化,D 项正确。
C
1.将 11.2 g 铜粉和镁粉的混合物分成两等份,其中一份加入 200 mL 的稀硝酸并加热,固体和
硝酸恰好完全反应,并产生标准状况下 2.24 L NO;将另一份在空气中充分加热,最后得到 m g 固体。下列有
关说法正确的是 ( )
①c(HNO3)=2.0 mol·L-1 ②c(HNO3)=0.5 mol·L-1
③m=8.0 ④m=7.2
A.①④ B.①③ C.②④ D.②③
命题角度 2 HNO2 及其盐的性质(预测角度)
7 信息 1:亚硝酸(HNO2)是一种弱酸,既具有氧化性又具有还原性;亚硝酸不稳定,易分解为硝酸、水和
NO。信息 2:亚硝酸钠又名“工业盐”,常被大量用作高分子材料的发泡剂和偶氮染料的原料等,该物质有毒,但
其颜色、形状、味道和食盐相似,很容易因误食而中毒;亚硝酸银为难溶于水的白色沉淀。
根据上述信息,回答下列问题:
(1)甲组同学取一份可能是 NaCl 或 NaNO2 的样品,用蒸馏水溶解,通过下列实验操作可鉴别样品成分。在待
检验溶液中滴加 AgNO3 溶液的现象是 ,倒出上清液,在沉淀中加入硝酸,振荡,沉淀溶解,则
该样品为 (写化学式),沉淀溶解的离子方程式为 。
(2)乙组同学利用如图所示装置检验可能是 NaCl 或 NaNO2 的样品。
①A 装置中盛装稀硫酸的仪器名称是 ,打开该仪器的活塞,使稀硫酸缓缓滴下,若样品为
NaNO2,则在 B 装置中可观察到的现象为 ,检验 B 装置中有 NO 的操作及产生的现象
是 。
②C 装置中盛有的试剂名称是 ,作用是 。
(3)设计实验证明。
①亚硝酸为弱酸: 。
②亚硝酸具有还原性: 。
(1)AgCl 和 AgNO2 均为白色难溶于水的物质,故加入 AgNO3 溶液后出现白色沉淀。AgCl 难溶于硝酸,
而 AgNO2 与硝酸反应可生成 HNO2,该物质不稳定,又分解生成硝酸、水和 NO。(2)①根据装置图中盛装稀
硫酸的仪器的结构及作用可知其为分液漏斗。A 装置和 B 装置中残留的空气与 A 装置中生成的 NO 反应生
成 NO2。由于 B 装置中主要含 NO,故其内气体颜色较淡,打开止水夹,鼓入空气,NO 完全转化为 NO2,使 B 装
置内 NO2 浓度增大,红棕色变深。②氮的氧化物有毒,可用碱液(如 NaOH 溶液)吸收。(3)①检验 HNO2 的弱
酸性,可检验其强碱盐的 pH,也可以直接检验其一定浓度稀溶液的 pH 等。②检验 HNO2 的还原性需要用到
氧化剂,故在酸性 KMnO4 溶液中加入过量 NaNO2 溶液,KMnO4 被还原,从而使溶液褪色。
(1)产生白色沉淀 NaNO2 3AgNO2+2H+ 3Ag++2NO↑+N
O3
-
+H2O (2)①分液漏斗 出现较淡
的红棕色气体 打开止水夹,鼓入空气,红棕色变深 ②NaOH 溶液(合理即可) 吸收尾气 (3)①取 NaNO2
溶液,用 pH 试纸检验,对照标准比色卡知 pH>7(其他合理答案也可) ②在酸性 KMnO4 溶液中加入过量
NaNO2 溶液,溶液褪色(其他合理答案也可)
考法归纳·迁移创新
类比硝酸的性质学习亚硝酸的性质
1.亚硝酸的性质
(1)亚硝酸中,N 为+3 价,既有氧化性,又有还原性,在水溶液中能将 I-氧化为单质
碘:2HNO2+2I-+2H+ I2+2NO↑+2H2O。
(2)亚硝酸是一种弱酸,不稳定,易分解成 HNO3、H2O 和 NO,即 3HNO2 HNO3+2NO↑+H2O。
2.HNO2 的制备
(1)将等物质的量的 NO2 和 NO 的混合物溶解在冰水中:NO+NO2+H2O 2HNO2。
(2)将强酸加入亚硝酸盐的冷溶液中:NaNO2+HCl NaCl+HNO2。
素材 16PH3、H3PO2、H3PO4 等物质的性质及其应用
考点扫描
1.[2019 全国卷Ⅲ,11B 改编]常温下 pH=2 的 H3PO4溶液中
c(H+)=c(H2P
O4
-
)+2c(HP
O4
2-
)+3c(P
O4
3-
)+c(OH-)( )
2.[2018 全国卷Ⅱ,11A 改编]NA 代表阿伏加德罗常数的值,常温常压下,124gP4 中所含 P—P 键数目为
4NA( )
3.[2017全国卷Ⅲ,10D改编]NA代表阿伏加德罗常数的值。密闭容器中1molPCl3 与1molCl2 反应制备PCl5(g),
增加 2NA 个 P—Cl 键( )
4.[2015 新课标全国卷Ⅱ,7B]P2O5 不可用作食品干燥剂( )
5.[2014 新课标全国卷Ⅰ,27(1)(3),4 分]H3PO2 是一元中强酸,写出其电离方程式 。H3PO2 的工
业制法是将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体和 Ba(H2PO2)2,后者再与 H2SO4 反应。写出白磷与
Ba(OH)2 溶液反应的化学方程式: 。
提示:1.√ 2.✕ 3.✕ 4.√ 5.H3PO2 H++H2P
O2
-
2P4+3Ba(OH)2+6H2O 3Ba(H2PO2)2+2PH3↑
2.[2019 四川成都二诊]NaH2PO2·H2O 易溶于水,水溶液呈中性,具有强还原性,可用于化学镀
银、镍、铜等。一种以泥磷(含 P4 和少量 CaO、Fe2O3、Al2O3、CaCl2 等)为原料制备 NaH2PO2·H2O 的工
艺流程如图所示。
已知:P4 与 Ca(OH)2、NaOH 的反应主要有
Ⅰ.3Ca(OH)2+2P4+6H2O 3Ca(H2PO2)2+2PH3↑
Ⅱ.3NaOH+P4+3H2O 3NaH2PO2+PH3↑
(1)已知 H3PO2 是一元中强酸,NaH2PO2 是 (填“正盐”或“酸式盐”)。
(2)尾气中的 PH3 被 NaClO 溶液吸收可生成 NaH2PO2 和 NaCl,离子方程式为 ,从吸收液中
获得 NaH2PO2·H2O 的操作为 、 、过滤、洗涤和干燥。
(3)用 NiCl2、NaH2PO2 溶液化学镀 Ni,同时生成 H3PO4 和氯化物的化学方程式
为 。
(4)“滤渣 2”的主要成分为 (填化学式)。
(5)“过滤 2”的滤液需要用 Ag2SO4 悬浊液和 Ba(OH)2 溶液除去其中 Cl-,加入的 Ag2SO4 悬浊液不宜过量太多,
其主要原因是 。
素材 17As 及其化合物的性质及应用
考点扫描
[2017全国卷Ⅲ,28(2)节选,2分]工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2 氧化,生成H3AsO4
和单质硫。写出发生反应的化学方程式 。
提示:2As2S3+5O2+6H2O 4H3AsO4+6S
3.[2019 广东模拟改编]砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问
题:
(1)AsH3 的电子式为 ;将 AsH3 通入 AgNO3 溶液中可生成 Ag、As2O3 和 HNO3,该反应中氧化剂与还
原剂的物质的量之比为 。
(2)改变 0.1 mol·L-1 三元弱酸 H3AsO4 溶液的 pH,溶液中的 H3AsO4、H2As
O4
-
、HAs
O4
2-
以及 As
O4
3-
的物质的
量分布分数随 pH 的变化如图 1 所示:
图 1 图 2
①lg Ka1(H3AsO4)= ,用甲基橙作指示剂(pH 变色范围为 3.1~4.4),用 NaOH 溶液滴定 H3AsO4 发生的
主要反应的离子方程式为 。
②反应 H2As
O4
-
+As
O4
3-
2HAs
O4
2-
的 lg K= 。
(3)反应 2As2S3(s) 4AsS(g)+S2(g)达到平衡时气体总压的对数值 lg(p/kPa)与温度的关系如图 2 所示:
①对应温度下,B 点的反应速率 v(正) v(逆)(填“>”“<”或“=”)。
②A 点处,AsS(g)的分压为 kPa,该反应的 Kp= (Kp 为以分压表示的平衡常数)。
模型 2 基于核心素养下的新情境命题模型——工艺流程题
8[盐浸][2019 全国卷Ⅰ,26,14 分]硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等
工业。一种以硼镁矿(含 Mg2B2O5·H2O、SiO2 及少量 Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流
程如图所示。
回答下列问题:
(1)在 95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为 。
(2)“滤渣 1”的主要成分有 。为检验“过滤 1”后的滤液中是否含有 Fe3+离子,可选用的化学试剂是 。
(3)根据 H3BO3 的解离反应:H3BO3+H2O H++B(OH
)4
-
,Ka=5.81×10-10,可判断 H3BO3 是 酸;在“过
滤 2”前,将溶液 pH 调节至 3.5,目的是 。
(4)在“沉镁”中生成 Mg(OH)2·MgCO3 沉淀的离子方程式为 ,母液经加热后可返回
工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是 。
(1)硫酸铵溶液中存在平衡:N
H4
+
+H2O NH3·H2O+H+,硼酸镁能与水解出的 H+反应,促进平衡向右移
动,生成的一水合氨浓度增大,因溶液中存在平衡 NH3·H2O NH3+H2O,一水合氨浓度增大,促进 NH3·H2O
分解产生 NH3。用 NH4HCO3 溶液吸收氨气,发生的反应为 NH4HCO3+NH3 (NH4)2CO3。(2)二氧化硅、
氧化铁、氧化铝不溶于硫酸铵溶液,滤渣 1 的主要成分是二氧化硅、氧化铁、氧化铝。检验 Fe3+的试剂可选
用 KSCN。(3)由题给硼酸的解离反应方程式知,硼酸是一元弱酸。“过滤 2”之前,调节 pH≈3.5 目的是将硼元
素转化为硼酸,促进硼酸析出。(4)“沉镁”中,碳酸铵溶液与硫酸镁溶液发生相互促进的水解反应生成碱式碳酸
镁:2MgSO4+2(NH4)2CO3+H2O Mg(OH)2·MgCO3↓+2(NH4)2SO4+CO2↑或者反应生成碱式碳酸镁和碳酸
氢盐。母液含硫酸铵,可以将母液返回“溶浸”工序循环使用,体现绿色化学理念和环境保护思想。碱式碳酸镁
转化成轻质氧化镁,联系碳酸镁、氢氧化镁受热都能分解生成氧化镁,也可以联系碱式碳酸铜分解生成氧化铜、
水和二氧化碳,可知采用的方法是高温焙烧法,MgCO3·Mg(OH)2 2MgO+H2O+CO2↑。
(1)NH4HCO3+NH3 (NH4)2CO3
(2)SiO2、Fe2O3、Al2O3 KSCN
(3)一元弱 转化为 H3BO3,促进析出
(4)2Mg2++3C
O3
2-
+2H2O Mg(OH)2·MgCO3↓+2HC
O3
-
( 或
2Mg2++2C
O3
2-
+H2O Mg(OH)2·MgCO3↓+CO2↑) 溶浸 高温焙烧
9[2017 全国卷Ⅲ,27,15 分]重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为
FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示。
回答下列问题:
(1)步骤①的主要反应为
FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2
上述反应配平后 FeO·Cr2O3 与 NaNO3 的系数比为 。该步骤不能使用陶瓷容器,原因是 。
(2)滤渣 1 中含量最多的金属元素是 ,滤渣 2 的主要成分是 及含硅杂质。
(3)步骤④调滤液 2 的 pH 使之变 (填“大”或“小”),原因是 (用离子方程式表
示)。
(4)有关物质的溶解度如图所示。向“滤液 3”中加入适量 KCl,蒸发浓缩,冷却结晶,过滤得到 K2Cr2O7 固体。冷
却到 (填标号)得到的 K2Cr2O7 固体产品最多。
a.80 ℃ b.60 ℃ c.40 ℃ d.10 ℃
步骤⑤的反应类型是 。
(5)某工厂用 m1 kg 铬铁矿粉(含 Cr2O3 40%)制备 K2Cr2O7,最终得到产品 m2 kg,产率为 。
(1)1molFeO·Cr2O3 参与反应共失去 7mol 电子,而 1molNaNO3 参与反应得到 2mol 电子,根据得失电子
守恒,二者的系数比为 2∶7。由于高温下碳酸钠能与陶瓷中的二氧化硅发生反应,所以该步骤不能使用陶瓷容
器。(2)步骤①中生成的氧化铁因不溶于水而进入滤渣 1,所以滤渣 1 中含量最多的金属元素是 Fe。结合流
程图可知,滤渣 2 的主要成分是氢氧化铝及含硅杂质。(3)滤液 2 中存在平衡:2Cr
O4
2-
+2H+ Cr2
O7
2-
+H2O,
氢离子浓度越大(pH 越小),越有利于平衡正向移动,所以步骤④应调节滤液 2 的 pH 使之变小。(4)根据题图可
知,温度越低 K2Cr2O7 的溶解度越小,析出的重铬酸钾固体越多,故 d 项正确。步骤⑤中发生的反应为
Na2Cr2O7+2KCl K2Cr2O7↓+2NaCl,其属于复分解反应。(5)该铬铁矿粉中 Cr2O3 的物质的量为
�1
×
103g
×
40%
152g
·
mol-1
,根据铬元素守恒可求得 K2Cr2O7 的理论质量 m0=
�1
×
103g
×
40%
152g
·
mol-1
×294g·mol-1×10-3kg·g-1=
147�1
190
kg,
所以产品的产率为
�2
�0
×100%=
190�2
147�1
×100%。
(1)2∶7 陶瓷在高温下会与 Na2CO3 反应 (2)Fe Al(OH)3 (3)小 2Cr
O4
2-
+2H+ Cr2
O7
2-
+H2O
(4)d 复分解反应 (5)
190�2
147�1
×100%
4.[原料预处理粉碎][2018 北京,26,13 分]磷精矿湿法制备磷酸的一种工艺流程如下:
已知:磷精矿主要成分为 Ca5(PO4)3(OH),还含有 Ca5(PO4)3F 和有机碳等。
溶解度:Ca5(PO4)3(OH)”或“<”)。
②结合元素周期律解释①中结论:P 和 S 电子层数相同, 。
(3)酸浸时,磷精矿中 Ca5(PO4)3F 所含氟转化为 HF,并进一步转化为 SiF4 除去。写出生成 HF 的化学方程式:
。
(4)H2O2 将粗磷酸中的有机碳氧化为 CO2 脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温
度下的有机碳脱除率如图所示。80 ℃后脱除率变化的原因: 。
(5)脱硫时,CaCO3 稍过量,充分反应后仍有 S
O4
2-
残留,原因是 ;加入 BaCO3 可进一步
提高硫的脱除率,其离子方程式是 。
(6)取 a g 所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用 b mol·L-1 NaOH 溶液滴定至终点时生成
Na2HPO4,消耗 NaOH 溶液 c mL。精制磷酸中 H3PO4 的质量分数是 。
(已知:H3PO4 摩尔质量为 98 g·mol-1)
5.[氧化还原和沉淀转化][2016 全国卷Ⅲ,28,14 分]以硅藻土为载体的五氧化二钒(V2O5)是接
触法生产硫酸的催化剂。从废钒催化剂中回收 V2O5 既避免污染环境又有利于资源综合利用。废钒催化剂的
主要成分为:
物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3
质量分数
/%
2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时 V2O5 转化为 V
O2
+
,反应的离子方程式为 ,同时 V2O4 转化成 VO2+。“废渣 1”
的主要成分是 。
(2)“氧化”中欲使 3 mol 的 VO2+变成 V
O2
+
,则需要氧化剂 KClO3 至少为 mol。
(3)“中和”作用之一是使钒以 V4
O12
4-
形式存在于溶液中。“废渣 2”中含有 。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4
O12
4-
R4V4O12+4OH-(ROH 为强碱性阴离子交换树
脂)。为了提高洗脱效率,淋洗液应该呈 性(填“酸”“碱”或“中”)。
(5)“流出液”中阳离子最多的是 。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程
式 。
6.[萃取与反萃取][新课标全国卷Ⅰ高考,15 分]锂离子电池的应用很广,其正极材料可再生利用。
某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应
为 6C+xLi++xe- LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:
(1)LiCoO2 中,Co 元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在 80 ℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用
盐酸代替 H2SO4 和 H2O2 的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生 LiCoO2 和 Li1-xCoO2 之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收
到的金属化合物有 (填化学式)。
1.A 反 应① 为 Li 与 N2 反 应生 成 Li3N 的 反应 ,属 于氮 的 固 定 ,A 项 正确 ;结 合题 图 可 知反 应 ② 为
Li3N+3H2O 3LiOH+NH3↑,该反应中没有化合价的变化,属于非氧化还原反应,B 项错误;电解 LiOH 溶液不
能生成单质 Li,C 项错误;结合题图可知,三步循环的总反应为 2N2+6H2O 4NH3+3O2,D 项错误。
2.(1)2NH3+2O2 N2O+3H2O(2 分)
(2)①BC(2 分) ②NaNO3(2 分) NO(2 分)
(3)①3HClO+2NO+H2O 3Cl-+2N
O3
-
+5H+(2 分)
②溶液 pH 越小,溶液中 HClO 的浓度越大,氧化 NO 的能力越强(2 分)
【解析】 (1)NH3 被 O2 氧化生成 N2O,氮元素从-3 价升至+1 价,1molNH3 失去 4mole-,氧元素从 0 价降至-2
价,1molO2 得到 4mole-,根据得失电子守恒及原子守恒配平化学方程式。(2)①A 项,通入尾气速率过快时,尾
气吸收不充分,错误;B 项,采用气、液逆流的方式吸收尾气时,尾气吸收会更充分,正确;C 项,补充 NaOH 溶
液,c(OH-)增大,能更充分吸收尾气,正确。②NO2 与 NaOH 反应可生成 NaNO2、NaNO3 和水,所以 NaNO2 晶
体中会混有 NaNO3 杂质。由吸收尾气的主要反应可知,NO2 吸收更充分,故吸收后排放的尾气中 NO 的含量
较高。(3)①HClO 氧化 NO 生成 N
O3
-
,自身被还原为 Cl-,根据得失电子守恒、原子守恒、电荷守恒配平化学
方程式。②氧化 NO 的是 HClO,NaClO 在酸性条件下会生成 HClO,所以 pH 越小,溶液中 HClO 的浓度越
大,NO 转化率越高。
3.( 每 空 2 分 )(1) 除 尘 (2)c (3) (4) 防 止 NOx 溶 于 冷 凝 水
(5)2NO+3H2O2 2H++2N
O3
-
+2H2O (6)锥形瓶、酸式滴定管 (7)
23
×
(�1�1-6�2�2)
3�
×104 (8)偏低 偏高
【解析】 (1)A 中装有无碱玻璃棉,其作用是除去烟道气中的粉尘。(2)C 中填充的干燥剂不能吸收 NOx,因
此不能为碱石灰,而无水 CuSO4 通常只用于检验水而不是吸收水,故该干燥剂为 P2O5。(3)D 的作用是吸收
NOx,故该装置中应装有碱液,为洗气瓶装置,气体从长管进、短管出。(4)NOx 中的 NO2 能溶于水且与水反应,
故加热烟道气的目的是防止 NOx 溶于冷凝水。(5)NO 被 H2O2 氧化为 N
O3
-
,则 H2O2 被还原为 H2O,配平离子
方程式为 2NO+3H2O2 2N
O3
-
+2H++2H2O。(6)K2Cr2O7 标准溶液具有强氧化性,能氧化碱式滴定管下端的
橡胶部分,因此滴定操作使用的玻璃仪器主要有锥形瓶、酸式滴定管。(7)根据滴定原理,可得原溶液中 N
O3
-消 耗 的 n(Fe2+)=(c1mol·L-1×v1×10-3L-c2mol·L-1×v2×1
0
-3
L×6)×
100.00
×
10
-3
mL
20.00
×
10
-3
mL
=5(c1v1-6c2v2)×10-3mol, 则
n(N
O3
-
)=
1
3
n(Fe2+)=
5
3
(c1v1-6c2v2)×1
0
-3
mol, 故 气 样 中 NOx 折 合 成 NO2 的 含 量 为
5
3
(c1v1-6c2v2)×10-3mol×46000mg·mol-1÷(v×10-3)m3=
23
×
(�1�1-6�2�2)
3�
×104mg·m-3。(8)若缺少采样步骤③,则采集
的烟道气中混有空气,测定结果偏低;若 FeSO4 标准溶液部分变质,则消耗的 FeSO4 标准溶液的体积偏大,测
定结果偏高。
4.(1)避免 b 中压强过大(1 分) (2)防止暴沸(1 分) 直形冷凝管(1 分) (3)c 中温度下降,管路中形成负压(2
分) (4)①液封,防止氨气逸出(2 分) ②N
H4
+
+OH- NH3↑+H2O(2 分) 保温使氨完全蒸出(2 分)
(5)
1.4��
�
(2 分)
7.5��
�
(2 分)
【解析】 (1)导管 a 与大气相通,其作用是避免圆底烧瓶内压强过大,发生危险。(2)加热液体时加入碎瓷片,
其作用是防止液体暴沸。根据该冷凝管的形状特点可知其为直形冷凝管。(3)停止加热,瓶内水蒸气冷凝,气
体压强减小,会引起 g 中液体倒吸入 c 中,利用蒸馏水倒吸来洗涤仪器 e、f。(4)①止水夹 k3 处可能漏气,导致
测定的氮元素质量分数偏低,故 d 中保留少量水起液封作用,防止氨气逸出。②e 中发生的主要反应是铵盐与
氢氧化钠的反应,需要加热,使氨气全部逸出。“中空双层玻璃瓶”考生比较陌生,可以联想平时生活中保温玻璃
瓶来分析问题。(5)n(N)=n(NH3)=n(HCl)=
��
1000
mol,w(N)= ��
1000mol
×
14g
·
mol
-1
�g
×100%=
1.4��
�
%。C2H5NO2 的相对分子
质量为 75,w(C2H5NO2)=
1.4��
�
%×
75
14
=
7.5��
�
%。
5.(1)圆底烧瓶(1 分) (2)dbaec(2 分) (3)0.03(2 分) (4)取少量装置 D 内溶液于试管中,滴加 BaCl2 溶液,
生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体(或其他合理答案,3 分) (5)NH3(或氨
气)(2 分) (6)3(NH4)2SO4 4NH3↑+N2↑+3SO2↑+6H2O↑(3 分)
【解析】 (1)根据仪器 X 的形状特点可知其为圆底烧瓶。(2)使用滴定管前需要先检查是否漏液,并对其进
行清洗;然后用标准液润洗,防止对加入的标准液造成稀释;润洗后加入标准液,并排出滴定管中的气泡,防止
对量取的液体体积造成误差;最后读数、记录数值。故正确的顺序为 dbaec。(3)装置 B 中的盐酸吸收 NH3,
设吸收的氨气为 xmol,则有 0.5000mol/L×0.0700L=xmol+0.2000mol/L×0.0250L,得 x=0.03。(4)取少量装置
D 中的溶液于试管中,向其中滴加 BaCl2 溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色、有
刺激性气味的气体。(5)装置 B 中所盛盐酸可吸收碱性气体,故吸收的是 NH3。(6)通过分析所给信息可知
(NH4)2SO4 受热分解过程中 S
O4
2-
被还原,故 N
H4
+
被氧化,而产物中无氮氧化物,故氧化产物为 N2,因此
(NH4)2SO4 分解的化学方程式为 3(NH4)2SO4 3SO2↑+N2↑+4NH3↑+6H2O↑。
6.D ①中灼热碎玻璃起加热作用,浓硝酸受热分解生成红棕色气体(NO2),硝酸中氮元素化合价降低,必有元
素化合价升高,只能为氧元素,因此,还有 O2 生成,产生的气体为混合气体,A 项正确;由①可知,浓硝酸受热分解
可生成红棕色气体,所以②中产生的“红棕色气体”不一定是木炭与浓硝酸发生反应产生的,B 项正确;③中浓
硝酸挥发才能与红热木炭接触,产生的 NO2 是还原产物,C 项正确;红热的木炭还可与空气中的 O2 反应生成
CO2,不一定是木炭与浓硝酸发生反应得到 CO2,D 项错误。
1.B 标准状况下 2.24 L NO 的物质的量为
2.24L
22.4L
·
mol
-1
=0.1 mol,生成 0.1 mol NO 转移电子的物质的量为 0.1
mol×(5-2)=0.3 mol;固体和硝酸恰好完全反应,生成硝酸铜和硝酸镁,铜元素和镁元素均为+2 价,根据得失电
子守恒可知金属的总物质的量为
0.3mol
2
=0.15 mol,根据氮原子守恒,可知 200 mL 的稀硝酸中含有硝酸的物质
的量为 0.15 mol×2+0.1 mol=0.4 mol,该硝酸溶液的浓度为
0.4mol
0.2L
=2.0 mol·L-1,故①正确、②错误;铜粉、镁粉
在空气中充分加热生成 CuO、MgO,所得固体中含有氧元素的物质的量与金属的物质的量相等,则所得固体
的质量为
11.2g
2
+16 g·mol-1×0.15 mol=8.0 g,故③正确、④错误;根据以上分析可知,B 正确。
2.(1) 正 盐 (2)PH3+2ClO-+OH- H2P
O2
-
+2Cl-+H2O 蒸 发 浓 缩 冷 却 结 晶
(3)2NiCl2+NaH2PO2+2H2O 2Ni↓+H3PO4+NaCl+3HCl (4)CaCO3 、Al(OH)3 (5)过量的 Ag+ 会氧化
H2P
O2
-【解析】 (1)H3PO2 是一元中强酸,在水溶液中部分电离生成氢离子和酸根离子,电离方程式为
H3PO2 H++H2P
O2
-
,H2P
O2
-
不能再电离,则 NaH2PO2 为正盐。(2)PH3 与 NaClO 反应可生成 NaH2PO2 和
NaCl,该反应的离子方程式为 PH3+2ClO-+OH- H2P
O2
-
+2Cl-+H2O,从吸收液中获得 NaH2PO2·H2O,需要蒸
发浓缩、冷却结晶、过滤、洗涤和干燥。(3)根据题意,NiCl2 中镍元素转化成镍单质,H2P
O2
-
转化为 H3PO4,
氯化物为 NaCl,依据得失电子守恒写出 2NiCl2+NaH2PO2 2Ni↓+H3PO4+NaCl,产物中有 H3PO4,说明该溶
液呈酸性,左边少氧元素,补 H2O,根据原子守恒得 2NiCl2+NaH2PO2+2H2O 2Ni↓+H3PO4+NaCl+3HCl。
(4)“调 pH”过程中可除去 Ca2+和 Al
O2
-
,CO2 与碱反应可生成 C
O3
2-
,C
O3
2-
与 Ca2+反应生成 CaCO3,Al
O2
-
与 CO2、
H2O 反应可生成 Al(OH)3,因此“滤渣 2”的成分是 CaCO3 和 Al(OH)3。(5)根据题干信息,NaH2PO2 具有强还原
性,可用于化学镀银,Ag+具有氧化性,因此加入 Ag2SO4 悬浊液不宜过量太多,否则过量的 Ag+会氧化 H2P
O2
-
。
3.(1) 6∶1 (2)①-2.2 H3AsO4+OH- H2As
O4
-
+H2O ②4.5 (3)①> ②0.8 8.192×10-2
【解析】 (1)AsH3 的电子式与氨气类似,为 ;将 AsH3 通入 AgNO3 溶液中可生成 Ag、As2O3 和 HNO3,
反应的化学方程式为 2AsH3+12AgNO3+3H2O As2O3+12Ag↓+12HNO3,其中 As 元素化合价升高被氧
化,AsH3 为还原剂,Ag 元素化合价降低被还原,AgNO3 为氧化剂,氧化剂与还原剂的物质的量之比为 6∶1。
(2)①Ka1(H3AsO4)=
�(H
+
)
·
�(H2��O4
-
)
�(H3��O4)
, 根 据 图 1 可 知 ,pH=2.2 时 ,c(H2As
O4
-
)=c(H3AsO4), 则
Ka1(H3AsO4)=c(H+)=1.0×10-2.2,则 lgKa1(H3AsO4)=-2.2;用甲基橙作指示剂,在其变色范围内,As 元素主要以
H2As
O4
-
的形式存在,故甲基橙作指示剂时用 NaOH 溶液滴定 H3AsO4 发生的主要反应的离子方程式为
H3AsO4+OH- H2As
O4
-
+H2O 。 ②Ka2(H3AsO4)=
�(H
+
)
·
�(HAsO4
2-
)
�(H2��O4
-
)
,pH=7 时 ,c(H2As
O4
-
)=c(HAs
O4
2-
), 则
Ka2(H3AsO4)=c(H+)=10-7,Ka3(H3AsO4)=
�(H
+
)
·
�(AsO4
3-
)
�(HAsO4
2-
)
,pH=11.5 时 ,c(HAs
O4
2-
)=c(As
O4
3-
), 则
Ka3(H3AsO4)=c(H+)=10-11.5, 反 应 H2As
O4
-
+As
O4
3-
2HAs
O4
2-
的
K=
�(HAsO4
2-
)
·
�(HAsO4
2-
)
�(H2��O4
-
)
·
�(AsO4
3-
)
=
�(HAsO4
2-
)
·
�(HAsO4
2-
)
�(H2��O4
-
)
·
�(AsO4
3-
)
×
�(H
+
)
�(H
+
)
=
�a2(H3AsO4)
�a3(H3AsO4)
=
10
-7
10
-11.5
=104.5,lgK=4.5。(3)①A 点处反应已经达到平衡,B
点处气体总压小于平衡时的气体总压,说明 B 点处生成的气体比平衡时的少,反应向正反应方向进行,故 B 点
的反应速率 v(正)>v(逆)。②A 点处,lg(p/kPa)=0,则气体总压为 1kPa,AsS(g)在混合气体中的体积分数为
4
5
,S2(g)
在混合气体中的体积分数为
1
5
,则 AsS(g)的分压为 0.8kPa,S2(g)的分压为 0.2kPa,Kp=0.84×0.2=8.192×10-2。
4.(1)研磨、加热(1 分) (2)①<(1 分) ②核电荷数 PS,得电子能力 P
相关文档
- 2019届高考化学一轮复习化学反应中2021-07-0213页
- 2020届高考化学一轮复习化学反应速2021-07-0212页
- 2020届高考化学一轮复习化学实验方2021-07-0219页
- 2019届高考化学一轮复习化学与自然2021-07-028页
- 2020届高考化学一轮复习化学反应速2021-07-0235页
- 2020届高考化学一轮复习化学反应速2021-07-0217页
- 2020届高考化学一轮复习化学能与热2021-07-0210页
- 2021届高考化学一轮复习化学反应速2021-07-0218页
- 2020届高考化学一轮复习化学反应速2021-07-0210页
- 2021届高考化学一轮复习化学平衡状2021-07-028页