- 239.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学平衡状态
【巩固练习】
一、选择题
1.下列说法中错误的是( )。
A.可逆反应在一定条件下可建立化学平衡状态
B.处于化学平衡状态的可逆反应,v(正)=v(逆)≠0
C.可逆反应建立平衡状态时,与反应起始方向无关
D.一定温度下,可逆反应达平衡时,其反应物和生成物的总量相等
2.下列反应属于可逆反应的是( )。
A.H2和O2点燃生成H2O的反应与H2O电解生成H2和O2的反应
B.CuSO4吸水形成晶体蓝矾与蓝矾加热失去水分生成CuSO4
C.Cl2溶于水
D.Na2O溶于水
3.可逆反应N2+3H22NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )。
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
4.关于化学平衡常数的叙述中,正确的是( )。
A.只与化学方程式本身和温度有关
B.只与反应的温度有关
C.与化学反应本身和温度有关,并且会受到起始浓度的影响
D.只与化学反应本身有关,与其他任何条件无关的一个不变的常数
5.X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )。
A.33% B.40% C.50% D.65%
6.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B2C。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )。
①原混合气体的体积为1.2V L ②原混合气体的体积为1.1V L ③反应达到平衡时气体A消耗掉0.05V L ④反应达到平衡时气体B消耗掉0.05V L
A.②③ B.②④ C.①③ D.①④
7.一定温度下,对于可逆反应N2 (g)+3H2 (g)2NH3 (g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )。
A.恒容容器内混合气体的密度不再变化
B.NH3的生成速率与H2的生成速率之比为2∶3
C.恒压容器内混合气体的总物质的量不再变化
D.单位时间内断裂a mol N≡N键,同时断裂6a mol N—H键
8.在一定条件下,测得反应2CO22CO+O2,达到平衡时体系的平均式量为M,则在相同条件下,可以表示CO2
6
分解率的计算式为( )。
A. B. C. D.
9.已知下列反应的平衡常数:①H2 (g)+S (s)H2S (g) K1;②S (s)+O2 (g)SO2 (g) K2,则反应③H2 (g)+SO2 (g)O2 (g)+H2S (g)的平衡常数是( )。
A.K1+K2 B.K1-K2 C.K1×K2 D.
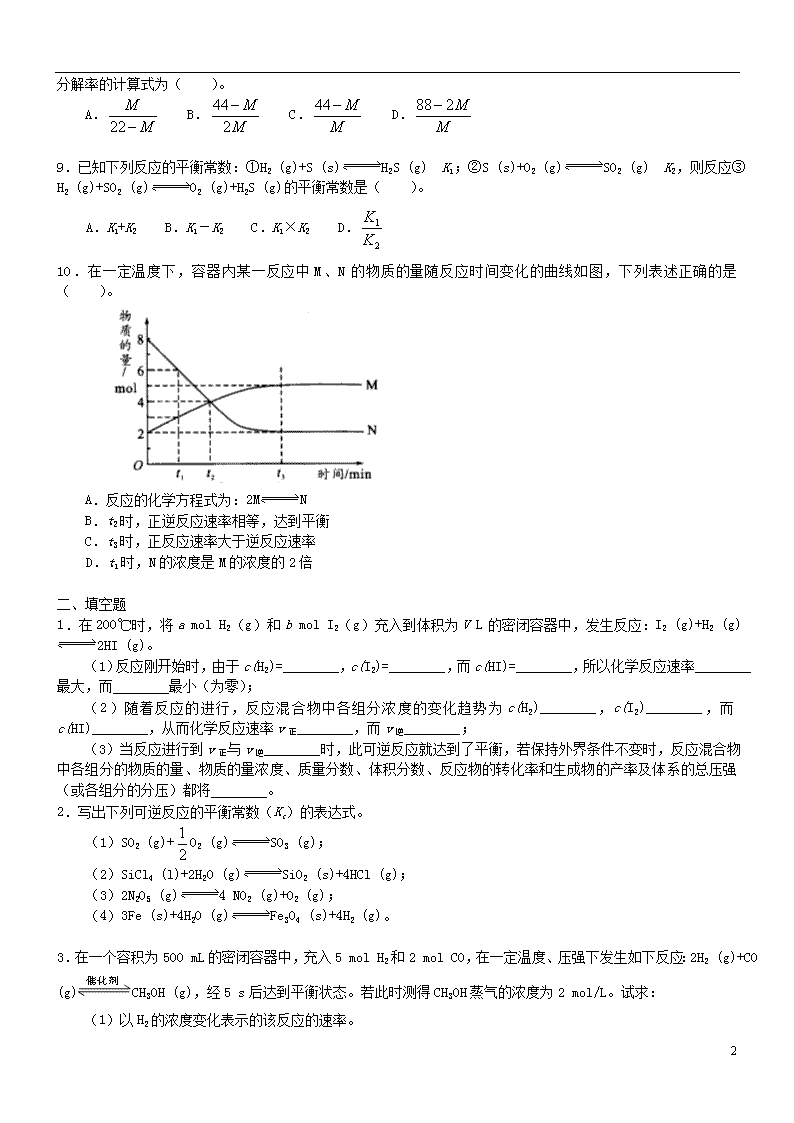
10.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )。
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M的浓度的2倍
二、填空题
1.在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2 (g)+H2 (g)2HI (g)。
(1)反应刚开始时,由于c(H2)=________,c(I2)=________,而c(HI)=________,所以化学反应速率________最大,而________最小(为零);
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________;
(3)当反应进行到v正与v逆________时,此可逆反应就达到了平衡,若保持外界条件不变时,反应混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
2.写出下列可逆反应的平衡常数(Kc)的表达式。
(1)SO2 (g)+O2 (g)SO3 (g);
(2)SiCl4 (l)+2H2O (g)SiO2 (s)+4HCl (g);
(3)2N2O5 (g)4 NO2 (g)+O2 (g);
(4)3Fe (s)+4H2O (g)Fe3O4 (s)+4H2 (g)。
3.在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO,在一定温度、压强下发生如下反应:2H2 (g)+CO (g)CH3OH (g),经5 s后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L。试求:
(1)以H2的浓度变化表示的该反应的速率。
6
(2)达到平衡时CO的转化率。
(3)该温度下的平衡常数K。
4.在密闭容器中,将0.020 mol·L-1 CO和0.020 mol·L-1 H2O (g)混合加热到773 K时,达到下列平衡CO (g)+H2O (g)CO2 (g)+H2 (g),K=9,求CO的转化率。
5.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3 (s)+3CO (g)2Fe (s)+3CO2 (g)
①该反应的平衡常数表达式为K=________。
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①________________,②________________。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。
6.Ⅰ.化学平衡常数K表示可逆反应的进行程度,K值越大,表示________,K值大小与温度的关系是温度升高,K值________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
Ⅱ. 698 K时,在1 L密闭容器中进行的反应H2+I22HI达到平衡,图(A)表示当起始物浓度为1 mol/L H2和1 mol/L I2时,容器内各物质的浓度c的变化与时间t的关系的示意图。
(1)请在图2-2-6(B)中画出当起始物浓度为2 mol/L HI时,容器内各物质的浓度变化与时间关系的示意图。
(2)由图中的事实说明化学平衡具有的特征是________________。
7.合成氨反应N2 (g)+3H2 (g)2NH3 (g)在某温度下达平衡时,各物质的浓度是c(N2)=3 mol·L-1,c(H2)=9 mol·L-1,c(NH3)=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
【参考答案】
一、选择题
1.D
【解析】可逆反应达到平衡时,反应物和生成物的浓度及物质的量分数保持不变。
6
2.C
【解析】A、B两项的反应不是在同一条件下进行,不属于可逆反应;D项反应能进行到底,不属于可逆反应;同一条件下,Cl2与水反应生成HCl和HClO,同时,HCl和HClO反应生成Cl2与水,属于可逆反应。
3.C
【解析】反应进行时,用不同的物质表示速率,数值不同,可它们的比值是固定的。如用N2、H2、NH3分别表示同一正反应速率时,应有如下关系,v正(N2)∶v正(H2)∶v正(NH3)=1∶3∶2。如果化学反应达到平衡时,则v(正)=v(逆)。若用具体物质表示,则速率值应与计量数成比例,且必须指明的是正、逆两个方向。即v正(H2)∶v逆(NH3)=3∶2,v正(N2)∶v逆(NH3)=1∶2,v正(N2)∶v逆(H2)=1∶3。选项A只表示一个方向,选项B、D不符合计量数关系。选项C符合要求。
4.A
【解析】大量实验证明,化学平衡常数决定于两个方面的因素:化学反应的本身和反应体系的温度,与起始浓度等其他外界条件没有任何关系。
5.D
【解析】由已知: X + 2Y2Z
起始: 1 1 0
转化: a 2a 2a
平衡: 1-a 1-2a 2a
根据题意有:,,Y的转化率最接近65%。
6.A
【解析】设起始A和B的体积分别为a L、b L,
A + 3B 2C
起始的体积(L) a b 0
转化的体积(L) 0.05V 0.15V 10%V
平衡时体积(L) a―0.05V b―0.15V 10%V
a―0.05V+b―0.15V+10%V=V,
a+b=1.1V。
7.A
【解析】反应物、生成物均为气体,在恒容容器中质量不变,体积不变,密度恒不变。
8.D
【解析】设起始投入CO2为1 mol,CO2转化率为x,则计算式为:
2CO2 2CO + O2
起始量 1 0 0
变化量 x x
平衡量 1―x x
,则。
6
9.D
【解析】反应①的平衡常数,反应②的平衡常数,反应③的平衡常数。
10.D
【解析】分析本题图像可知,反应开始到时间t3时建立化学平衡。N的变化为8 mol―2 mol=6 mol;M的变化为:5 mol―2 mol=3 mol。因此反应方程式应为2NM或M2N。t2时,M和N的物质的量相等(反应在同一容器中进行,也可理解为浓度相等),但正、逆反应速率并不相等,因为从图中可以看出,反应并未达到平衡。t3时,已达到平衡,此时的正、逆反应速率相等。t1时,N和M的物质的量分别为6 mol和3 mol,故N的浓度是M的2倍。
二、填空题
1.(1) 0 v正 v逆
(2)减小 减小 增大 减小 增大
(3)相等 保持不变
2.(1) (2)
(3) (4)
3.(1)0.8 mol·L―1·s―1 (2)50% (3)0.028 mol―2·L―2
【解析】开始时,
2H2 (g) + CO (g) CH3OH (g)
开始浓度 10 mol·L―1 4 mol·L―1 0
变化浓度 4 mol·L―1 2 mol·L―1 2 mol·L―1
平衡浓度 6 mol·L―1 2 mol·L―1 2 mol·L―1
(1);
(2)CO的转化率为;
(3)。
4.75%
6
【解析】设转化的CO的浓度为x mol·L―1,由题意知
CO (g) + H2O (g) CO2 (g) + H2 (g)
起始浓度/(mol·L―1) 0.020 0.020 0 0
转化浓度/(mol·L―1) x x x x
平衡浓度/(mol·L―1) 0.020―x 0.020―x x x
则,解得x=0.015,
故转化率。
5.(1)① ②0.015 mol / (L·min)
(2)①CO(或CO2)的生成速率与消耗速率相等 ②CO(或CO2)的质量不再改变
(3)b
【解析】由于固态物质的浓度恒定,故该反应的平衡常数K=c3 (CO2) / c3 (CO),结合题中反应及生成11.2 g Fe,可以算出参与反应的CO为0.3 mol,故v(CO)=0.3 mol / (2L·10 min)=0.015 mol / (L·min)。反应达到平衡状态时,正、逆反应速率相等,且混合物中各组分浓度、质量等均恒定。由于铝热反应可以放出大量的热,短时间内可以加快化学反应速率,故图像b比较接近。
6.Ⅰ.可逆反应进行的程度越大 可能增大也可能减小
Ⅱ.(1)如图所示。
(2)①动态平衡;②v(正)=v(逆)≠0;③平衡时各组分浓度保持不变;④一定条件下平衡的建立与途径无关
7.该温度下K=7.32×10―3,起始时c(N2)=5 mol·L―1,c(H2)=15 mol·L―1。
【解析】由题意知:由平衡时各物质的浓度可求出该温度时的平衡常数,再根据合成氨反应方程式和反应起始浓度可求出N2、H2的起始浓度。
N2 (g) + 3H2 (g) 2NH3 (g)
c起始/(mol·L―1) x y 0
c转化/(mol·L―1) a 3a 2a
c平衡/(mol·L―1) 3 9 4
即,
由题意得,解得a=2,x=5,y=15。
6
相关文档
- 2021版新高考化学一轮复习专题7化2021-07-0259页
- 2020届二轮复习化学平衡图像学案(全2021-07-027页
- 2020_2021学年高中化学第二章化学2021-07-027页
- 【推荐】专题2-3-3+化学平衡常数及2021-07-024页
- 湖南版2021高考化学一轮复习专题82021-07-0234页
- 人教版高二化学气体压强对化学平衡2021-07-023页
- 高中化学第二章化学反应速率和化学2021-07-023页
- 2018届一轮复习鲁科版专题八化学反2021-07-0217页
- 山东版2021高考化学一轮复习专题七2021-07-0237页
- 2021届一轮复习人教版化学平衡状态2021-07-0210页