- 2.03 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第3讲 烃的含氧衍生物
见《自学听讲》P250
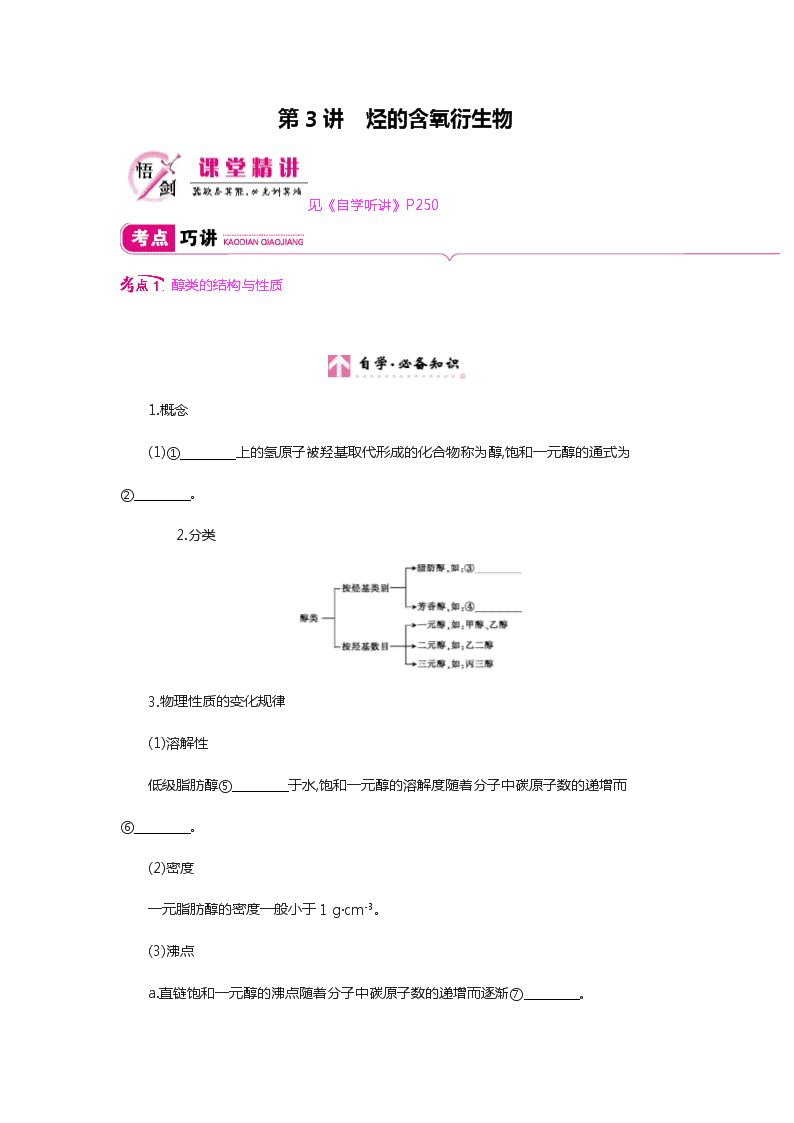
醇类的结构与性质
1.概念
(1)① 上的氢原子被羟基取代形成的化合物称为醇,饱和一元醇的通式为② 。
2.分类
3.物理性质的变化规律
(1)溶解性
低级脂肪醇⑤ 于水,饱和一元醇的溶解度随着分子中碳原子数的递增而⑥ 。
(2)密度
一元脂肪醇的密度一般小于1 g·cm-3。
(3)沸点
a.直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐⑦ 。
b.醇分子间存在⑧ ,所以相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
4.由断键方式理解醇的化学性质
如图所示将醇分子中的化学键进行标号:
以1-丙醇为例,完成下列条件下的化学方程式,并指明断键部位。
(1)与Na反应
⑨ , 。
(2)催化氧化
⑩ , 。
(3)与HBr的取代
, 。
(4)在浓硫酸,加热的条件下的消去反应
, 。
(5)与乙酸的酯化反应
, 。
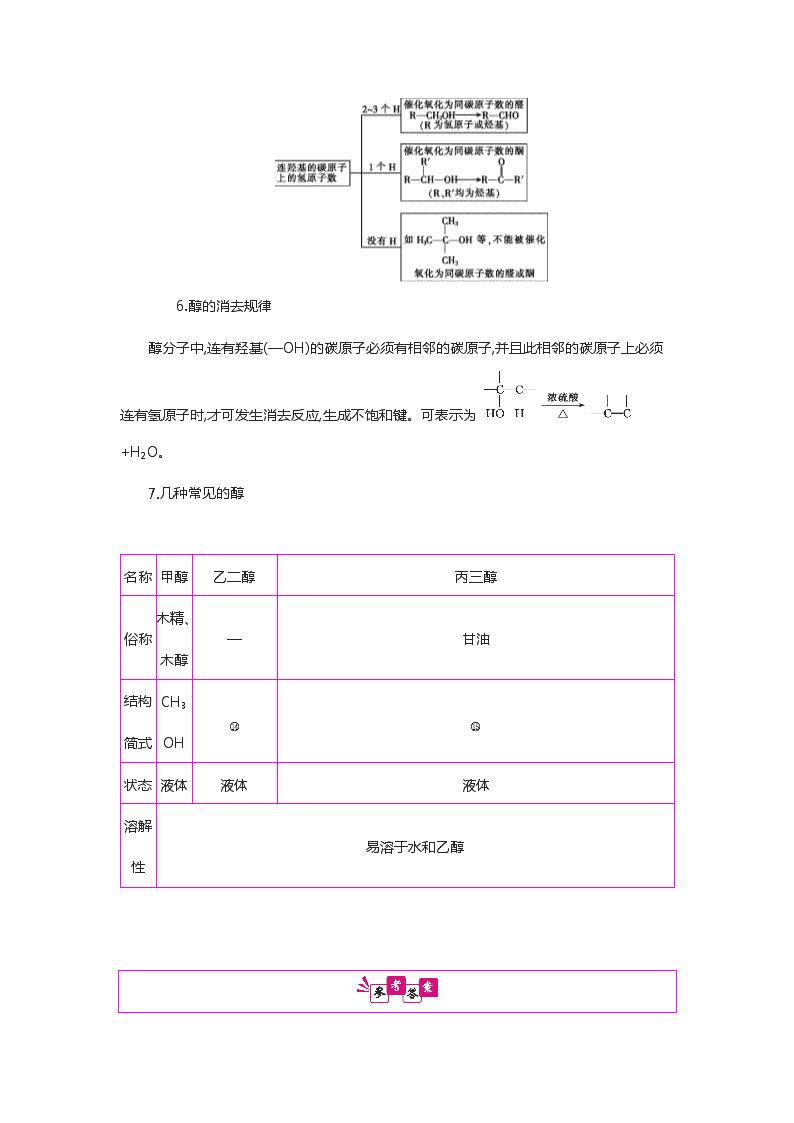
5.醇的催化氧化规律
醇的催化氧化的反应情况与跟羟基(—OH)相连的碳原子上的氢原子的个数有关。
6.醇的消去规律
醇分子中,连有羟基(—OH)的碳原子必须有相邻的碳原子,并且此相邻的碳原子上必须连有氢原子时,才可发生消去反应,生成不饱和键。可表示为+H2O。
7.几种常见的醇
名称
甲醇
乙二醇
丙三醇
俗称
木精、
木醇
—
甘油
结构
简式
CH3OH
状态
液体
液体
液体
溶解性
易溶于水和乙醇
①烃分子中饱和碳原子 ②CnH2n+2O(n≥1)(或CnH2n+1OH) ③C2H5OH ④
⑤易溶 ⑥减小 ⑦升高 ⑧氢键
⑨2CH3CH2CH2OH+2Na2CH3CH2CH2ONa+H2↑ a ⑩2CH3CH2CH2OH+O22CH3CH2CHO+2H2O ac CH3CH2CH2OH+HBrCH3CH2CH2Br+H2O b CH3CH2CH2OH+H2O
be CH3CH2CH2OH+CH3COOHCH3COOCH2CH2CH3+H2O a
1.下列关于醇的叙述错误的是( )。
A.CH3OH和CH2OHCH2OH都属于醇类,且二者互为同系物
B.CH3CH2OH在水中的溶解度大于在水中的溶解度
C.乙醇分子间脱水属于取代反应
D.醇能与羧酸发生酯化反应
答案 A
2.下列各醇中,既能发生消去反应又能发生催化氧化反应的是( )。
A.CH3OH B.
C. D.
答案 B
3.分子式为C4H10O的醇有四种同分异构体,其中:
(1)能发生催化氧化生成醛的醇结构简式为 。
(2)能发生催化氧化生成酮的醇结构简式为 。
(3)不能发生催化氧化的醇结构简式为 。
答案 (1)CH3CH2CH2CH2OH和
(2)
(3)
酚的结构与性质
1.组成与结构
2.物理性质
3.化学性质
(1)羟基中氢原子的反应——弱酸性
电离方程式:C6H5OHC6H5O-+H+,俗称石炭酸,酸性很弱,不能使石蕊试液变红。
由于苯环对羟基的影响,使羟基上的氢更易电离,苯酚的酸性比乙醇的酸性强。
a.与活泼金属反应
与Na反应的化学方程式:⑦。
b.与碱反应
苯酚的浑浊液现象为⑧ 现象为⑨ 。
该过程中发生反应的化学方程式分别为
⑩ ;
。
因为酸性H2CO3>>HCO3-,所以+Na2CO3+NaHCO3,因此向溶液中通入CO2只能生成NaHCO3,与通入CO2量的多少无关。
(2)苯环上氢原子的取代反应:由于羟基对苯环的影响,使苯环上的氢更易被取代。苯酚与浓溴水反应的化学方程式:+3Br2+3HBr。
该反应能产生白色沉淀,常用于苯酚的定性检验和定量测定。
(3)显色反应:苯酚与FeCl3溶液作用呈紫色,利用这一反应可以检验苯酚的存在。
(4)加成反应
与H2: 。
(5)氧化反应:苯酚易被空气中的氧气氧化而显粉红色;易被酸性KMnO4溶液氧化;容易燃烧。
(6)缩聚反应
n+nHCHO 。
4.脂肪醇、芳香醇、酚的比较
类别
脂肪醇
芳香醇
酚
实例
CH3CH2OH
C6H5CH2CH2OH
C6H5OH
官能团
结构
特点
与
链烃基相连
与芳香烃
侧链上的碳原
子相连
与苯环
直接相连
主要化学
性质
(1)与钠反应;(2)取代反应;
(3)消去反应;(4)氧化反应;
(5)酯化反应
(1)弱酸性
(2)取代反应
(3)显色反应
特性
将红热的铜丝插入醇中有刺激性气味产生(生成醛或酮)
遇FeCl3溶液显紫色
① ②C6H5OH ③C6H6O ④
⑤苯环 ⑥酒精 ⑦2C6H5OH+2Na2C6H5ONa+H2↑ ⑧液体变澄清 ⑨溶液又变浑浊
⑩+NaOH+H2O +H2O+CO2+NaHCO3
+3H2
+(n-1)H2O
1.判断正误(正确的打“√”,错误的打“×”)。
(1)苯酚的水溶液呈酸性,说明酚羟基的活泼性大于水中羟基的活泼性。( )
(2)除去苯中的苯酚,加入浓溴水再过滤。( )
(3)分子式为C7H8O的芳香类有机物有5种同分异构体。( )
(4)和含有的官能团相同,二者的化学性质相同。( )
(5)鉴别苯酚溶液与乙醇溶液可滴加FeCl3溶液。( )
(6)酚与芳香醇属于不同类别的有机物,不互为同系物。( )
(7)溶液与少量CO2反应生成NaHCO3,而不生成Na2CO3。( )
答案 (1)√ (2)× (3)√ (4)× (5)√ (6)√ (7)√
2.汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用,其结构简式如图所示。
下列有关汉叙述正确的是( )。
A.汉黄芩素的分子式为C16H13O5
B.该物质遇FeCl3溶液显紫色
C.1 mol该物质与溴水反应,最多消耗1 mol Br2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
解析 A项,汉黄芩素的分子式为C16H12O5,错误;B项,汉黄芩素含有酚羟基,遇FeCl3溶液显紫色,正确;C项,1 mol汉黄芩素与溴水发生取代反应和加成反应,最多消耗2 mol Br2,错误;D项,汉黄芩素中的苯环、羰基和碳碳双键均可与H2发生加成反应,所以与足量H2发生加成反应后,该分子中官能团的种类减少2种,错误。
答案 B
3.白藜芦醇()广泛存在于食物(如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。
(1)1 mol该化合物最终可消耗Br2或H2的物质的量分别是( )。
A.1 mol,1 mol B.3.5 mol,7 mol
C.3.5 mol,6 mol D.6 mol,7 mol
(2)下列不能与白藜芦醇反应的是( )。
A.Na2CO3溶液 B.FeCl3溶液
C.NaHCO3溶液 D.酸性KMnO4溶液
答案 (1)D (2)C
醛的结构与性质
1.醛的概念
醛是由烃基或氢原子与醛基相连而构成的化合物,官能团为—CHO,饱和一元醛的分子通式为CnH2nO(n≥1)。
2.甲醛、乙醛的分子组成和结构
分子式
结构简式
官能团
甲醛
CH2O
HCHO
—CHO
乙醛
C2H4O
CH3CHO
—CHO
3.甲醛、乙醛的物理性质
颜色
状态
气味
溶解性
甲醛
无色
①
刺激性
气味
易溶于水
乙醛
②
与水、乙醇等互溶
4.化学性质(以乙醛为例)
醛类物质既有氧化性又有还原性,其氧化还原关系为醇醛 羧酸。
请写出乙醛的主要反应的化学方程式:
5.在生产、生活中的作用和影响
(1)醛是重要的化工原料,广泛应用于合成纤维、医药、染料等行业。
(2)35%~40%的甲醛水溶液称为⑧ ,具有杀菌消毒作用和防腐性能,常用作农药和消毒剂,用于种子消毒和浸制生物标本。
(3)劣质的装饰材料中挥发出的甲醛,对环境和人体健康影响很大,是室内的主要污染物之一。
①气体 ②液体 ③CH3CHO+H2CH3CH2OH ④2CH3CHO+5O24CO2+4H2O ⑤CH3CHO+2Ag(NH3)2OHCH3COONH4+3NH3+2Ag↓+H2O ⑥CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+3H2O ⑦2CH3CHO+O22CH3COOH ⑧福尔马林
1.判断正误(正确的打“√”,错误的打“×”)。
(1)醛基能写成—CHO或,不能写成—COH。( )
(2)醛类物质发生银镜反应或与新制Cu(OH)2悬浊液的反应均需在碱性条件下。( )
(3)凡是能发生银镜反应的有机物都是醛。( )
(4)醛类既能被氧化为羧酸,又能被还原为醇。( )
(5)1 mol HCHO与足量银氨溶液在水浴加热条件下充分反应,最多生成2 mol Ag。( )
(6)甲酸具有醛的部分化学性质。( )
答案 (1)√ (2)√ (3)× (4)√ (5)× (6)√
2.下列关于丙烯醛()的叙述正确的是( )。
A.丙烯醛是乙醛的同系物
B.向丙烯醛中加入酸性高锰酸钾溶液后,丙烯醛可被氧化成
C.1 mol丙烯醛最多能与2 mol H2发生加成反应
D.1 mol丙烯醛最多能与含有2 mol Br2的溴水发生加成反应
答案 C
3.香茅醛()可作为合成青蒿素的中间体,下列关于香茅醛的叙述正确的有( )。
A.分子式为C10H20O
B.不能发生银镜反应
C.可使酸性KMnO4溶液褪色
D.分子中有7种不同化学环境的氢原子
答案 C
羧酸的结构与性质
1.概念
羧酸是由烃基或氢原子与羧基相连构成的有机化合物。官能团为① 。
饱和一元羧酸分子的通式为② 。
2.甲酸和乙酸的分子组成和结构
分子式
结构简式
官能团
甲酸
CH2O2
HCOOH
—CHO、—COOH
乙酸
C2H4O2
CH3COOH
—COOH
3.物理性质
(1)乙酸
(2)低级饱和一元羧酸:一般易溶于水且溶解度随碳原子数的增加而降低。
4.化学性质
(1)酸的通性:乙酸是一种弱酸,其酸性比碳酸强,在水溶液里的电离方程式为CH3COOHH++CH3COO-。
请写出乙酸表现酸性的主要现象或化学方程式:
(2)酯化反应:CH3COOH和CH3CH218OH发生酯化反应的化学方程式为CH3COOH+C2H518OHCH3CO18OCH2CH3+H2O。
5.乙酸、水、乙醇和碳酸分子中羟基氢活泼性的比较
乙酸
水
乙醇
碳酸
分子
结构
CH3COOH
C2H5OH
遇石蕊
试液
变红
不变红
不变红
变浅红
与Na
反应
反应
反应
反应
与NaOH
反应
不反应
不反应
反应
与
Na2CO3
反应
水解
不反应
反应
与
NaHCO3
反应
水解
不反应
不反应
羟基氢
的活泼
性强弱
CH3COOH>H2CO3>H2O>CH3CH2OH
①—COOH ②CnH2nO2(n≥1) ③2CH3COOH+2Na2CH3COONa+H2↑ ④2CH3COOH+CaO(CH3COO)2Ca+H2O ⑤CH3COOH+NaOHCH3COONa+H2O ⑥2CH3COOH+Na2CO32CH3COONa+CO2↑+H2O
1.某有机物X的结构简式如图所示。若1 mol X分别与足量的H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )。
A.4∶3∶2∶1 B.3∶3∶2∶1
C.4∶3∶2∶2 D.3∶3∶2∶2
答案 A
2.某重要有机合成中间体X的结构如图所示,下列有关该物质的说法正确的是( )。
A.X分子中所有碳原子一定共平面
B.X可以使溴水、酸性KMnO4溶液褪色,且原理不相同
C.标准状况下1 mol X分别和足量Na和NaHCO3反应,生成气体体积相同
D.X与庚二酸()互为同分异构体
解析 分子中碳碳单键是可以绕键轴旋转的,所以不能保证所有碳原子一定共平面,A项错误。X使溴水褪色的原理是碳碳双键与溴水的加成反应,使酸性高锰酸钾溶液褪色的原理是碳碳双键被高锰酸钾氧化,B项正确。X与金属Na或与NaHCO3反应,都是—COOH上活泼氢的作用,1 mol X和足量Na反应得到0.5 mol氢气,和足量NaHCO3反应得到1 mol二氧化碳气体,C项错误。X中有3个氧原子,庚二酸分子中有4个氧原子,所以不可能互为同分异构体,D项错误。
答案 B
3.对羟基扁桃酸是合成农药、香料等的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得。
+OHC—COOH
(乙醛酸) (对羟基扁桃酸)
下列有关说法不正确的是( )。
A.上述三种物质都能与金属钠反应
B.1 mol乙醛酸与足量碳酸氢钠溶液反应能生成1 mol气体
C.对羟基扁桃酸可发生加成反应、取代反应和缩聚反应
D.1 mol对羟基扁桃酸与足量NaOH溶液反应,最多可消耗3 mol NaOH
解析 上述三种物质中分别有酚羟基、羧基、羟基和羧基,都能与钠反应,A项正确;1 mol乙醛酸中含有1 mol羧基,与碳酸氢钠溶液反应能生成1 mol二氧化碳,B项正确;对羟基扁桃酸含有苯环,能发生加成反应,含有羟基和羧基,能发生取代反应、缩聚反应,C项正确;对羟基扁桃酸中的酚羟基、羧基能与NaOH溶液反应,1 mol该物质最多可消耗2 mol NaOH,D项错误。
答案 D
酯的结构与性质
1.酯的结构
羧酸分子羧基中的—OH被—OR'取代后的产物。可简写为RCOOR',官能团为。
2.酯的性质
(1)低级酯的物理性质
气味
状态
密度
溶解性
芳香气味
液体
比水小
水中难溶,易溶于乙醇、乙醚等有机溶剂
(2)化学性质(水解反应)
①反应原理:
②实例:
如CH3COOC2H5在稀硫酸或NaOH催化作用下发生水解反应的化学方程式分别为CH3COOC2H5+H2OCH3COOH+C2H5OH、CH3COOC2H5+NaOHCH3COONa+C2H5OH。
无机酸只起催化作用,碱除起催化作用外,还能中和生成的酸,使水解程度增大。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)酯的水解反应为取代反应。( )
(2)在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH。( )
(3)羧基和酯基中的均能与H2加成。( )
(4)1 mol酯基水解时,只能消耗1 mol NaOH。( )
答案 (1)√ (2)× (3)× (4)×
2.一种新药物结构如图所示,下列有关该化合物的说法正确的是( )。
A.分子式为C17H17N2O6
B.能发生水解反应、聚合反应、取代反应
C.能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
D.分子中含有三种不同的官能团
解析 从分子结构可知其分子式为C17H18N2O6,A项错误;该有机物中含有酯基,能够发生水解、取代反应,含有碳碳双键,能够发生加聚反应,B项正确;含有碳碳双键,既能与氢气发生加成反应,又能与溴发生加成反应,C项错误;分子中含有酯基、硝基、碳碳双键、亚氨基四种官能团,D项错误。
答案 B
3.某有机物的分子式为C4H8O2,下列有关其同分异构体数目的说法中错误的是( )。
A.属于酯类的有4种
B.属于羧酸类的有2种
C.既含有羟基又含有醛基的有3种
D.存在分子中含有六元环的同分异构体
答案 C
4.有芳香气味的分子式为C9H18O2的有机物在酸性条件下加热可水解产生相对分子质量相同的两种有机物,则符合此条件的C9H18O2的结构有( )。
A.8种 B.14种 C.16种 D.18种
答案 C
常见有机反应类型总结
1.判断有机反应类型的常用方法
(1)根据官能团种类判断发生的反应类型。
(2)根据特定的反应条件判断反应类型。
(3)根据反应物和产物的结构不同判断反应类型。
2.常见有机反应类型与有机物类型的关系
基本类型
有机物类别
取
代
反
应
卤代反应
饱和烃、苯和苯的同系物、卤代烃等
酯化反应
醇、羧酸、糖类等
水解反应
卤代烃、酯、低聚糖、多糖、蛋白质等
硝化反应
苯和苯的同系物等
磺化反应
苯和苯的同系物等
加成反应
烯烃、炔烃、苯和苯的同系物、醛等
消去反应
卤代烃、醇等
氧
燃烧
绝大多数有机物
化
反
应
酸性KMnO4溶液
烯烃、炔烃、苯的同系物等
直接(或催化)氧化
酚、醇、醛、葡萄糖等
还原反应
醛、葡萄糖等
聚合
反应
加聚反应
烯烃、炔烃等
缩聚反应
苯酚与甲醛、多元醇与多元羧酸等
与浓硝酸的颜色反应
蛋白质(含苯环的)
与FeCl3溶液的显色反应
酚类物质
1.某有机物的结构简式为
,则其不可能发生的反应有( )。
①加成反应 ②取代反应 ③消去反应 ④氧化反应
⑤水解反应 ⑥与氢氧化钠反应 ⑦与Fe2+反应
A.②③④ B.①④⑥ C.③⑤⑦ D.⑦
解析 该有机物分子中含有酚羟基、酯基、氯原子、碳碳双键,因此兼有苯酚、酯、卤代烃、烯烃的化学性质,能发生加成反应、取代反应、氧化反应、水解反应(酸性或碱性均可),在NaOH醇溶液和加热条件下可发生消去反应(卤代烃消去),可与Fe3+发生显色反应,但不能与Fe2+反应。
答案 D
2.有机物M的结构简式为,下列关于M的说法错误的是( )。
A.分子中含有3种官能团
B.1 mol M最多可与3 mol NaOH反应
C.一定条件下可发生取代、加成、加聚反应
D.能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
答案 B
烃的衍生物之间的转化
一、烃和烃的衍生物转化关系图
二、有机物的推断
1.有机推断题的解题思维模型
2.有机推断的突破口
(1)根据反应中特殊条件进行推断
①NaOH水溶液——卤代烃、酯类的水解反应。
②NaOH醇溶液,加热——卤代烃的消去反应。
③浓硫酸,加热——醇消去、酯化、苯环的硝化等反应。
④溴水或溴的CCl4溶液——烯烃、炔烃的加成反应,酚的取代反应。
⑤O2/Cu,加热——醇的催化氧化反应。
⑥新制的Cu(OH)2悬浊液,加热(或银氨溶液,水浴加热)——醛氧化成羧酸的反应。
⑦稀硫酸——酯的水解等反应。
⑧H2,催化剂——烯烃、炔烃的加成,芳香烃的加成,醛还原成醇的反应。
⑨光照——烷基上的氢原子被卤素原子取代。
⑩Fe或FeX3(X为卤素原子)——苯环上的氢原子被卤素原子取代。
(2)根据特征现象进行推断
①使溴水褪色,则表示该物质中可能含有碳碳双键、碳碳三键、酚羟基(产生白色沉淀)等。
②使酸性KMnO4溶液褪色,则表示该物质中可能含有碳碳双键、碳碳三键或苯的同系物等。
③遇FeCl3溶液显紫色,说明该物质中含有酚羟基。
④与新制的Cu(OH)2悬浊液在加热煮沸时有砖红色沉淀生成,或能发生银镜反应,说明该物质中含有—CHO。
⑤与金属Na反应有H2产生,表示该物质中可能含有—OH或—COOH。
⑥与NaHCO3溶液反应有气体放出,表示该物质中含有—COOH。
⑦遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质。
⑧遇I2变蓝,则说明该物质为淀粉。
(3)根据某些产物推知官能团的位置
①由醇催化氧化成醛(或羧酸),可确定—OH在链端;由醇催化氧化成酮,可确定—OH在链中;若该醇不能被催化氧化,可确定与—OH相连的碳原子上无氢原子。
②由取代产物的种类可确定碳链结构。
③由加氢后碳架结构确定或—C≡C—的位置。
④由有机物发生酯化反应能生成环酯或聚酯,可确定有机物是羟基酸,并根据环的结构,可确定—OH与—COOH的相对位置。
(4)根据数据确定官能团的数目
①
②2—OH(醇、酚、羧酸)H2
③2—COOHCO2,—COOHCO2
④,
—C≡C—(或二烯、烯醛)—CH2CH2—
⑤某有机物与足量的醋酸反应后相对分子质量增加42,则该有机物中含有1个—OH;增加84,则含有2个—OH。
⑥由—CHO转变为—COOH,相对分子质量增加16;若增加32,则含2个—CHO。
⑦当醇被氧化成醛或酮后,若相对分子质量减小2,则含有1个—OH;若相对分子质量减小4,则含有2个—OH。
(5)依据有机物之间的转化关系推断有机物的类别
醇、醛、羧酸、酯之间的相互衍变关系是有机结构推断的重要突破口,它们之间的相互转化关系如图所示:
上图中,A能连续氧化生成C,且A、C在浓硫酸存在下加热生成D,则:
①A为醇,B为醛,C为羧酸,D为酯。
②A、B、C三种物质中碳原子数相同,碳骨架结构相同。
③A分子中含—CH2OH结构。
④若D能发生银镜反应,则A为CH3OH,B为HCHO,C为HCOOH,D为HCOOCH3。
(6)根据核磁共振氢谱推断有机物的结构
有机物的分子中有几种氢原子,在核磁共振氢谱中就出现几种峰,峰面积的大小和氢原子个数成正比。
三、有机物的合成
1.有机合成题的解题思路
2.有机合成中碳骨架的构建
(1)碳链增长的反应
①加聚反应;
②缩聚反应;
③酯化反应;
④利用题目信息所给反应,如醛酮中的羰基与HCN加成,CH3CHO+HCN;
⑤醛、酮的羟醛缩合(其中至少一种有α-H);
⑥苯环上的烷基化反应:+R—Cl+HCl;
⑦卤代烃与活泼金属作用:2CH3Cl+2NaCH3CH3+2NaCl。
(2)碳链减短的反应
①烷烃的裂化反应;
②酯类、糖类、蛋白质等的水解反应;
③利用题目信息所给反应,如烯烃、炔烃的氧化反应,羧酸及其盐的脱羧反应……
(3)常见由链成环的反应
①二元醇成环:HOCH2CH2OH+H2O;
②羟基酸酯化成环:
如+H2O;
③氨基酸成环:
如H2NCH2CH2COOH+H2O;
④二元羧酸成环:
如HOOCCH2CH2COOH+H2O;
⑤利用题目所给信息成环,如常给信息二烯烃与单烯烃的成环:
+。
3.有机合成中官能团的转化
(1)官能团的引入
引入官能团
引入方法
引入卤素原子
①烃、酚的取代;
②不饱和烃与HX、X2的加成;
③醇与氢卤酸(HX)反应
引入羟基
①烯烃与水加成;
②醛酮与氢气加成;
③卤代烃在碱性条件下水解;
④酯的水解
引入碳碳双键
①某些醇或卤代烃的消去;
②炔烃不完全加成;
③烷烃裂化
引入碳氧双键
①醇的催化氧化;
②连在同一个碳上的两个羟基脱水
引入羧基
①醛基氧化;
②酯、肽、蛋白质、羧酸盐的水解
(2)官能团的消除
①通过加成反应可以消除不饱和键(双键、三键、苯环);
②通过消去、氧化或酯化反应等消除羟基;
③通过加成或氧化反应等消除醛基;
④通过水解反应消除酯基、肽键、卤素原子。
(3)官能团的改变
①利用官能团的衍生关系进行衍变,如R—CH2OHR—CHOR—COOH;
②通过某种化学途径使一个官能团变为两个,如
CH3CH2OHCH2CH2ClCH2CH2ClHOCH2CH2OH;
③通过某种手段改变官能团的位置,如:
。
4.官能团的保护
(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH变为—ONa将其保护起来,待氧化后再酸化将其转变为—OH。
(2)碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3)氨基(—NH2)的保护:如在对硝基甲苯合成对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。防止当酸性KMnO4溶液氧化—CH3时,—NH2(具有还原性)也被氧化。
5.熟记中学常见的有机合成路线
(1)一元合成路线
R—CHCH2卤代烃一元醇→一元醛→一元羧酸→酯
(2)二元合成路线
CH2CH2二元醇→二元醛→二元羧酸→链酯环酯高聚酯
(3)芳香化合物合成路线
a.
b.→芳香酯
1.以环戊烷为原料制备环戊二烯的合成路线如图所示:
下列说法正确的是( )。
A.A的结构简式是
B.①②的反应类型分别是取代反应、消去反应
C.反应②③的条件分别是浓硫酸加热、光照
D.酸性KMnO4溶液褪色可证明已完全转化为
解析 以环戊烷为原料制备环戊二烯的合成路线为。A项,由上述分析可知,A为氯代环戊烷;B项,反应①为光照条件下的取代反应,反应②为在氢氧化钠醇溶液中加热发生的消去反应;C项,反应②的反应试剂和反应条件为氢氧化钠醇溶液、加热,反应③的条件为常温;D项,B为环戊烯,含碳碳双键,与环戊二烯均能使酸性高锰酸钾溶液褪色。
答案 B
2.4-溴甲基-1-环己烯的一种合成路线如下:
W X Y Z
下列说法正确的是( )。
A.化合物W、X、Y、Z中均有一个手性碳原子
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
解析 A项,X、Y、Z连接支链的碳原子为手性碳原子,连接4个不同的原子或原子团,W中没有手性碳原子,错误;B项,由官能团的转化可知1,3-丁二烯与丙烯酸乙酯发生加成反应生成X,X发生还原反应生成Y,Y发生取代反应生成Z,正确;C项,由化合物Z一步制备化合物Y,发生的是水解反应,应在氢氧化钠水溶液中进行,错误;D项,Y中含有碳碳双键,会被酸性高锰酸钾溶液氧化,错误。
答案 B
3.由合成水杨酸的路线如下:
(1)反应①的化学方程式为 。
(2)反应②的条件为 。
答案 (1)+Br2+HBr
(2)酸性KMnO4溶液
4.已知:。有多种合成方法合成,写出由乙酸合成的路线流程图(其他原料任选)。
答案 CH3COOH
相关文档
- 2020届高考化学一轮复习化学能与热2021-07-0214页
- 2019届高考化学一轮复习化学反应中2021-07-0213页
- 2020届高考化学一轮复习化学反应速2021-07-0212页
- 2020届高考化学一轮复习化学实验方2021-07-0219页
- 2019届高考化学一轮复习化学与自然2021-07-028页
- 2020届高考化学一轮复习化学反应速2021-07-0235页
- 2020届高考化学一轮复习化学反应速2021-07-0217页
- 2020届高考化学一轮复习化学能与热2021-07-0210页
- 2021届高考化学一轮复习化学反应速2021-07-0218页
- 2020届高考化学一轮复习化学反应速2021-07-0210页