- 116.44 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
湖北省部分重点中学2016—2017学年度上学期高一期中考试
化 学 试 卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
相对原子质量:H-1 C-12 O-16 S-32 Na-23 N-14 Cu-64 Mg-24 Cl-35.5
第Ⅰ卷(选择题 共48分)
一.选择题(每小题3分,共48分,每小题只有一个选项符合题意)
1.我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原因是
A.胶体的电泳 B.血液的氧化还原反应 C.血液中发生复分解反应 D.胶体的聚沉
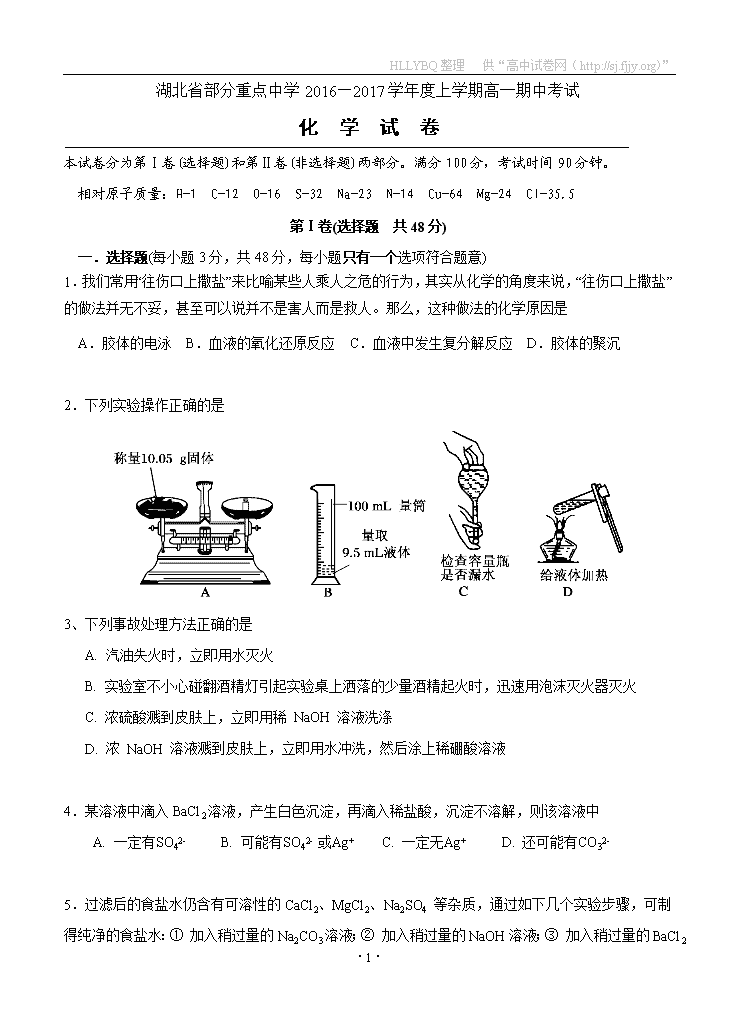
2.下列实验操作正确的是
3、下列事故处理方法正确的是
A. 汽油失火时,立即用水灭火
B. 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火
C. 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D. 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
4.某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中
A. 一定有SO42- B. 可能有SO42- 或Ag+ C. 一定无Ag+ D. 还可能有CO32-
5.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2
·7·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
溶液;④ 滴入稀盐酸至无气泡产生;⑤ 过滤。
正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
6.下列现象或应用中,不能用胶体知识解释的是
A.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
D.在河水与海水交界处有三角洲形成
7.能正确表示四种基本反应类型与氧化还原反应关系的示意图是
8.实验室里需用480 mL0.1mol/L的硫酸铜溶液,现选用500 mL容量瓶进行配制,以下操作正确的是
A.称取7.68g硫酸铜,加入500mL水
B.称取8.0 g硫酸铜,加入500 mL水
C.称取12.5 g胆矾(CuSO4·5H2O)配成500mL溶液
D.称取12.0 g胆矾(CuSO4·5H2O)配成500 mL溶液
9.化学实验设计和操作中必须十分重视安全问题和环保问题。下列实验方法或实验操作不正确的是
①在制取氧气中排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
③水和碘的四氯化碳溶液分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
·7·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
④进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑤酒精着火时可用湿抹布或沙子扑火
⑥用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
A.①⑥ B.②③④ C.②④⑤ D.③④⑤
10.下列混合物的分离方法不可行的是
A.互溶的液态混合物可用分液的方法分离
B.互不相溶的液态混合物可用分液的方法分离
C.沸点不同的液态混合物可用蒸馏方法分离
D.可溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离
11.下列叙述中正确的是
A.氧化还原反应中,一种元素被氧化,一定是另一种元素被还原
B.某元素由化合态变成游离态,此元素可能被氧化,也可能被还原
C.金属单质在反应中只能作还原剂,非金属单质只能作氧化剂
D.金属原子失电子越多,其还原性越强
12.下列反应的离子方程式书写正确的是
A.碳酸钙与盐酸反应:CO32- + 2H+ = H2O + CO2↑
B.稀H2SO4与铁粉反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.氢氧化钡溶液与稀H2SO4反应:Ba2+ + SO42- = BaSO4↓
D.将氢氧化铁放入盐酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
13.下列说法正确的是
A.电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离
B.强电解质与弱电解质的本质区别,是其水溶液导电性的强弱
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是非电解质
14.下列反应中不属于氧化还原反应的是
A.3CuS + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 3S↓ + 4H2O
B.3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
·7·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
C.3CCl4 + K2Cr2O7 = 2CrO2C12 + 3COCl2 + 2KCl
D.2KMnO4 K2MnO4 + MnO2 + O2↑
15.用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
16.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号
物质
杂质
除杂试剂或操作方法
①
NaCl溶液
Na2CO3
加入盐酸,蒸发
②
FeSO4溶液
CuSO4
加入过量铁粉并过滤
③
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④
NaNO3
CaCO3
加稀盐酸溶解、过滤、蒸发、结晶
A.①②③④ B.②③④ C.①③④ D.①②③
第Ⅱ卷(非选择题 共52分)
二.非选择题(本题包括5小题,共52分)
17.(14分)
(1) 在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是______________,只有还原性的是____________,既有氧化性又有还原性的是______________。
(2)分析氧化还原反应2P + 5Br2 + 8H2O = 2H3PO4 + 10HBr,用“双线桥法”表示出反应中电子转移的方向和数目为___________________________________。
·7·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
反应中氧化剂与还原剂的物质的量之比为__________________________________。
(3) 氧化还原反应3S + 6KOH = K2S + K2SO3 + 3H2O中,氧化产物是______________,还原产物是_____________________。该反应的离子方程式为:_________________________________。
18.(10分)现有m g某气体,它由四原子构成一个分子,它的摩尔质量为M g·mol-l。则:
(用含字母的代数式表示)
(1)该气体的物质的量为_______________mol。
(2)该气体中所含的原子总数为______________个(阿伏加德罗常数用NA表示)。
(3)该气体在标准状况下的体积为________________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______________。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_________________mol·L-l。
19.(7分)在含有NO3-、SO42-、CO32-三种离子的溶液中,加入足量的硫酸,其中明显减少的阴离子有_________,明显增加的阴离子有__________;再加入足量的BaCl2溶液明显减少的阴离子有____________,明显增加的阴离子有____________;最后加入足量的AgNO3溶液,则溶液中剩下的阴离子为_______________。其中,向溶液中加入足量的硫酸时的离子方程式为:_______________________________________________________________。
20.(11分)用18 mol·L-l 浓硫酸配制100 ml 3.0 mol·L-l 稀硫酸的实验步骤如下:① 计算所用浓硫酸的体积;② 量取一定体积的浓硫酸;③ 溶解;④ 转移、洗涤;⑤ 定容、摇匀。
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是
(从下列量筒的规格中选用 A. 10mL B. 20mL C. 50mL D. 100mL)
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
·7·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
D. 定容时俯视溶液的液凹面
21.(10分)
在0.2 L NaCl、MgCl2的混合溶液中,部分离子浓度大小如右图所示,回答下列问题:
⑴该混合溶液中,Na+的物质的量为_________mol,
MgCl2的物质的量为_________mol,Cl-的物质的量为_________mol。
⑵该混合溶液中含溶质的总质量为___________g 。
⑶将该混合溶液加水稀释至体积为 1 L,稀释后溶液中Cl-的物质的量浓度为_____mol·L-1 。
·7·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
湖北省部分重点中学2016—2017学年度上学期高一期中考试
化 学 答 案
一.选择题(每小题3分,共48分,每小题只有一个选项符合题意)
1.D 2.C 3.D 4.B 5.A 6.C 7.D 8.C 9.B 10.A 11.B 12.D 13.A 14.C 15.B 16.D
二.填空题(共52分)
17.(14分) (1)Fe3+、Mg2+、H+(2分) S2-、I-(2分) Fe2+、S (2分)
(2) 电子转移的方向和数目为 失去2×5e-
2P + 5Br2 + 8H2O = 2H3PO4 + 10HBr (2分)
得到5×2e-
5:2。 (2分)
(2)K2SO3,K2S。 (各1分共2分) 3S+6OH-=2S2-+SO32-+3H2O。(2分)
18.(10分) (1)。(2分) (2) ×NA。(2分)
(3) ×22.4。(2分) (4) ×100% 。(2分) (5) 。(2分)
19.(7分)CO32-,SO42-;SO42-,Cl-;NO3-(各1分共5分)。 CO32-+2H+=CO2↑+H2O (2分)
20.(11分)(1)16.7mL(3分) B (1分)
(2)先向烧杯加入30mL蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌。(3分)(其他合理答案也给分)
(3)A. 偏小 B. 无影响 C. 偏小 D. 偏大(各1分,共4分)
21.(10分)
(1)0.2,0.3,0.8 (2)40.2 (3)0.8 (每空2分)
欢迎访问“高中试卷网”——http://sj.fjjy.org
·7·
相关文档
- 云南省曲靖市会泽县茚旺高级中学202021-07-024页
- 【化学】黑龙江省绥化市安达市第七2021-07-0219页
- 2021届河北衡水中学新高考模拟试卷2021-07-0216页
- 2021届湖南长郡中学新高考模拟试卷2021-07-0217页
- 2019-2020学年安徽省桐城中学高一2021-07-027页
- 化学卷·2018届宁夏六盘山高中高二2021-07-0242页
- 北京专家2020届高三高考模拟试卷(二2021-07-0219页
- 广东省佛山市禅城区2019-2020学年2021-07-029页
- 化学卷·2018届福建省厦门六中高二2021-07-0222页
- 2018-2019学年甘肃省宁县二中高一2021-07-025页