- 571.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 炔烃 脂肪烃的来源及其应用
[明确学习目标] 1.了解炔烃物理性质的递变规律。2.以乙炔为例,了解炔烃的结构特点及其化学性质。3.掌握乙炔的实验室制法。
一、炔烃
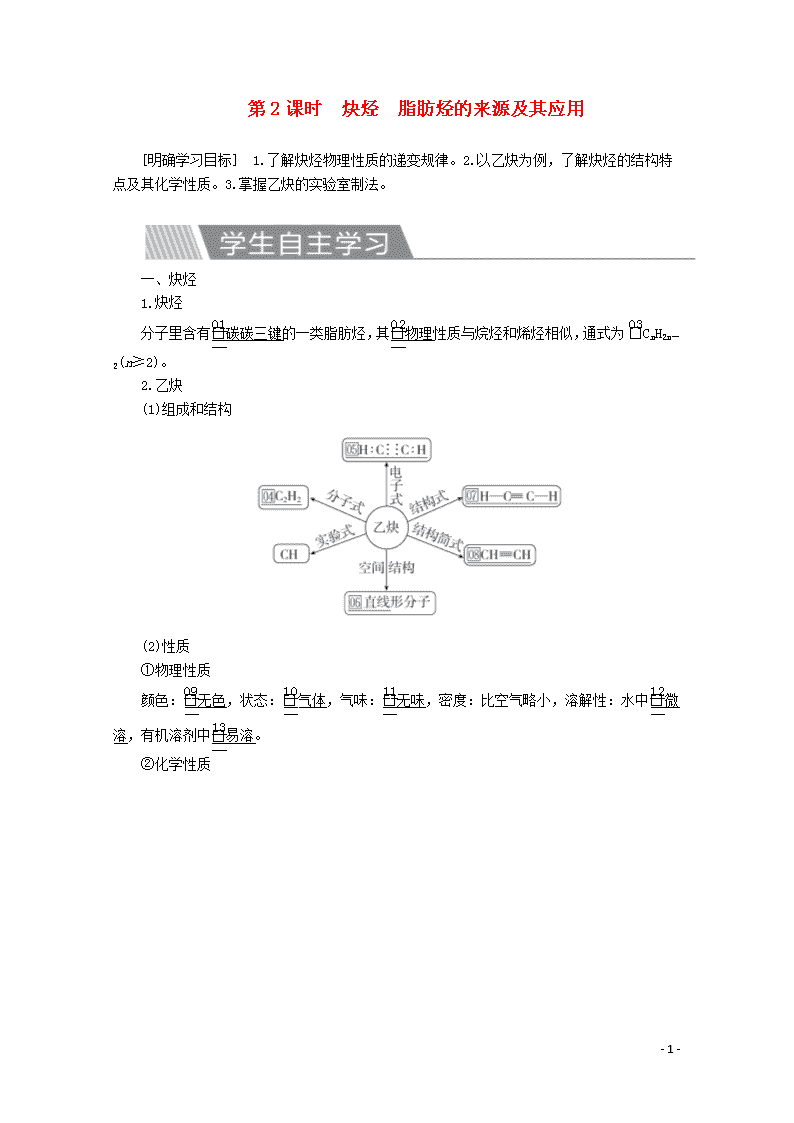
1.炔烃
分子里含有碳碳三键的一类脂肪烃,其物理性质与烷烃和烯烃相似,通式为CnH2n-2(n≥2)。
2.乙炔
(1)组成和结构
(2)性质
①物理性质
颜色:无色,状态:气体,气味:无味,密度:比空气略小,溶解性:水中微溶,有机溶剂中易溶。
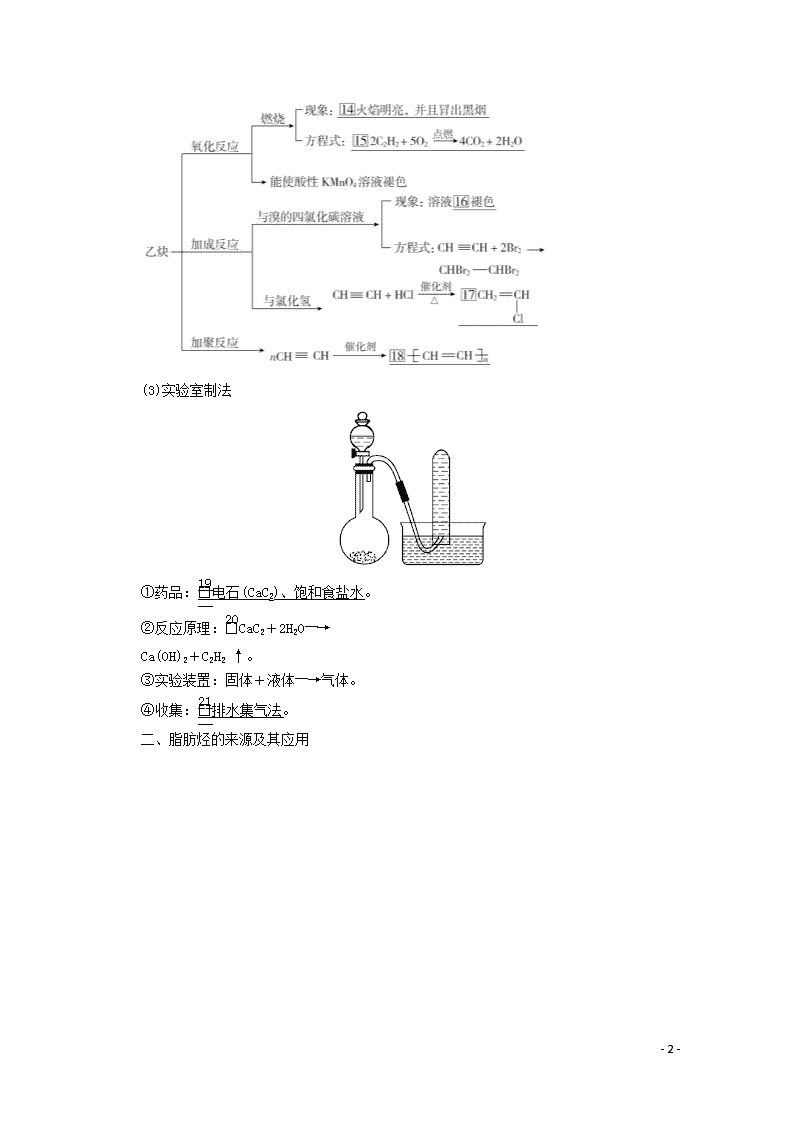
②化学性质
- 8 -
(3)实验室制法
①药品:电石(CaC2)、饱和食盐水。
②反应原理:CaC2+2H2O―→
Ca(OH)2+C2H2 ↑。
③实验装置:固体+液体―→气体。
④收集:排水集气法。
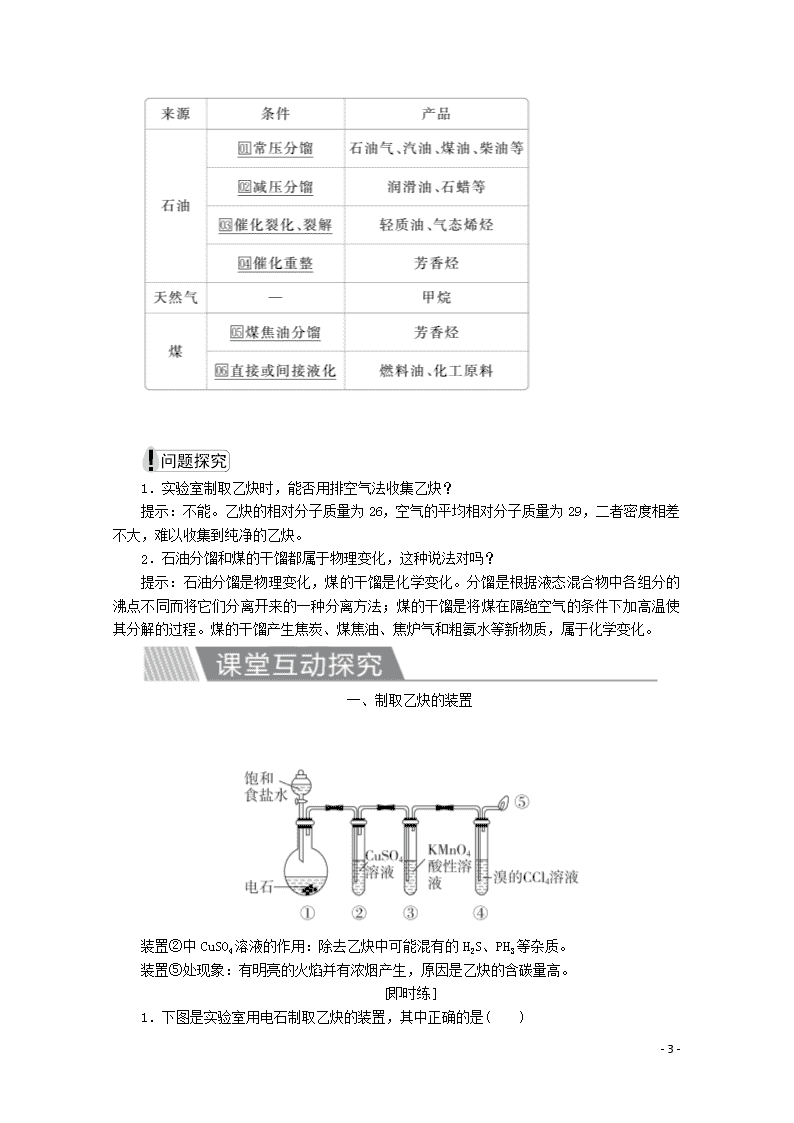
二、脂肪烃的来源及其应用
- 8 -
1.实验室制取乙炔时,能否用排空气法收集乙炔?
提示:不能。乙炔的相对分子质量为26,空气的平均相对分子质量为29,二者密度相差不大,难以收集到纯净的乙炔。
2.石油分馏和煤的干馏都属于物理变化,这种说法对吗?
提示:石油分馏是物理变化,煤的干馏是化学变化。分馏是根据液态混合物中各组分的沸点不同而将它们分离开来的一种分离方法;煤的干馏是将煤在隔绝空气的条件下加高温使其分解的过程。煤的干馏产生焦炭、煤焦油、焦炉气和粗氨水等新物质,属于化学变化。
一、制取乙炔的装置
装置②中CuSO4溶液的作用:除去乙炔中可能混有的H2S、PH3等杂质。
装置⑤处现象:有明亮的火焰并有浓烟产生,原因是乙炔的含碳量高。
[即时练]
1.下图是实验室用电石制取乙炔的装置,其中正确的是( )
- 8 -
答案 C
解析 实验室制取乙炔是用CaC2和水反应,不需要加热,由于CaC2与水反应剧烈,且反应放出大量的热,因此不能用启普发生器,也不能用长颈漏斗,用分液漏斗控制食盐水的滴加以控制反应速率,导气管也不能伸入到液面以下,否则气体无法导出。
2.如图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是__________________________,制取乙炔的化学方程式是________________________,为避免反应太迅速,可采取的措施为________________________。
(2)乙炔通入酸性KMnO4溶液中观察到的现象是____________________,乙炔发生了________反应。
(3)乙炔通入溴的CCl4溶液中可观察到的现象是__________________,乙炔发生了________反应。
(4)为了安全,点燃乙炔前应________,乙炔燃烧时的实验现象是__________________。
答案 (1)调节水面高度以控制反应的发生和停止
CaC2+2H2O―→Ca(OH)2+C2H2↑ 将水换成饱和食盐水 (2)酸性KMnO4溶液褪色 氧化 (3)溴的CCl4溶液褪色 加成 (4)检验乙炔的纯度 火焰明亮并伴有浓烈的黑烟
解析 由图可以看出A管通过橡胶软管与右侧相连,A管的高低可调节右管中的水是否与电石接触,从而控制反应能否发生。为避免反应太快,可把水换成饱和食盐水。可燃性气体点燃前都应检验纯度。由于乙炔的含碳量较高,所以燃烧时火焰明亮并伴有浓烈的黑烟。
方法规律
制取乙炔的注意事项
(1)实验装置在使用前,要先检查气密性。
(2)盛电石的试剂瓶要及时密封并放于干燥处,以防电石吸水而变质。取电石要用镊子夹取,切忌用手拿。
- 8 -
(3)电石与水反应很剧烈,为得到平稳的乙炔气流,可用饱和食盐水代替水,并用分液漏斗控制水的滴加速度,让水逐滴滴入。
(4)由电石制得的乙炔中含有H2S、PH3等杂质,使混合气体通过盛有CuSO4溶液的洗气瓶可将杂质除去。
二、石油化工中分馏、催化裂化与裂解、催化重整三种工艺的比较
[即时练]
3.下列说法错误的是 ( )
A.石油中含有C5~C11的烷烃,通过石油的分馏得到汽油
B.含C20以上的重油经催化裂化可以得到汽油
C.开采天然气(主要成分是甲烷)应做到安全规范的操作
D.煤中含有苯和甲苯,可用分馏的方法把它们分离出来
答案 D
解析 石油中含有C5~C11的烷烃,可以通过石油的常压分馏得到汽油、煤油、柴油等;含C18以上的重油经催化裂化可以得到汽油、煤油、柴油等;煤焦油中含苯和甲苯,可以通过分馏的方法将它们分离出来,但煤是多种无机物和有机物组成的复杂混合物,并不含苯和甲苯等芳香烃。
4.煤和石油等化石燃料对促进经济社会发展起到了重要的作用,这些燃料合理的综合利用是当前节能减排的要求。
- 8 -
请回答下列问题:
(1)石油分馏是石油炼制的重要环节,这种操作是在________(填设备名称)内完成的。工业上通常使用的分馏石油的方法有常压分馏和________,分馏的目的是______________________________________。
(2)石油不仅是重要的燃料,还是重要的化工原料的来源,如利用石油生产乙烯。为了使石油分馏产物进一步生成更多的乙烯、丙烯等短链烃而采取________措施。
(3)目前石油资源逐渐匮乏,人们把目光聚集到储量相对丰富的煤上。目前煤综合利用的主要方法是________、________和煤的气化。
答案 (1)分馏塔 减压分馏 为了获得沸点不同的各种成分 (2)高温裂解 (3)煤的干馏 煤的液化
方法规律
化石燃料及其利用
(1)煤、石油、天然气是当今世界上最重要的三大化石燃料,它们也是脂肪烃的来源。
(2)石油的分馏与蒸馏原理相同,发生的是物理变化;石油的裂化、裂解和催化重整发生的是化学变化。
(3)石油裂化的目的是提高汽油的产量,而石油裂解的目的是为了获得气态不饱和烃。
本课归纳总结
1.炔烃是分子中含有碳碳三键的一类不饱和链烃,官能团为。
2.乙炔是直线形分子,能使溴水或酸性KMnO4溶液褪色,易发生加成反应和氧化反应。
3.实验室制乙炔的反应原理为CaC2+2H2O―→Ca(OH)2+C2H2↑,常用排水法收集,点燃前要验纯。
4.石油的分馏与蒸馏原理相同;石油的裂化是为了提高汽油的产量及质量,裂解是为了获得短链不饱和气态烃,催化重整是为了获取芳香烃。
1.下列关于乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.可通过酸性高锰酸钾溶液来区别烯烃和炔烃
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替水
D.乙炔的收集方法可用排水法收集
答案 B
解析 乙炔中含碳量很高,燃烧时会伴有浓厚的黑烟,A正确。烯烃和炔烃都可以使酸性高锰酸钾溶液褪色,无法区别,B错误。用饱和食盐水可以降低电石和水的反应速率,C正确。乙炔不溶于水,可以用排水法收集,D正确。所以符合题意的答案是B。
2.下列关于乙炔制取的说法不正确的是( )
- 8 -
A.反应后溶液呈碱性
B.此反应是放热反应
C.为了除去杂质气体,可用硫酸铜溶液
D.为了加快反应速率可用饱和食盐水代替水反应
答案 D
解析 电石(主要成分CaC2)与水反应得到乙炔和氢氧化钙,溶液呈碱性,故A正确;电石与水反应放出大量的热,属于放热反应,故B正确;杂质气体有硫化氢,可用硫酸铜除掉,故C正确;不是为了“加快反应速率”,而是为了“减慢反应速率”,故D错误。
3.含有一个三键的炔烃,氢化后结构简式为,此炔烃可能有的结构简式有( )
A.1种 B.2种 C.3种 D.4种
答案 B
解析 炔烃与H2加成后,碳碳三键两端的每个碳原子上至少有2个氢原子,则原碳碳三键的位置可能在①、②、③三个位置,但①、②两个位置等效,则该炔烃可能有2种结构,B正确。
4.某气态烃1 mol能与2 mol HCl完全加成,加成后产物分子中的氢原子又可被6 mol Cl2完全取代,则此气态烃可能是( )
A.CH3C≡CCH3 B.CH2===CH2
C.CH≡CCH3 D.CH2===CHCH3
答案 C
解析 1 mol气态烃能与2 mol HCl完全加成,说明含有1 mol碳碳三键或2 mol碳碳双键,而加成产物能与6 mol Cl2发生取代反应,说明原分子内有4个氢原子,只有C项符合要求。
5.实验室制取乙炔的实验装置图(如图)中,
- 8 -
(1)A仪器的名称为__________________;所盛的试剂为________________;发生反应的化学方程式为:__________________________________________。
(2)将反应产生的乙炔通入酸性高锰酸钾溶液中,观察到的现象是:________________________;将反应产生的乙炔通入溴的四氯化碳溶液中,反应的化学方程式为:__________________________________。(产物为1,2二溴乙烯)
(3)生成的乙炔中可能含有的杂质气体是__________________________,除去的方法是____________________________________。
答案 (1)分液漏斗 饱和食盐水 CaC2+2H2O―→Ca(OH)2+CH≡CH↑
(2)酸性高锰酸钾溶液紫色褪去
(3)硫化氢、磷化氢(H2S、PH3) 将混合气体通过CuSO4溶液洗气
解析 实验室用电石和水反应制取乙炔,由于该反应十分剧烈,所以通常用饱和食盐水代替水并通过分液漏斗控制滴加的速度来减小反应速率。由于电石中常含有硫化钙和磷化钙等杂质,故所制备的乙炔中会混有硫化氢和磷化氢等杂质而有臭味。
(3)生成的乙炔中可能含有的杂质气体是硫化氢、磷化氢(H2S、PH3),除去的方法是将混合气体通过CuSO4溶液洗气,硫化氢和磷化氢与硫酸铜溶液反应转化为硫化铜和磷化亚铜沉淀而除去。
- 8 -
相关文档
- 2020高中化学第二章烃和卤代烃走近2021-07-027页
- 高中化学 烃和卤代烃知识总结 (1)2021-07-025页
- 2019届高考化学一轮复习烃和卤代烃2021-07-0215页
- 2020高中化学第二章烃和卤代烃第一2021-07-026页
- 2015高考化学苏教版一轮复习考点突2021-05-1416页
- 高考化学一轮复习课时分层训练35烃2021-05-146页
- 走向高考高考化学一轮复习 选考部2021-05-147页
- 高考化学人教版一轮复习教学案选2021-05-148页
- 高考化学一轮复习专题演练测试卷102021-05-145页
- 2017高考化学烃和卤代烃辅导讲义无2021-05-1416页