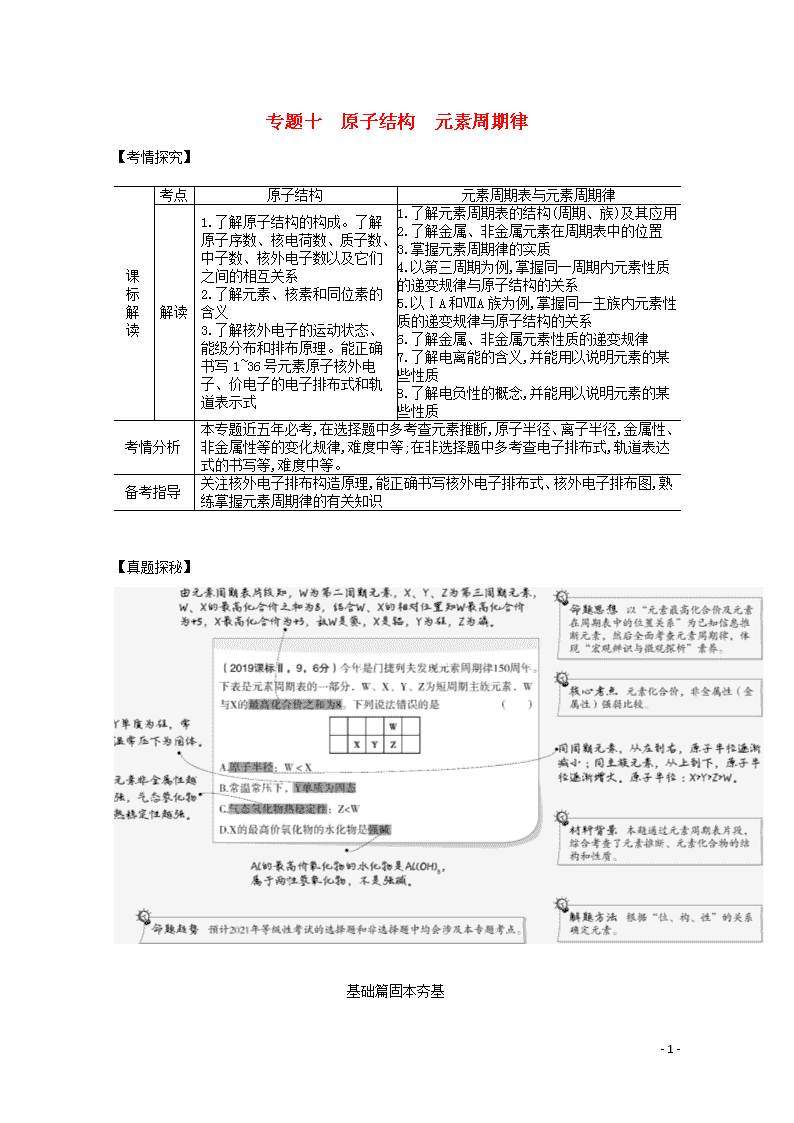
Z>R
C.工业上通常采用电解法冶炼Q的单质
D.RZ2通入BaCl2、Ba(NO3)2溶液中,均无明显现象
答案 C
【五年高考】
- 17 -
考点一 原子结构
1.(2019浙江4月选考,10,2分)下列说法正确的是( )
A.18O2和16O3互为同位素
B.正己烷和2,2-二甲基丙烷互为同系物
C.C60和C70是具有相同质子数的不同核素
D.H2NCH2COOCH3和CH3CH2NO2是同分异构体
答案 B
2.(2019上海选考,1,2分)元素 118295Og中文名为,是一种人工合成的稀有气体元素,下列正确的是( )
A.核外电子数是118 B.中子数是295
C.质量数是177 D.第六周期0族元素
答案 A
3.(2019北京理综,8,6分)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.49115In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
答案 D
4.(2019江苏单科,2,2分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:1718Cl
B.N2的结构式:N N
C.Na+的结构示意图:
D.H2O的电子式:H··O ·· ····H
答案 D
5.(2018课标Ⅱ,10,6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
答案 A
6.(2018课标Ⅲ,8,6分)下列叙述正确的是( )
A.24 g镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数比为2∶1
D.1 mol乙烷和1 mol乙烯中,化学键数相同
答案 B
- 17 -
7.(2018课标Ⅰ,35,15分)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为 、 (填标号)。
- 17 -
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是 。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是 、中心原子的杂化形式为 。LiAlH4中,存在 (填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
图(a)
可知,Li原子的第一电离能为 kJ·mol-1,O O键键能为 kJ·mol-1,Li2O晶格能为 kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为 g·cm-3(列出计算式)。
图(b)
答案 (1)D C
(2)Li+核电荷数较大
(3)正四面体 sp3 AB
(4)520 498 2 908
(5)8×7+4×16NA(0.466 5×10-7)3
考点二 元素周期表与元素周期律
8.(2019浙江4月选考,14,2分)2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是( )
A.第35号元素的单质在常温常压下是液体
B.位于第四周期第ⅤA族的元素为非金属元素
C.第84号元素的最高化合价是+7
D.第七周期0族元素的原子序数为118
答案 C
9.(2019上海选考,15,2分)短周期元素m、n、p、q在元素周期表中的排序如图所示,其中m的气态氢化物与其最高价氧化物对应的水化物能反应。下列说法正确的是( )
m
n
p
q
A.非金属性:m>n
B.氢化物稳定性:nq
D.最高价氧化物对应水化物酸性:p>q
答案 C
10.(2019课标Ⅲ,9,6分)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
- 17 -
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
答案 B
11.(2019江苏单科,8,2分)短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是 ( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
答案 B
12. (2015山东理综,8,5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A.原子半径:XZ
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
答案 C
13.(2019天津理综,7,14分)氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置 。115288Mc的中子数为 。
已知:
P(s,白磷) P(s,黑磷) ΔH=-39.3 kJ·mol-1;
P(s,白磷) P(s,红磷) ΔH=-17.6 kJ·mol-1;
由此推知,其中最稳定的磷单质是 。
(2)氮和磷氢化物性质的比较:
热稳定性:NH3 PH3(填“>”或“<”)。
沸点:N2H4 P2H4(填“>”或“<”),判断依据是 。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是 (填序号)。
a.不能与NaOH反应
b.含离子键、共价键
c.能与水反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式 ,因此,配制SbCl3溶液应注意 。
(5)在1 L真空密闭容器中加入a mol PH4I固体,t ℃时发生如下反应:
PH4I(s) PH3(g)+HI(g) ①
4PH3(g) P4(g)+6H2(g) ②
2HI(g) H2(g)+I2(g) ③
达平衡时,体系中n(HI)=b mol,n(I2)=c mol,n(H2)=d mol,则t ℃时反应①的平衡常数K值为 (用字母表示)。
- 17 -
答案 (14分)(1)第四周期第ⅤA族 173 黑磷
(2)> > N2H4分子间存在氢键
(3)b、c
(4)SbCl3+H2O SbOCl↓+2HCl(“ ”写成“ ”亦可) 加盐酸,抑制水解
(5)(b+8c-2d3)b
14.(2016天津理综,7,14分)下表为元素周期表的一部分。
碳
氮
Y
X
硫
Z
回答下列问题:
(1)Z元素在周期表中的位置为 。
(2)表中元素原子半径最大的是(写元素符号) 。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃。写出该反应的热化学方程式:
。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为 。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。
答案 (1)第三周期,ⅦA族
(2)Si
(3)ac
(4)Si(s)+2Cl2(g) SiCl4(l) ΔH=-687 kJ·mol-1
(5)
Mg2C3+4H2O 2Mg(OH)2+C3H4↑
(6)NO 0.9 mol,NO2 1.3 mol 2 mol
教师专用题组
考点一 原子结构
1.(2016课标Ⅱ,9,6分)a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
答案 A
2.(2015课标Ⅰ,12,6分)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
- 17 -
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y、=或<),其原因是 。
答案 (1)Al (2)1s22s22p63s23p63d104s24p2 GeCl4 C、D (3)B、D (4)> 两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
- 17 -
【三年模拟】
时间:40分钟 分值:70分
一、选择题(每小题2分,共20分。每小题只有一个选项符合题意)
1.(2020届山东等级考模拟,4)某元素基态原子4s轨道上有1个电子,则该基态原子价电子排布不可能是( )
A.3p64s1 B.4s1
C.3d54s1 D.3d104s1
答案 A
2.(2020届济南外国语学校九月测试,8)现有四种元素基态原子的电子排布式:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:④>③>①>②
B.原子半径:④>③>②>①
C.电负性:④>③>①>②
D.最高正化合价:④>③=②>①
答案 C
3.(2020届济南外国语学校九月测试,7)第三周期元素X、Y、Z、W的最高价氧化物分别溶于水可得四种溶液,0.01 mol·L-1的这四种溶液的pH与该元素原子半径的关系如图所示。下列说法正确的是( )
A.简单离子半径:X>Y>Z>W
B.Z与X形成的化合物的水溶液pH>7
C.气态氢化物的稳定性:Z>W>Y
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
答案 B
4.(2020届山东等级考模拟,6)X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如右图所示。下列说法错误的是 ( )
A.X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B.Y的最高价氧化物的水化物为弱酸
C.Y、Z组成的分子可能为非极性分子
D.W是所在周期中原子半径最小的元素
答案 A
- 17 -
5.(2020届青岛高三期中,15)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是( )
A.W、X、Y、Z的简单离子的半径依次增大
B.X的简单氢化物的热稳定性比W的强
C.析出的黄色沉淀易溶于乙醇
D.X与Z属于同一主族,X与Y属于同一周期
答案 B
6.(2019日照一模,11)几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
原子半径/(10-10 m)
1.86
0.99
1.43
1.60
0.75
0.74
主要
化合价
最高正价
+1
+7
+3
+2
+5
……
最低负价
……
-1
……
……
-3
-2
下列说法不正确的是( )
A.由元素X和Q组成的化合物可能含有共价键
B.X、Z、R的最高价氧化物对应水化物可彼此反应
C.简单氢化物的稳定性:Q>Y>R
D.Z和Y形成的化合物为离子化合物
答案 D
7.(2019聊城一模,11)短周期主族元素X、Y、Z、W的原子序数依次增大,X的最简单氢化物分子的空间结构为正四面体,Y的+1价阳离子的电子层结构与氖原子相同。二元化合物E中元素Y和W的质量之比为23∶16。化合物F和G中均含元素Z,且10 mL 0.1 mol/L的F溶液恰好与15 mL 0.2 mol/L的G溶液完全反应,并产生白色沉淀。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.Y和Z的单质组成的混合物可能完全溶于水中
D.W的单质在足量氧气中燃烧,所得产物溶于水可得强酸
答案 C
8.(2019德州一模,10)X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子核外电子总数是其次外层电子数的4倍,Y单质与硫酸铜溶液反应能产生蓝色沉淀,Z单质为淡黄色固体。下列叙述正确的是( )
A.简单离子半径:W>Z>Y>X
B.X2与Z单质反应能直接形成ZX3
C.简单氢化物的还原性:Z>W
D.由X、Y、W组成的化合物的水溶液一定显碱性
答案 C
9.(2019烟台诊断测试,11)短周期元素X、Y、Z、W分属三个周期,且原子序数依次增加。其中Y与X、Z均可形成1∶1或1∶2的二元化合物;X与Z最外层电子数相同;Y与W的一种化合物是一种新型的自来水消毒剂。下列说法错误的是( )
A.常温常压下Y的单质为气态
B.离子半径:W>Z>Y
C.X与Z形成的离子化合物具有还原性
D.W的最高价氧化物的水化物一定是强酸
答案 B
10.(2019济南一模,12)短周期主族元素A、B、C、D、E的原子序数依次增加,A和D的质子数之和等于E的核外电子数,B和D同主族,C的原子半径是短周期主族元素中最大的,A和E组成的化合物AE是常见强酸。下列说法错误的是( )
A.简单离子半径:B>C
B.热稳定性:A2D>AE
- 17 -
C.CA为离子化合物,溶于水所得溶液呈碱性
D.实验室制备AE时可选用D的最高价含氧酸
答案 B
二、选择题(每小题4分,共12分。每小题有一个或两个选项符合题意)
11.(2020届潍坊高三期中,10)2019年是元素周期表发表150周年。已知X、Y、Z、W、M均为短周期元素。25 ℃时,其最高价氧化物对应的水化物(浓度均为0.01 mol·L-1)溶液的pH和原子半径的关系如图所示。下列说法不正确的是( )
A.Y的最高价氧化物的化学式可能为YO2
B.五种元素中只有一种是金属元素
C.W、M简单离子半径大小顺序:WZ>Y
C.简单离子半径:W>Q>Z
D.该中间体中Q都满足8电子稳定结构
答案 AD
13.(2020届淄博高三摸底,12)短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
A.简单离子半径:ZW
D.W2Y2中含有非极性键
答案 BC
三、非选择题(共38分)
14.(2020届济南外国语学校高三九月测试,19)(14分)(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为 。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电能
I1
I2
I3
I4
…
I0/kJ· mol-1
578
1 817
2 745
11 575
…
则该元素的元素符号是 。
(4)NO3-的空间构型 (用文字描述),SO42-中硫原子的杂化方式为 。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是 、中心原子的杂化形式为 。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是 。
- 17 -
(6)与O3分子互为等电子体的一种阴离子为 (填化学式)。
(7)N2分子中σ键与π键的数目比为n(σ):n(π)= 。
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 (用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的式子表示)。
答案 (1)大于 (2)1s22s22p63s23p63d6 (3)Al
(4)平面三角形 sp3杂化 (5)正四面体 sp3 H2S
(6)NO2- (7)1∶2 (8)Cu3N 2.06×1023a3NA
15.(2019聊城二模,35)(11分)元素铜(Cu)、砷(As)、镓(Ga)等形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的价电子排布式为 ,价电子中未成对电子占据的原子轨道的形状是 。
(2)化合物AsCl3分子的立体构型为 ,其中As的杂化轨道类型为 。
(3)第一电离能Ga As。(填“>”或“<”)
(4)若将络合离子[Cu(CN)4]2-中的2个CN-换为两个Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间构型为 ,一个CN-中有 个π键。
(5)砷化镓是一种重要的半导体材料,晶胞结构如图所示。
熔点为1 238 ℃,密度为ρ g·cm-3,该晶体类型为 ,Ga与As以 键键合,Ga和As的相对原子质量分别为Ma和Mb,原子半径分别为ra cm和rb cm,阿伏加德罗常数值为NA,GaAs晶胞中原子体积占晶胞体积的百分率为 。(列出计算公式)
答案 (1)3d104s1 球形 (2)三角锥形 sp3
(3)< (4)正四面体 2
(5)共价晶体 共价 4πNAρ(ra3+rb3)3(Ma+Mb)×100%
16.(2018泰安二模,35)(13分)根据下列五种短周期元素的电离能数据(单位:kJ·mol-1),回答下列问题:
元素
I1
I2
I3
I4
I5
Q
800.6
2 427.1
3 659.7
25 025.8
32 826.7
R
495.8
4 562
6 910.3
9 543
13 354
S
577.5
1 816.7
2 744.8
11 577
14 842
T
1 402.3
2 856
4 578.1
7 475
9 444.9
U
2 080.7
3 952.3
6 122
9 371
12 177
(1)在这五种元素中,最可能处于同一族的两种元素是 (填元素符号),S元素最可能是 区元素。
(2)基态Q元素原子的价电子排布式是 。Q和T同周期,化合物QT中T元素的化合价为 。第一电离能介于Q、T之间的同周期元素有 种。
- 17 -
(3)化合物RT3中含有的化学键类型为 ,RT3中阴离子的几何构型为 。
(4)下列元素中,化学性质和物理性质可能与U元素相似的是 (填序号)。
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X的晶胞结构如图所示,晶胞参数a=0.566 nm,X的化学式为 ,晶体X的密度是 g·cm-3。
答案 (1)B和Al(2分) p(1分)
(2)2s22p1(1分) -3(1分) 3(1分)
(3)离子键、共价键(2分) 直线形(1分)
(4)D(1分) (5)Na2O(1分) 2.27(2分)
- 17 -