- 1.48 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
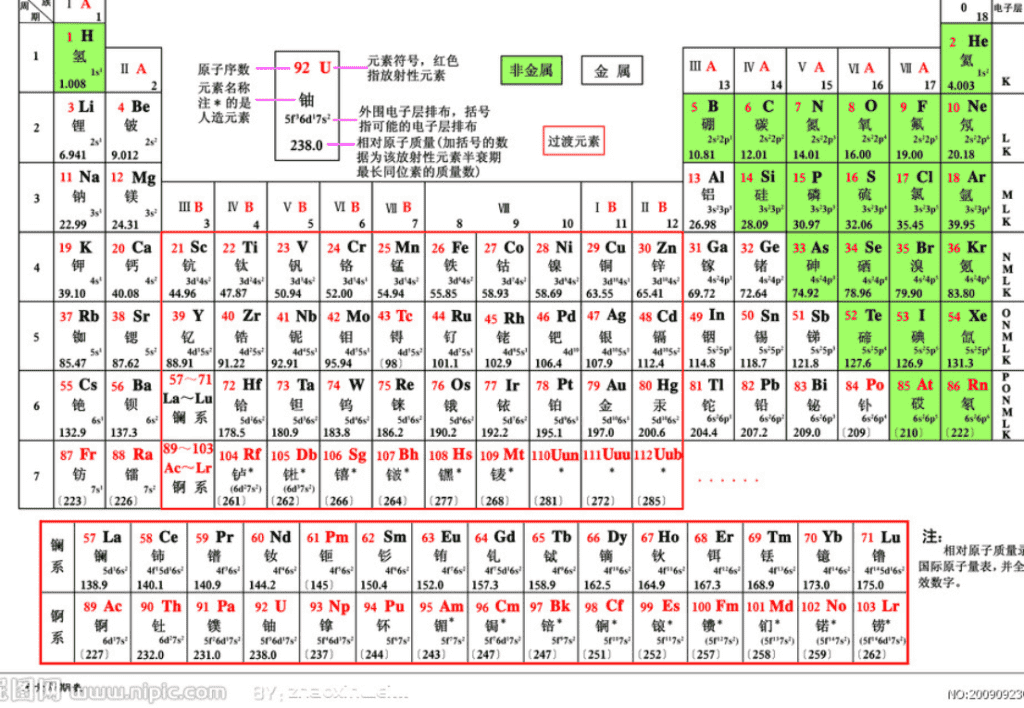
原子结构与元素的性质
第一课时
第二节
周期
短周期
长周期
第
1
周期
(H--He)
:
2
种元素
第
2
周期
(Li--Ne)
:
8
种元素
第
3
周期
(Na--
Ar
)
:
8
种元素
第
4
周期
(K--Kr)
:
18
种元素
第
5
周期
(
Rb--Xe
)
:
18
种元素
第
6
周期
(Cs--
Rn
)
:
32
种元素
不完全周期
第
7
周期:
26
种元素
镧
57
La –
镥
71
Lu
共
15
种元素称镧系元素
锕
89
Ac –
铹
103
Lr
共
15
种元素称锕系元素
周期序数
=
电子层数
(横行)
知识回顾:
元素周期表的结构(由
周期
与
族
构成)
(
应
32
种
)
族
主
族:
副
族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第
VIII
族:
稀有气体元素
主族序数
=
最外层电子数
(纵行)
零族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共七个副族
三个纵行
(
第
8
、
9
、
10
),位于
Ⅶ B
与
ⅠB
中间
知识回顾:
元素周期表的结构
(由
周期
与
族
构成)
元素周期表从
左到右族顺序依次
为:
ⅠA , ⅡA
, ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
,
第
VIII
族
;
ⅠB , ⅡB
,
ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
,
零族
___________________________
___________________________
1
、
写出每个周期开头第一个元素的最外层电子的排布式?
ns
1
(n
表示电子层数
)
第一周期:
s
2
其它周期:
ns
2
np
6
(n
为电子层数
)
2
、
写出每个周期最后一个元素的最外层电子的排布式?
科 学 探 究:书
14
3
、
同族主族元素的价电子层有何规律?
相同
4
、同族
过渡元素的价电子层有何规律?
价电子层上的电子总数相等
5
、
零族元素的价电子层有何规律?
除氦外,其它相同
一、元素周期表的
重新
分区
1
、
s
区:
特点:
价电子数
=
主族序数
=
最外层电子数
①并不是所有价电子层为
ns
1
或
2
的元素都在
S
区,
He
除外(它在
p
区)
注意:
②除
H
外,都是金属元素
含
ⅠA
与
ⅡA
共两族两列
;价电子层为
ns
1
或
2
(n
≥
1)
一、元素周期表的
重新
分区
2
、
p
区:
特点:
①价电子总数
=
主族序数(零族除外)
注意:
He
在
p
区,但它无
p
电子
含
Ⅲ
A
至
Ⅶ
A
及零族
共六族六列
;价电子层为
ns
2
np
1-6
(n
≥
2) ,
②以非金属元素为主
一、元素周期表的
重新
分区
3
、
d
区:
特点:
②价电子总数
=
副族序数
;
若总数为
8
、
9
、
10
,则为
Ⅷ
族。
有元素在
d
区但并不符合
(n-1)d
1-9
ns
1-2
规则,如:
46
Pd 4d
10
。
注意:
①均为金属元素;
含
Ⅲ
B
至
Ⅶ
B
和
Ⅷ
族
共六族八列
(
镧系和锕系属
f
区
)
;价电子层为
(n-1)d
1-9
ns
1-2
一、元素周期表的
重新
分区
4
、
ds
区:含
ⅠB
与
ⅡB
共两族两列
;可理解为电子先填满
(n-1)d (n
≥
4)
,再填
ns,
即价电子层为
(n-1)d
10
ns
1
或
2
,
①
价电子总数
=
所在的列序数
特点
:
②均
为金属元素;且
d
轨道电子一般不参与化学键的形成。
一、元素周期表的
重新
分区
5
、
f
区:包括镧系与锕系;
价电子层
(n-2)f
0-14
(n-1)d
0-2
ns
2
说明:
由于最外层电子数基本相同,
(n-1)d
电子数也基本相同,因此镧系元素化学性质相似;锕系元素化学性质也相似。
ⅠA
0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
p
区
3
s
区
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
4
d
区
ds
区
5
6
7
镧系
f
区
锕系
元素周期表的五个分区
问
:
为什么
s
区、
d
区、
ds
区的元素
都是金属
(
除
H
外
)
?
s
区、
d
区、
ds
区的元素最外层电子数为
1-2
个电子,在反应中易失去,所以都是金属。
原子结构与元素在周期表中的位置是有什么的关系的?
(
1
)周期数
=
最大能层数
(钯除外,
因为
46
Pd [Kr]4d
10
,
最大能层数是
4
,但是在第五周期)
这些你知道吗?
(
2
)外围电子总数决定排在哪一族
如:
29
Cu 3d
10
4s
1
10+1=11
(第
11
列) 所以,是
IB
。
5
、已知某元素在周期表中位于第五周期、
ⅥA
族位置上。试写出该元素基态原子的
价电子排布式、
电子排布式并分析该元素在哪区?
由于是
ⅥA
族,
4d
必是全充满的,
所以
价电子排布为
5s
2
5p
4
,
电子排布式
[Kr]4d
10
5s
2
5p
4
课堂练习
属
P
区
1.
已知某元素的价电子层结构为
3d
5
4s
2
,
试确定其在周期表中的位置。
第四周期,
ⅦB
族。
典例:
2.
试确定
32
号元素在周期表
中的位置。
第四周期,
ⅣA
族
典例:
3.
判断处于第三周期,
ⅣA
族元素的
价电子层结构、原子序数。
3s
2
3p
2
,
第
14
号元素
典例:
下列说法错误的是( )
A. S
区元素的原子价电子层排布都是
s
结尾
B. d
区元素的原子价电子层排布都是
ds
结尾
C.
ds
元素的原子价电子层排布都是
ds
结尾
D. p
区元素的原子价电子层排布都是
sp
结尾
E.
主族元素的原子价电子层排布都含
s
,但都
不含
d
F.
过渡元素的原子价电子层排布都是
ds
结尾
G.
ds
区元素的原子
d
轨道一定全满
BDF
相关文档
- 【化学】天津市南开区2019-2020学2021-07-0216页
- 全国通用2021高考化学一轮复习第十2021-07-025页
- 2017-2018学年江苏省邗江中学高二2021-07-029页
- 高二化学下期中试题合格2021-07-0211页
- 2019-2020版高中化学(人教版 选修3)2021-07-027页
- 【化学】福建省漳州市第一中学20192021-07-0219页
- 【推荐】专题2-2+影响化学反应速率2021-07-027页
- 【化学】福建省三明第一中学2020届2021-07-0226页
- 吉林省延边市长白山第一高级中学202021-07-027页
- 2019届一轮复习鲁科版化学反应的方2021-07-0228页