- 115.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019届高三年级9月份考试化学试卷
一:选择题(每小题只有1个选项符合题意)
7. 用某仪器量一液体体积时,平视时读数为nml,仰视时读数为xml,俯视时读数为yml,若x>n>y,则所用的仪器可能是
A. 量筒 B. 酸式滴定管 C. 碱式滴定管 D. 容量瓶
8. 在下列溶液中,一定能大量共存的一组离子是
A. 溶液的pH=13:ClO-、HCO、Na+、Mg2+
B. 溶液中含有大量NO:NH、I-、SO、H+
C. 溶液中c(HCO)=0.1 mol/L:Na+、K+、CO、Br-
D. 溶液中由水电离出的c(H+)=1×10-13mol/L:Na+、H+、Cl-、Br-
9.下列化学反应属于放热反应的是
A. 浓硫酸溶于水B. 镁溶于盐酸
C. 石灰石煅烧D. Ba(OH)2·8H2O晶体与NH4Cl晶体混合
10. 在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
A. 若M(甲)>M(乙),则气体体积:甲<乙B. 若M(甲)<M(乙),则气体的压强:甲>乙
C. 若M(甲)>M(乙),则气体的摩尔体积:甲<乙D. 若M(甲)<M(乙),则的分子数:甲<乙
11. 下列化学反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
B. 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+
C. 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3﹣+Ba2++OH﹣═BaCO3↓+H2O
12.下列说法不正确的是
A. 甲烷和苯都可以与氯气发生取代反应
B. 乙烯、溴苯分子中的所有原子都处于同一平面上
C. CH3CH2CH(CH3)CH(CH3)2的名称是 2, 3-二甲基戊烷
D. 乙炔、乙烯、苯都能使溴水褪色,其褪色原理相同,都发生加成反应
13. 各取nmol的Na、Mg、Al分别与含有1molHCl的盐酸反应,若Mg和Al产生氢气的物质的量相等且大于Na产生氢气的物质的量,则n的取值范围应满足( )
4
A. n>1 B. n=1 C. 0.5≤n<1 D. n<0.5
第Ⅱ卷 非选择题
26. 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g)N2(g)+2CO2(g) △H1
(1)已知:CO的燃烧热△H2 = -283 kJ·moL-1。几种化学键的键能数据如下:
已知:N2(g)+O2(g) =2NO(g) △H3,则:△H1= __________。
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为c(K+)> c(HCO3-)> c(OH-) > c(H+)> c(CO32-),则负极的反应式为________;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H< 0,相关数据如下:
0 min
5min
10min
15min
20min
c(NO2)
2.0
1.7
1.56
1.5
1.5
c(N2)
0
0.15
0.22
0.25
0.25
①5~10min,用CO的浓度变化表示的反应速率为:____________。
②能说明上述反应达到平衡状态的是__________。
A.2n正(NO2) =n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时_____(填“变大”、“ 变小”或“不变”)。
④计算此温度下的化学平衡常数K=__________。
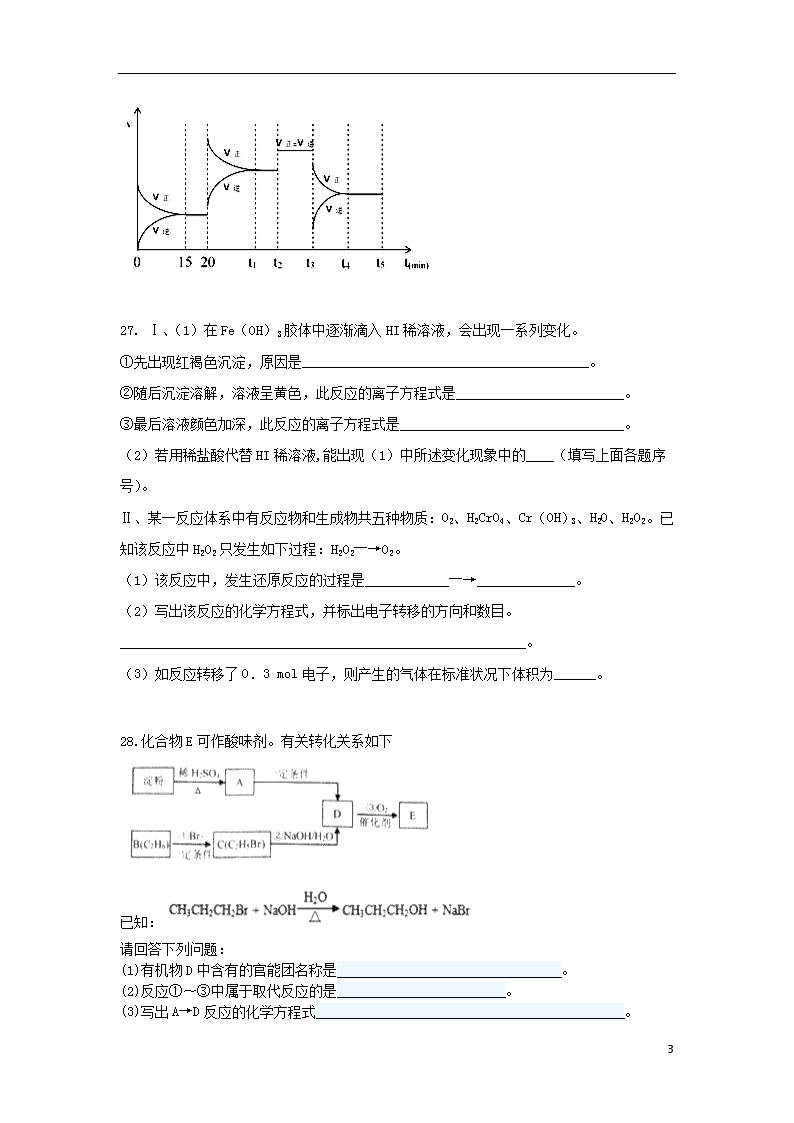
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:_______;在时间15-20,t1-t2,t2-t3,t4-t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系:_____________________。
4
27. Ⅰ、(1)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化。
①先出现红褐色沉淀,原因是_________________________________________。
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是________________________。
③最后溶液颜色加深,此反应的离子方程式是________________________________。
(2)若用稀盐酸代替HI稀溶液,能出现(1)中所述变化现象中的____(填写上面各题序号)。
Ⅱ、某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2―→O2。
(1)该反应中,发生还原反应的过程是____________―→______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目。
__________________________________________________________。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为______。
28.化合物E可作酸味剂。有关转化关系如下
已知:
请回答下列问题:
(1)有机物D中含有的官能团名称是 。
(2)反应①〜③中属于取代反应的是 。
(3)写出A→D反应的化学方程式 。
4
(4)下列说法正确的是 。
A.可以用碘化钾溶液检验淀粉是否完全转化为A
B.B能使Br2的CCl4溶液褪色
C.化合物C不存在同分异构体
D.D和E在浓硫酸条件下能反应生成密度比水小的有机物
参考答案:
一:选择题(每小题只有1个选项符合题意)
7. A8. C9.B10.B11. D12.D13.C
第Ⅱ卷 非选择题
26.(1). —749kJ·moL-1 (2). CO—2e—+3OH—=HCO3—+H2O (3). v(CO)=0.056mol/(L .min) (4). BD (5). 变大 (6). 0.11或1/9 L/ mol (7). 降低温度 (8). K1=K2=K3
相关文档
- 高中化学选修5人教版同步练习及测2021-07-022页
- 2017-2018学年安徽省滁州市民办高2021-07-0221页
- 2019高中化学 第二章 化学反应与能2021-07-024页
- 高中化学必修1人教版课时练习及章2021-07-028页
- 2018-2019学年江西省南昌市八一中2021-07-0222页
- 新教材高中化学课时跟踪检测十一化2021-07-027页
- 高中化学第1章原子结构与性质第1节2021-07-027页
- 高中化学第三章有机化合物3_1最简2021-07-027页
- 2020版高中化学 第一章第2节课时1 2021-07-027页
- 高中化学选修4第3章第1节 弱电解质2021-07-025页