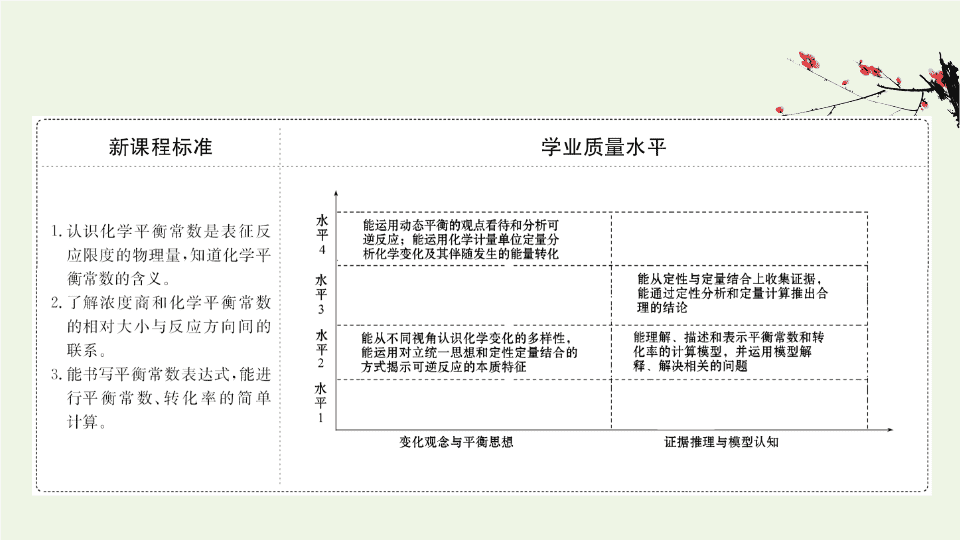
- 1.73 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
节 化学反应的限度
第
1
课时 化学平衡常数 平衡转化率
一、化学平衡常数
1.
定义
:
在一定温度下
,
当一个可逆反应达到化学平衡状态时
,_______
浓度的化
学计量数次幂之积与
_______
浓度的化学计量数次幂之积的比值
,
用符号
K
表示。
2.
表达式
:
以化学反应
aA(g)+bB(g) c C(g)+d D(g)
为例
:
K=______________,
单位
:(mol·L
-1
)
(c+d)-(a+b)
。
必备知识
·
素养奠基
生成物
反应物
3.
意义
:
平衡常数的大小反映化学反应可能进行的
_____;
当
_____
时
,
该反应进行得就基本完全了。
4.
影响因素
:
程度
K>10
5
5.
应用
:
(1)
判断反应可能进行的程度。
K
值
<10
-5
10
-5
~
10
5
>10
5
反应程度
_________
_________
_________
很难进行
反应可逆
进行完全
(2)
判断反应是否达到平衡状态。
对化学反应
aA(g)+bB(g) cC(g)+dD(g)
的任意状态有浓度商
:Q=
Q
与
K
的大小
反应状态
v(
正
)
与
v(
逆
)
Q>K
反应
_____
进行
v(
正
)__v(
逆
)
Q=K
反应达到
_________
v(
正
)__v(
逆
)
Q
(3)
判断反应的热效应。
温度变化
K
值变化
正反应的热效应
升高
增大
___
热
(ΔH>0)
减小
___
热
(ΔH<0)
降低
增大
___
热
(ΔH<0)
减小
___
热
(ΔH>0)
吸
放
放
吸
【
做一做
】
写出下列各反应的平衡常数表达式
:
(1)CO(g)+H
2
O(g) CO
2
(g)+H
2
(g)
(2)3Fe(s)+4H
2
O(g) Fe
3
O
4
(s)+4H
2
(g)
(3)N
2
(g)+3H
2
(g) 2NH
3
(g)
提示
:
(1)K=
(2)K=
(3)K=
【
巧判断
】
(1)
在平衡常数表达式中
,
反应物浓度用起始浓度
,
生成物浓度用平衡浓度
(
)
提示
:
×
。平衡常数的表达式中反应物和生成物的浓度均用的是平衡浓度。
(2)
升高温度
,K
值增大
,
则正反应为放热反应
(
)
提示
:
×
。放热反应的平衡常数随温度的升高而降低。
(3)
平衡常数的大小只与温度有关
,
而与浓度、压强、催化剂等无关
(
)
提示
:
√
。平衡常数只与温度有关。
(4)
从平衡常数的大小可以推断一个反应的进行程度
(
)
提示
:
√
。可以用平衡常数定量描述一个可逆反应进行的程度。
二、平衡转化率
1.
表达式
:
对于化学反应
aA+bB cC+dD,
反应物
A
的平衡转化率为
α(A)=
平衡转化率也可表示为
α(A)= ×100%=
×100%
。
2.
规律
:
(1)
同一反应的不同反应物
,
其转化率可能不同
;
当按照化学计量数之比投入反
应物时
,
反应物转化率相同。
(2)
多种反应物参加反应时
,
提高一种反应物的浓度
,
可以
_____
其他反应物的转
化率
,
而该反应物本身的转化率会
_____
。
提高
降低
【
做一做
】
25℃
时
,
密闭容器中
A
、
B
、
C
三种气体的初始浓度和平衡浓度如下表
:
物质
A
B
C
初始浓度
/mol·L
-1
2
3
0
平衡浓度
/mol·L
-1
1.5
1.5
1
则
A
的平衡转化率为
____,B
的平衡转化率为
____
。
提示
:
α
A
= ×100%=25%,
α
B
= ×100%=50%
。
25%
50%
关键能力
·
素养形成
知识点一 化学平衡状态的判断
【
重点释疑
】
1.
判断依据
(
满足其一即可
):
(1)
正反应速率与逆反应速率相等
,v
(
正
)
=v
(
逆
)
≠0
。
①对同一物质
,
该物质的生成速率等于它的消耗速率
;
②
对不同物质
,
速率之比等于方程式中的化学计量数之比
,
但必须是不同方向的速率。
(2)
反应混合物中各组分的百分含量保持不变。
2.
判断方法
——“
逆向相等
,
变量不变”
:
(1)“
逆向相等”
:
反应速率必须一个是正反应的速率
,
一个是逆反应的速率
,
且经过换算后同一种物质的减少速率和生成速率相等。
(2)“
变量不变”
:
如果一个量是随反应进行而改变的
,
当不变时为平衡状态
;
一个随反应的进行保持不变的量
,
不能作为是否是平衡状态的判断依据。
3.
常见变量归纳
:
项目
mA(g)+nB(g) pC(g)+qD(g)
是否平衡
混合物体系中各成分的含量
①
各物质的物质的量或物质的量浓度一定
平衡
②
各物质的质量或质量分数一定
平衡
③
各气体的体积或体积分数一定
平衡
④
总体积、总压强、总物质的量一定
不一定平衡
压强
①
若
m+n≠p+q
时
,
总压强一定
(
其他条件一定
)
平衡
②m+n=p+q
时
,
总压强一定
(
其他条件一定
)
不一定平衡
项目
mA(g)+nB(g) pC(g)+qD(g)
是否平衡
混合气体的平均相对分子质量
( )
①
一定
,
当
m+n≠p+q
时
平衡
②
一定
,
当
m+n=p+q
时
不一定平衡
温度
任何化学反应都伴随着能量变化
,
当体系温度一定时
,
其他不变
平衡
密度
(ρ)
体系的密度一定
不一定平衡
其他
如体系颜色不再变化
(
当气体均无色时除外
)
平衡
【
思考
·
讨论
】
(1)
当一个可逆反应达到平衡时
,
各物质的浓度保持不变
,
这时反应停止了吗
?
提示
:
没有停止
,
此时
v
正
=v
逆
≠
0
。
(2)
在化学平衡的反应中
,
如何理解正逆反应速率相等
?(
以
N
2
+3H
2
2NH
3
为例
)
提示
:
正、逆反应速率相等针对同一物质来说
:
如
N
2
,
正反应消耗
N
2
的速率与逆
反应生成
N
2
的速率相等。
(3)
若反应体系的总压强不变
,
该可逆反应一定达平衡了吗
?
提示
:
不一定
,
对反应前后气体体积相等的反应
,
压强不变不能作为判据。
(4)
若反应体系的气体密度不变
,
该可逆反应达平衡了吗
?
提示
:
不一定
,
若可逆反应前后都是气体
,
且体系容积不变、密度始终不变
,
不能作为判据。
【
案例示范
】
【
典例
】
(2020·
日照高二检测
)
可逆反应
:2NO
2
2NO+O
2
在恒容的密闭容
器中进行
,
达到平衡状态的标志是
(
)
①
单位时间内生成
n mol O
2
的同时生成
2n mol NO
2
②
单位时间内生成
n mol O
2
的同时生成
2n mol NO
③
用
NO
2
、
NO
、
O
2
表示的反应速率的比为
2∶2∶1
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥
混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤ D.
全部
【
思维建模
】
判断可逆反应是否达到平衡状态的思路如下
:
【
解析
】
选
A
。依据
v
正
=v
逆
≠
0
判断
:①
单位时间内生成
n mol O
2
的同时必消耗
2n mol NO
2
,①
能说明反应已达到平衡
;②
描述的均是正反应速率
,
无法判断
;
③
无论反应是否达到平衡
,
均有此关系
;
依据组成一定判断
:④NO
2
(
红棕色
)
为有
颜色的气体
,
颜色不变能说明反应体系中
NO
2
浓度一定
,
反应已达到平衡
;⑤
因
ρ= ,
反应前后
,m
、
V
均不变
,ρ
也不变
,
不能说明反应达到平衡
;
这是一个反
应前后气体分子数发生改变的反应
,⑥⑦
均能说明反应已达平衡。
【
规律方法
】
“
两步法”突破化学平衡状态标志的判断
(1)
审题干条件
:
一审外界条件是恒温恒容还是恒温恒压
;
二审反应特点
:
①
全部是气体参与的等体积反应还是非等体积反应
;
②
有固体参与的等体积反应还是非等体积反应。
(2)
找准“变量”
,
所用标志必须随着反应的进行在改变
,
当“变量不变”了
,
也就是变量一定了
,
说明达到了平衡。
【
迁移
·
应用
】
1.(2020·
成都高二检测
)
在恒温恒容的密闭体系中
,
可逆反应
:A(s)+2B(g)
2C(g)
ΔH<0,
不能作为该反应达到化学平衡的标志的是
(
)
①v
正
(B)=v
逆
(C)
②n(B)∶n(C)=1∶1
③
容器内压强不再改变
④容器内气体的密度不再改变
⑤容器内混合气体的平均相对分子质量不再改变
A.②④⑤ B.②③ C.①③④ D.①②③④⑤
【
解析
】
选
B
。①当某反应物的正反应速率与某生成物的逆反应速率之比等于系数之比时
,
可推出
v(
正
)=v(
逆
),
即反应达到平衡状态
;②
当反应物与生成物的物质的量之比等于系数之比时
,
无法确定
v(
正
)
与
v(
逆
)
的关系
,
也无法判断是否达到平衡状态
;③
该反应
ΔV=0,
不管是否达到平衡状态
,
压强均不变
;④
、⑤由于
A
为固体
,
当平衡发生移动时
,
恒容条件下气体的质量发生改变
,
气体的密度及平均相对分子质量都发生相应的改变
,
当气体的密度及平均相对分子质量不再改变时说明反应达到平衡。
2.(2020·
福州高二检测
)
在一定条件下能说明
2NO
2
(g) N
2
O
4
(g)
达到平衡
状态的是
(
)
①
温度和体积一定
,
某一物质的浓度不再变化时
②温度和体积一定
,
容器内压强不再变化时
③条件一定
,
混合气体的平均相对分子质量不再变化时
④温度和体积一定
,
混合气体的颜色不再变化时
⑤温度和压强一定
,
混合气体的密度不再变化时
A.①②③ B.②③
C.④⑤ D.①②③④⑤
【
解析
】
选
D
。①只要有一种物质的浓度变化必然会导致另外的物质的浓度发
生变化
,
因此只要有一种物质
(
固体或纯液体除外
)
浓度不变
,
其他物质的浓度
也不会变化。②该反应是反应前后气体体积发生改变的反应
,
所以当随着反应
的进行压强不变时
,
可以用来判断反应达到了平衡状态。③平衡混合物的平均
相对分子质量
,
反应体系的总质量不变
,n
总
也不变
,
即
NO
2
、
N
2
O
4
的物质
的量也不再变化。④反应体系的颜色由
NO
2
的浓度决定
,
颜色不变意味着
NO
2
的
浓度不变
,
是平衡状态的标志。⑤温度、压强不变
,
气体的总质量不变
,
若密度
不变意味着体积不再变化
,
即各组分的物质的量不再变化
,
是平衡状态的标志。
【
素养提升
】
氢是宇宙中分布最广泛的物质
,
它构成了宇宙质量的
75%,
因此氢能被称为人类的终极能源。氢气是一种绿色能源
,
又是一种重要的化工原料。如何将水中的氢释放出来是目前氢能研究的重要课题。
以生物材质
(
以
C
计
)
与水蒸气反应制取
H
2
是一种低耗能、高效率的制
H
2
方法。
该方法由气化炉制造
H
2
和燃烧炉再生
CaO
两步构成。气化炉中涉及的反应为
:
Ⅰ.C(s)+H
2
O(g) CO(g)+H
2
(g)
K
1
;
Ⅱ.CO(g)+H
2
O(g)
CO
2
(g)+H
2
(g)
K
2
;
Ⅲ.CaO(s)+CO
2
(g) CaCO
3
(s)
K
3
;
(1)
该工艺制
H
2
总反应可表示为
C(s)+2H
2
O(g)+CaO(s) CaCO
3
(s)+2H
2
(g),
用
K
1
、
K
2
、
K
3
的代数式表示此反应的平衡常数
K
。
提示
:
已知
:Ⅰ:C(s)+H
2
O(g) CO(g)+H
2
(g)
K
1
,
Ⅱ:CO(g)+H
2
O(g) ==== CO
2
(g)+H
2
(g)
K
2
,
Ⅲ:CaO(s)+CO
2
(g) CaCO
3
(s)
K
3
,
反应
Ⅰ
、
Ⅱ
、
Ⅲ
之和为反应
C(s)+2H
2
O(g)+CaO(s) CaCO
3
(s)+2H
2
(g),
则
K=K
1
·
K
2
·
K
3
。
(2)
在
2 L
的密闭容器中加入一定量的
C(s)
、
H
2
O(g)
和
CaO(s)
。下列说法能否说明制
H
2
总反应达到平衡状态
?
①
容器内混合物的质量不变
②
H
2
与
H
2
O(g)
的物质的量之比不再变化
③混合气体的密度不再变化
④形成
a mol H—H
键的同时断裂
2a mol H—O
键
提示
:
①
根据质量守恒定律
,
容器内混合物的质量始终不变
,
不能判断达到平衡状态
;②H
2
与
H
2
O(g)
的物质的量之比不再变化
,
说明正逆反应速率相等
,
能够判断达到了平衡状态
;③C(s)
为固体
,
反应后气体的质量减小
,
容器的体积不变
,
则混合气体的密度不再变化
,
能够判断达到了平衡状态
;④
形成
a mol H—H
键的同时断裂
2a mol H—O
键描述的都是正反应速率
,
不能判断达到了平衡状态。
(3)
对于反应
Ⅰ,
不同温度和压强对
H
2
产率影响如下表。
压强
温度
p
1
/MPa
p
2
/MPa
500 ℃
45.6%
51.3%
700 ℃
67.8%
71.6%
某同学结合上述表格中的数据就反应
Ⅰ
画出下列图象
,
请你分析图象是否正确
?
提示
:
根据反应
Ⅰ.C(s)+H
2
O(g) CO(g)+H
2
(g)
K
1
;
相同温度条件下
,
减小
压强
,
平衡正向移动
,
氢气的产率增大
,
因此
p
1
>p
2
;
减小压强
,
平衡正向移动
,
图
象①错误
;
根据表格数据
,
升高温度
,
氢气的产率增大
,
说明平衡正向移动
,
图象
②正确
;
升高温度
,
平衡正向移动
,
水的含量减少
,
减小压强
,
平衡正向移动
,
水
的含量减少
,
图象③错误
;
升高温度
,
平衡正向移动
,
平衡常数增大
,
图象④正确。
(4)
对于反应
Ⅲ,
若平衡时再充入
CO
2
,
使其浓度增大到原来的
2
倍
,
判断平衡移
动的方向
;
当重新平衡后
,CO
2
浓度怎么变化
?
提示
:
反应
Ⅲ.CaO(s)+CO
2
(g) CaCO
3
(s),
平衡常数
K
3
= ,
若平衡时再
充入
CO
2
,
使其浓度增大到原来的
2
倍
,
即
c(CO
2
)=2c
平
(CO
2
)
此时
Q= K
3
<
K
3
,
因此平衡正向移动
;
温度不变
,
平衡常数不变
,K
3
=
不变
,
则重新平衡后
,
CO
2
浓度不变。
知识点二 有关化学平衡常数和转化率的计算
【
重点释疑
】
1.
分析三个量
:
即起始量、变化量、平衡量。
2.
明确三个关系
:
(1)
对于同一反应物
,
起始量
-
变化量
=
平衡量。
(2)
对于同一生成物
,
起始量
+
变化量
=
平衡量。
(3)
各变化量之比等于化学方程式中各物质的化学计量数之比。
3.
掌握一种方法
——“
三段式法”
:
化学平衡计算模式
:
对于反应
:mA(g)+nB(g) pC(g)+qD(g),
令
A
、
B
起始物
质的量
(mol)
分别为
a
、
b,
达到平衡后
,A
的消耗量为
mx,
容器容积为
V L
。
mA(g)+nB(g) pC(g)+qD(g)
起始
(mol) a b 0 0
转化
(mol) mx nx px qx
平衡
(mol) a-mx b-nx px qx
建立等式求解
:①K=
②c
平
(A)= mol·L
-1
。
③
α(A)
平
= ×100%,α(A)∶α(B)=
。
④
φ
(A)= ×100%
。
⑤
⑥
g·L
-1
。
⑦
g·mol
-1
。
【
思考
·
讨论
】
(1)
反应
H
2
(g)+I
2
(g) 2HI(g)
的平衡常数是
K,
则反应
2HI(g) H
2
(g)
+I
2
(g)
的平衡常数为多少
?
反应
H
2
(g)+ I
2
(g) HI(g)
的平衡常数为
多少
?
提示
:
反应
2HI(g) H
2
(g)+I
2
(g)
的平衡常数为
, H
2
(g)+ I
2
(g)
HI(g)
的平衡常数为 。
(2)
已知在密闭容器中发生可逆反应
:M(g)+N(g) P(g)+Q(g)
ΔH>0
。
①某温度下
,
反应物的起始浓度分别为
c(M)=2 mol·L
-1
,c(N)=4.8 mol·L
-1
。
若达到平衡后
,M
的转化率为
60%,
此时
N
的转化率为多少
?
提示
:
N
的转化率
= ×100%=25%
。
②某温度下
,
反应物的起始浓度分别为
c(M)=2 mol·L
-1
,c(N)=2 mol·L
-1
。若
达到平衡后
,M
的转化率为
60%,
此时
N
的转化率为多少
?
提示
:
60%
。
【
案例示范
】
【
典例
】
(2020·
揭阳高二检测
)
化学反应
2SO
2
(g)+O
2
(g) 2SO
3
(g)
是硫酸
制造工业的基本反应
,
若在一定温度下
,
将
0.1 mol
的
SO
2
(g)
和
0.06 mol O
2
(g)
注入体积为
2 L
的密闭容器中
,
当达到平衡状态时
,
测得容器中有
0.08 mol
SO
3
(g),
则在该温度下
:
(1)
此反应的平衡常数为
____________
。
(2)SO
2
(g)
和
O
2
(g)
的平衡转化率为
____________,____________
。
【
思维建模
】
解答化学平衡的相关计算流程如下
:
【
解析
】
(1)
2SO
2
(g)+O
2
(g) 2SO
3
(g)
初始浓度
/(mol
·
L
-1
) 0.050 0.030 0
转化浓度
/(mol
·
L
-1
) 0.040 0.020 0.040
平衡浓度
/(mol
·
L
-1
) 0.010 0.010 0.040
K=
=1 600 mol
-1
·
L
。
(2)α(SO
2
)= ×100%=80%;
α(O
2
)= ×100%≈66.7%
。
答案
:
(1)1 600 mol
-1
·
L
(2)80%
66.7%
【
迁移
·
应用
】
1.(2020·
柳州高二检测
)
在容积为
1 L
的密闭容器中
,
将
CO
和水蒸气的混合气
体加热到
800 ℃
时
,
有下列平衡
CO(g)+H
2
O(g) CO
2
(g)+H
2
(g),
且
K=1,
若用
2 mol CO
和
10 mol H
2
O(g)
相互混合并加热到
800 ℃,
则
CO
的转化率为
(
)
A.16.7%
B.50%
C.66.7%
D.83.3%
【
解析
】
选
D
。在一定温度下
,K
是定值。
CO(g)+H
2
O(g) CO
2
(g)+H
2
(g)
初始浓度
/(mol
·
L
-1
) 2 10 0 0
转化浓度
/(mol
·
L
-1
) a a a a
平衡浓度
/(mol
·
L
-1
) 2-a 10-a a a
则
K= =1
解得
a=
故
CO
的转化率为
×100%=83.3%
。
2.(2020·
清远高二检测
)
在某温度下
,
将
H
2
和
I
2
各
0.10 mol
的气态混合物充入
10 L
的密闭容器中
,
充分反应
,
达到平衡后
,
测得
c
平
(H
2
)=0.008 0 mol·L
-1
。
(1)
求该反应的平衡常数
K
。
(2)
在上述温度下
,
该容器中若通入
H
2
和
I
2
蒸气各
0.20 mol,
试求达到化学平衡状态时各物质的物质的量浓度。
【
解析
】
(1)
根据题意知
:
H
2
(g)
+
I
2
(g)
2HI(g)
初始浓度
/(mol
·
L
-1
) 0.010 0.010 0
转化浓度
/(mol
·
L
-1
) 0.002 0 0.002 0 0.004 0
平衡浓度
/(mol
·
L
-1
) 0.008 0 0.008 0 0.004 0
K= =0.25
(2)
设转化的
H
2
的物质的量浓度为
x
。依据题意知
:
H
2
(g)
+
I
2
(g)
2HI(g)
初始浓度
/(mol
·
L
-1
) 0.020 0.020 0
转化浓度
/(mol
·
L
-1
) x x 2x
平衡浓度
/(mol
·
L
-1
) 0.020-x 0.020-x 2x
由于温度不变
,K
不变
,
则有
:
K= =0.25
解得
x=0.004 0 mol
·
L
-1
平衡时
c
平
(H
2
)=c
平
(I
2
)=0.016 mol
·
L
-1
,c
平
(HI)=0.008 0 mol
·
L
-1
。
答案
:
(1)
该反应的平衡常数
K
为
0.25
。
(2)
达到平衡状态时
,c
平
(H
2
)=c
平
(I
2
)=0.016 mol
·
L
-1
,
c
平
(HI)=0.008 0 mol
·
L
-1
。
【
课堂回眸
】
课堂检测
·
素养达标
1.(2020·
周口高二检测
)
一定温度下某容积不变的密闭容器中
,
可逆反应
C(s)+H
2
O(g) CO(g)+H
2
(g)
可建立平衡状态。下列状态中不能确定该反应
已达到平衡状态的是
(
)
A.
体系的压强不再发生变化
B.v
正
(CO)=v
逆
(H
2
O)
C.
生成
n mol CO
的同时生成
n mol H
2
D.1 mol H—H
键断裂的同时断裂
2 mol H—O
键
【
解析
】
选
C
。不论反应是否达到平衡状态
,
生成
n mol CO
的同时都会生成
n mol H
2
。
2.(2020·
牡丹江高二检测
)
对于反应
3Fe(s)+4H
2
O(g) Fe
3
O
4
(s)+4H
2
(g)
的
平衡常数
,
下列说法正确的是
(
)
A.K=
B.K=
C.
增大
c(H
2
O)
或减小
c(H
2
),
会使该反应平衡常数减小
D.
改变反应的温度
,
平衡常数不一定变化
【
解析
】
选
B
。固体反应物或生成物
,
其浓度可看作
1,
在平衡常数表达式中不写
,
故
A
项错误
,B
项正确
;
化学平衡常数只与温度有关
,
而与反应物、生成物的浓度无关
,
故增大
c(H
2
O)
或减小
c(H
2
),
该反应的平衡常数不变
,
但温度改变
,
平衡常数一定改变
,
故
C
、
D
项错误。
3.(2020·
潍坊高二检测
)
等物质的量的
X(g)
与
Y(g)
在密闭容器中进行可逆反
应
:X(g)+Y(g) 2Z(g)+W(s)
ΔH<0,
下列叙述正确的是
(
)
A.
达到平衡时
,X
、
Y
的平衡转化率不同
B.
升高温度
,
平衡常数
K
值增大
C.
平衡常数
K
值越大
,X
的转化率越大
D.
达到平衡时
,
反应速率
v
正
(X)=2v
逆
(Z)
【
解析
】
选
C
。
A
项
,X
与
Y
起始时物质的量相等
,
转化物质的量之比
=
方程式化学
计量数之比
,
故平衡时
α(X)=α(Y),
错误
;B
项
,
该反应
ΔH<0,
即放热反应
,
升高
温度
K
值减小
,
错误
;C
项
,K
值越大
,
反应进行程度即
X
的转化率越大
,
正确
;D
项
,
平衡时
,v
正
(X)= v
逆
(Z),
错误。
4.(2020·
永州高二检测
)
已知某温度下可逆反应
:M(g)+N(g) P(g)+Q(g),
反应物的初始浓度分别为
c
0
(M)=1 mol·L
-1
,c
0
(N)=2.4 mol·L
-1
;
达到平衡
后
,M
的平衡转化率为
60%,
则此时平衡常数
K
的数值为 世纪金榜导学号
(
)
A.0.25
B.0.5
C.1
D.2
【
解析
】
选
B
。
M(g)+ N(g) P(g)+Q(g)
初始浓度
/(mol
·
L
-1
) 1 2.4 0 0
转化浓度
/(mol
·
L
-1
) 0.6 0.6 0.6 0.6
平衡浓度
/(mol
·
L
-1
) 0.4 1.8 0.6 0.6
K= =0.5
。
5.(2020·
襄阳高二检测
)
某温度下
,H
2
(g)+CO
2
(g) H
2
O(g)+CO(g)
的平衡常
数
K=
。该温度下在甲、乙、丙三个恒容密闭容器中
,
投入
H
2
(g)
和
CO
2
(g),
其起
始浓度如表所示。
起始浓度
甲
乙
丙
c(H
2
)/(mol·L
-1
)
0.010
0.020
0.020
c(CO
2
)/(mol·L
-1
)
0.010
0.010
0.020
下列判断不正确的是
(
)
A.
平衡时
,
乙中
CO
2
的转化率大于
60%
B.
平衡时
,
甲中和丙中
H
2
的转化率均是
60%
C.
平衡时
,
丙中
c(CO
2
)
是甲中的
2
倍
,
是
0.012 mol·L
-1
D.
平衡常数的表达式为
K=
【
解析
】
选
C
。设甲容器中氢气和二氧化碳的转化率为
x,
则有
解得
x=60%
。乙容器在甲容器的基础上
c(H
2
)
增大了一倍
,
故乙中
CO
2
的转化率大
于
60%,A
正确
;
丙容器中
H
2
和
CO
2
的浓度是甲容器中
H
2
和
CO
2
的浓度的
2
倍
,
但所给
反应是反应前后气体分子数不变的反应
,
故平衡时
,
甲中和丙中
H
2
的转化率均是
60%,B
正确
;
平衡时
,
甲中
c(CO
2
)
是
0.004 0 mol·L
-1
,
丙中
c(CO
2
)
是甲中的
2
倍
,
是
0.008 0 mol·L
-1
,
故
C
错误
;
根据平衡常数表达式的书写方式
,
可知
D
正确。
6.(
新思维
·
新考向
)
二氧化硫是常用的化工原料
,
也是大气的主要污染物。综
合治理其污染是环境化学当前的重要研究内容之一。硫酸生产中
,SO
2
催化氧化
生成
SO
3
:
2SO
2
(g)+O
2
(g) 2SO
3
(g)
某温度下
,SO
2
的平衡转化率
(α)
与体系总压强
(p)
的关系如图所示。根据图示回答下列问题
:
世纪金榜导学号
(1)
将
2.0 mol SO
2
和
1.0 mol O
2
置于
10 L
密闭容器中
,
反应达平衡后
,
体系总压强为
0.10 MPa
。计算该反应的平衡常数。
(2)
平衡状态由
A
变到
B
时
,
平衡常数
K(A)
、
K(B)
什么关系。
【
解析
】
(1)A
点表示可逆反应
2SO
2
(g)+O
2
(g) 2SO
3
(g)
达平衡状态
,
此时
α(SO
2
)=0.80,
所以建立平衡过程中
SO
2
转化浓度为
×0.80=
0.16 mol
·
L
-1
,
根据化学方程式可求得
O
2
的转化浓度为
×0.16 mol
·
L
-1
=0.08 mol
·
L
-1
,SO
3
生成浓度为
0.16 mol
·
L
-1
,
即有
2SO
2
+ O
2
2SO
3
初始浓度
/(mol
·
L
-1
) 0
转化浓度
/(mol
·
L
-1
) 0.16 0.08 0.16
平衡浓度
/(mol
·
L
-1
) 0.04 0.02 0.16
K= =800 (mol
·
L
-1
)
-1
。
(2)
平衡状态由
A
变到
B
时
,
条件的改变是增大压强
,
温度没有变化
,
所以平衡常数不变
,K(A)=K(B)
。
答案
:
(1)800(mol
·
L
-1
)
-1
(2)K(A)=K(B)
相关文档
- 化学卷·2019届湖南省长沙市麓山国2021-07-0310页
- 2017-2018学年广西陆川县中学高二2021-07-0315页
- 2019-2020学年山东省临沂市蒙阴县2021-07-038页
- 2019届一轮复习人教版化学平衡常数2021-07-0328页
- 2020届高考化学一轮复习(山西专用版2021-07-039页
- 【化学】云南省保山市施甸县一中202021-07-038页
- 【化学】青海省海东市第二中学20192021-07-0314页
- 2018-2019学年吉林省白城市通榆县2021-07-038页
- 广西专用2020版高考化学二轮复习专2021-07-035页
- 2017-2018学年广东省汕头市潮南实2021-07-039页