- 125.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
4.1 富集在海水中的元素——氯①
课型设置:新授课;
学习目标:初步掌握氯气的理化性质;能从从氯的原子结构特点分析氯气的化学性质;了解氯水的成分及其性质。
学习重点: 氯气的化学性质
学习难点: 氯水的成分及其性质
学习内容(包括学法指导)
氯气
通常状况下,氯气是一种________色气体,具有强烈的______气味(闻气味应采用______法)。使用氯气毒气弹除了利用氯气有毒这一性质,还利用了氯气_______________________。
降温至—34.6℃(Cl2的沸点)以下,Cl2由气态变为______态。相比于O2、CO、N2等气体,Cl2属于沸点相对较_______的气体,即______液化的气体。
氯的原子结构示意图为___________________,在周期表中,氯元素位于第三周期的__________(不考虑稀有气体),氯原子______通过_____电子而使最外层达到稳定结构,故氯元素表现为典型的________性(一种____电子的倾向)。
氯在自然界____________游离态。
氯气的化学性质
1、与单质反应
氯气的化学性质____________,能与很多金属单质化合。金属钠、铁、铜均可在氯气中燃烧,化学方程式分别为: Na+Cl2 — ___________(白烟); Fe+ Cl2 — ___________(________色烟);Cu+Cl2 —________(_______色烟)。氯气能将变价金属Fe氧化至_____价,显现了氯气具有______性。
氯气还能与很多非金属单质化合。
①与H2化合。点燃条件下,H2可以在Cl2中___________地燃烧,发出_________色火焰,集气瓶口产生______。(该反应表明,燃烧是______的发_____光_____的____________反应;燃烧________有O2参加)。燃烧生成的HCl气体溶于水既得________________(工业上制________的方法)。
若改变反应条件,H2、Cl2的混合气体经强光照射时,能_______地化合,甚至发生_______。
②与磷化合。点燃条件下,磷可在氯气中剧烈燃烧,产生白色烟雾;Cl2少量时,产物为_________,Cl2足量时,产物为_________。
2、与化合物反应
通入Cl2除去FeCl3溶液中的FeCl2杂质,原理用化学方程式表示为___________________________。
向Na2S溶液中通入Cl2,出现淡黄色浑浊,反应的化学方程式为_________________________。
新制氯水成分、性质的探究
Cl2 _______溶于水,1体积水约能溶解_________体积氯气,所得溶液为新制氯水。
现象
探究、推断、结论
新制氯水呈________色
新制氯水中含有________(化学式)
若向新制氯水中滴加AgNO3溶液,会产生___________
新制氯水中含有_____(离子符号),与该离子匹配的另一种离子为________。故认为,新制氯水中含有________(化学式)
从氧化还原的角度分析,Cl元素化合价有降必有升,必有一种生成物,其中所含Cl元素的化合价____于0价,该物质为HClO(一种___酸)。
①将新制氯水滴在有色布条上,布条褪色;
②将润湿的有色布条放入盛有Cl2的集气瓶中,布条_____;
③将干燥的有色布条放入盛有Cl2的集气瓶中,布条_______;
Cl2和HClO都具有强________性;其中具有漂白性的是________。
新制氯水、潮湿的Cl2,因存在_________而均有漂白作用(这种氧化漂白的过程通常不可逆转)。
综上所述,新制氯水具有如下性质:①挥发性(能逸出_______、_______等物质);②强酸性(氯气与水反应的离子方程式为__________________________________________________);③强氧化性(含有____________________等物质);④漂白性(其中_________具有漂白性);⑤不稳定性(其中________易发生分解,所以,一瓶久置氯水的成分可以认为就是____________。)。
将新制氯水滴入紫色石蕊试液中,现象为______________________________________。
将新制氯水滴在淀粉碘化钾试纸中部,现象为______________________________________。
新制氯水需装在棕色试剂瓶中,原因是____________________________________。
次氯酸盐
因为Cl2在水中溶解度______、HClO不稳定、HClO只能存在于_______中,用氯水做漂白剂不方便,难以保存;所以,常将Cl2与碱反应,制得较稳定的次氯酸盐。①Cl2通入NaOH溶液中,发生的反应离子方程式为__________________________________________;②Cl2通入石灰乳中,发生的反应化学方程式为___________________________________(离子方程式为_________________________) ,该反应用于工业制漂白粉,漂白粉是混合物,成分是_________,起漂白作用的有效成分是______。
根据需要,使用时再将次氯酸盐转化为次氯酸。①向次氯酸钠溶液中滴加稀盐酸,离子方程式为______________________________;②向次氯酸钙溶液中通入CO2,会产生白色沉淀,化学方程式为________________________________________________________。(若漂白粉未能妥善保存,即会发生上述反应②。此外,由于HClO不稳定,受热或见光易分解,化学方程式为_________________________;就会导致漂白粉失效)。
2
4.2 富集在海水中的元素——氯②
课型设置:新授课;
学习目标:简单了解卤族元素单质的理化性质;学习氯气的实验室制法以及氯气的精华、干燥、收集方法;掌握Cl-的检验方法。
学习重点: 氯气的实验室制法 Cl-的检验方法
学习难点: 卤族单质的理化性质
学习内容(包括学法指导)
氯气的实验室制法
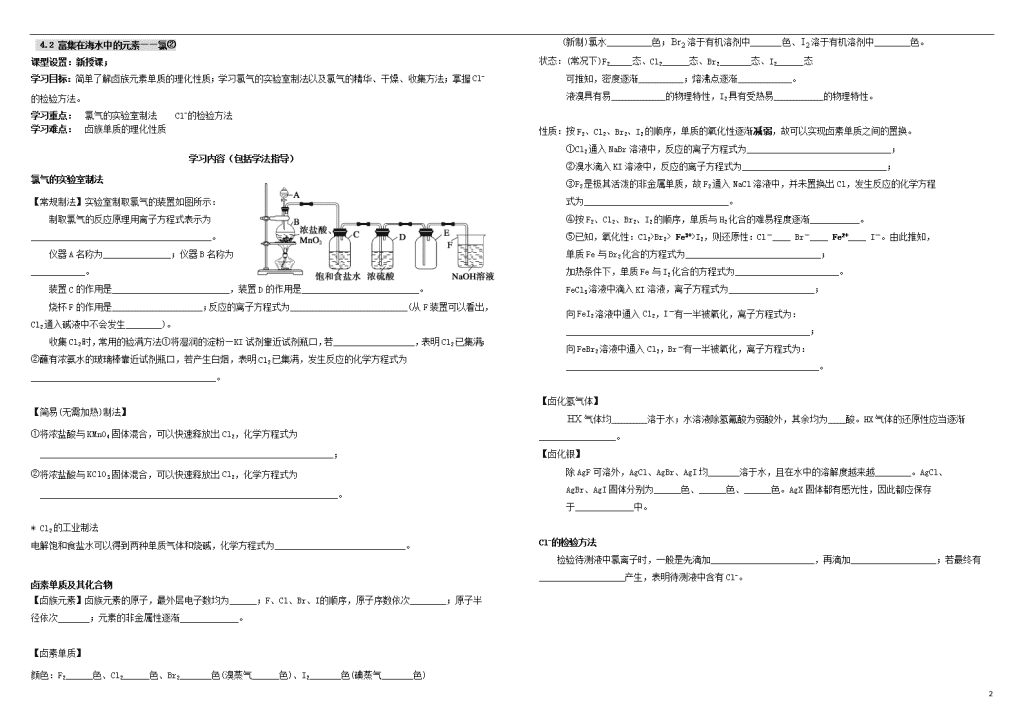
【常规制法】实验室制取氯气的装置如图所示:
制取氯气的反应原理用离子方程式表示为
________________________________________。
仪器A名称为_______________;仪器B名称为____________。
装置C的作用是__________________________,装置D的作用是__________________________。
烧杯F的作用是____________________;反应的离子方程式为__________________________(从F装置可以看出,Cl2通入碱液中不会发生________)。
收集Cl2时,常用的验满方法①将湿润的淀粉—KI试剂靠近试剂瓶口,若__________________,表明Cl2已集满;②蘸有浓氨水的玻璃棒靠近试剂瓶口,若产生白烟,表明Cl2已集满,发生反应的化学方程式为_________________________________________。
【简易(无需加热)制法】
①将浓盐酸与KMnO4固体混合,可以快速释放出Cl2,化学方程式为
_________________________________________________________________;
②将浓盐酸与KClO3固体混合,可以快速释放出Cl2,化学方程式为
__________________________________________________________________。
* Cl2的工业制法
电解饱和食盐水可以得到两种单质气体和烧碱,化学方程式为_____________________________。
卤素单质及其化合物
【卤族元素】卤族元素的原子,最外层电子数均为______;F、Cl、Br、I 的顺序,原子序数依次________;原子半径依次_______;元素的非金属性逐渐_____________。
【卤素单质】
颜色:F2______色、Cl2______色、Br2_______色(溴蒸气______色)、I2_______色(碘蒸气_______色)
(新制)氯水__________色;溶于有机溶剂中_______色、溶于有机溶剂中________色。
状态:(常况下)F2_____态、Cl2______态、Br2_______态、I2______态
可推知,密度逐渐__________;熔沸点逐渐____________。
液溴具有易____________的物理特性,I2具有受热易___________的物理特性。
性质:按F2、Cl2、Br2、I2的顺序,单质的氧化性逐渐减弱,故可以实现卤素单质之间的置换。
①Cl2通入NaBr溶液中,反应的离子方程式为________________________________;
②溴水滴入KI溶液中,反应的离子方程式为________________________________;
③F2是极其活泼的非金属单质,故F2通入NaCl溶液中,并未置换出Cl,发生反应的化学方程
式为________________________________。
④按F2、Cl2、Br2、I2的顺序,单质与H2化合的难易程度逐渐___________。
⑤已知,氧化性:Cl2>Br2> Fe3+>I2,则还原性:Cl-____ Br-____ Fe2+____ I-。由此推知,
单质Fe与Br2化合的方程式为______________________________;
加热条件下,单质Fe与I2化合的方程式为_______________________。
FeCl3溶液中滴入KI溶液,离子方程式为___________________;
向FeI2溶液中通入Cl2,I-有一半被氧化,离子方程式为:
______________________________________________________;
向FeBr2溶液中通入Cl2,Br-有一半被氧化,离子方程式为:
________________________________________________________。
【卤化氢气体】
气体均________溶于水;水溶液除氢氟酸为弱酸外,其余均为____酸。HX气体的还原性应当逐渐_________________。
【卤化银】
除AgF可溶外,AgCl、AgBr、AgI均_______溶于水,且在水中的溶解度越来越________。AgCl、
AgBr、AgI固体分别为______色、______色、______色。AgX固体都有感光性,因此都应保存
于_____________中。
Cl-的检验方法
检验待测液中氯离子时,一般是先滴加_______________________,再滴加___________________;若最终有___________________产生,表明待测液中含有Cl-。
2
相关文档
- 北京市2021高考化学一轮复习专题二2021-07-0357页
- 2020届高考化学一轮复习氯及其化合2021-07-037页
- 新教材高中化学第二章海水中的中盐2021-07-037页
- 2021届一轮复习人教版氯、溴、碘及2021-07-0211页
- 2021版新高考化学一轮复习专题2从2021-07-0287页
- 新教材高中化学第二章海水中的中盐2021-07-026页
- 全国通用2021高考化学一轮复习第四2021-07-029页
- 2019-2020学年高中化学第二章海水2021-07-0231页
- 氯、溴、碘及其化合物教案2021-07-0218页
- 2020年高考化学一轮复习课件:模块3 2021-07-0295页