- 375.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课后作业(十三)
[基础巩固]
一、物质的量浓度及相关计算
1.下列说法中正确的是( )
A.将322 g Na2SO4·10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol·L-1
B.将1 L 2 mol·L-1 H2SO4溶液加水稀释到2 L,所得溶液的物质的量浓度为1 mol·L-1
C.将1 L 18.4 mol·L-1的H2SO4溶液加入到1 L水中,所得溶液的物质的量浓度为9.2 mol·L-1
D.将336 mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05 mol·L-1
[解析] A项错在溶剂体积为1 L;C项溶液浓度大于9.2 mol·L-1;D项,未指明气体所处状况。
[答案] B
2.下图是某市售盐酸试剂瓶标签上的部分数据。
盐酸
化学式:HCl
相对分子质量:36.5
外观:合格
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符合GB622-89
则该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
[解析] 根据公式c===11.8 mol·L-1,故选C。
[答案] C
3.在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1 mol·L-1,SO的物质的量浓度为0.3 mol·L-1,则K+的物质的量浓度为( )
A.0.6 mol·L-1 B.0.3 mol·L-1
C.0.2 mol·L-1 D.0.15 mol·L-1
[解析] K2SO4和Fe2(SO4)3的混合溶液,Fe3+的物质的量浓度为0.1 mol·L-1,SO的物质的量浓度为0.3 mol·L-1,根据电荷守恒有3c(Fe3+)+c(K+)=2c(SO),即3×0.1
8
mol·L-1+c(K+)=2×0.3 mol·L-1,解得c(K+)=0.3 mol·L-1。
[答案] B
4.将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为___________。
(2)该溶液中NaOH的质量分数为__________________________。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为________,NaOH的质量分数为________,溶液的密度为________,含NaOH的质量为________,含NaOH的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为________。
[解析] (1)24.4 g NaOH的物质的量为0.61 mol,
c(NaOH)==6.1 mol·L-1。
(2)100 mL NaOH溶液的质量为100 mL×1.219 g·mL-1=121.9 g;NaOH的质量分数为×100%=20%。
(3)因为溶液是均匀的,所以这10 mL溶液与原100 mL溶液相比,NaOH的质量分数和溶液的密度均相同,但NaOH的质量和物质的量均为原来的。(4)10 mL溶液中NaOH的物质的量浓度为6.1 mol·L-1,稀释到100 mL后,NaOH的物质的量浓度减小为=0.61 mol·L-1。
[答案] (1)6.1 mol·L-1 (2)20%
(3)6.1 mol·L-1 20% 1.219 g·mL-1 2.44 g
0.061 mol
(4)0.61 mol·L-1
二、一定物质的量浓度溶液的配制
5.实验室中需要配制2 mol·L-1的NaOH溶液950 mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
A.950 mL 76.0 g
B.500 mL 80.0 g
C.1000 mL 80.0 g
D.任意规格的容量瓶 76.0 g
[解析] 配制溶液一定要选择合适的容量瓶,一般容量瓶的规格有100 mL、250 mL、500 mL、1000 mL,通常选择大于等于溶液体积的容量瓶,即题给实验中选择1000 mL的容量瓶。m(NaOH)=c·V·M=2 mol/L×1 L×40 g/mol=80 g,托盘天平的精确度为0.1 g
8
,故应称量80.0 g。
[答案] C
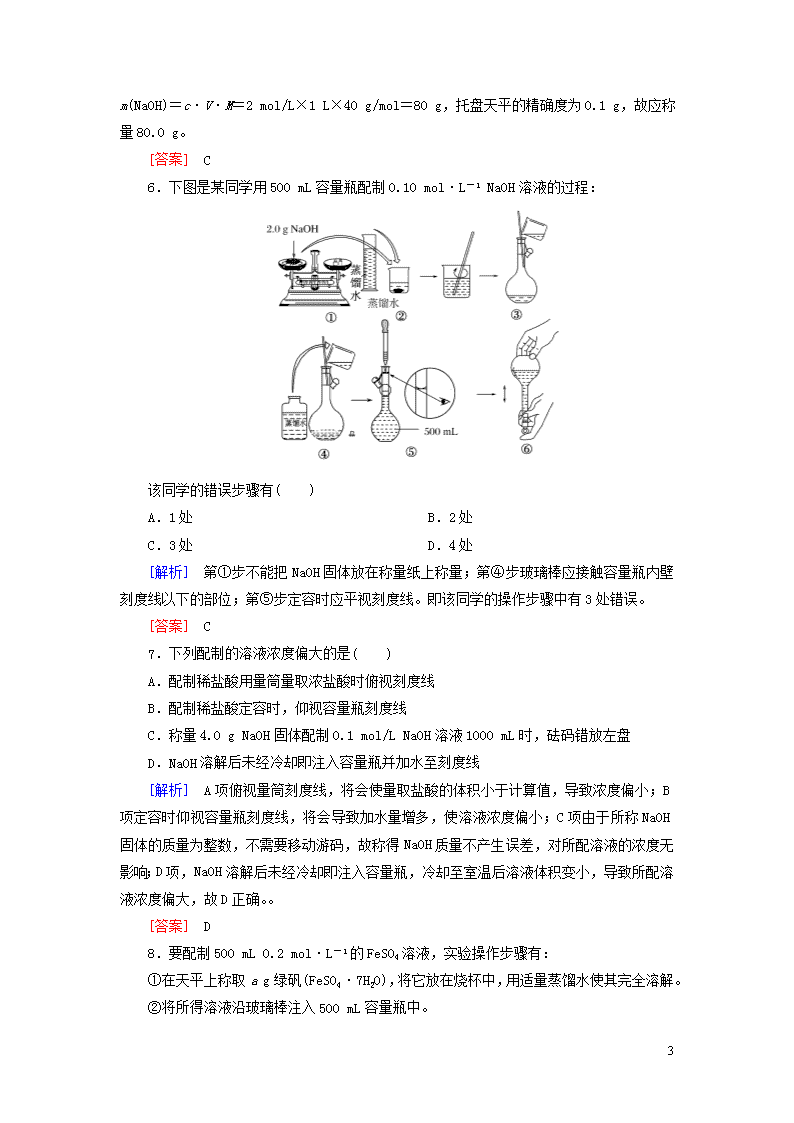
6.下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
该同学的错误步骤有( )
A.1处 B.2处
C.3处 D.4处
[解析] 第①步不能把NaOH固体放在称量纸上称量;第④步玻璃棒应接触容量瓶内壁刻度线以下的部位;第⑤步定容时应平视刻度线。即该同学的操作步骤中有3处错误。
[答案] C
7.下列配制的溶液浓度偏大的是( )
A.配制稀盐酸用量筒量取浓盐酸时俯视刻度线
B.配制稀盐酸定容时,仰视容量瓶刻度线
C.称量4.0 g NaOH固体配制0.1 mol/L NaOH溶液1000 mL时,砝码错放左盘
D.NaOH溶解后未经冷却即注入容量瓶并加水至刻度线
[解析] A项俯视量筒刻度线,将会使量取盐酸的体积小于计算值,导致浓度偏小;B项定容时仰视容量瓶刻度线,将会导致加水量增多,使溶液浓度偏小;C项由于所称NaOH固体的质量为整数,不需要移动游码,故称得NaOH质量不产生误差,对所配溶液的浓度无影响;D项,NaOH溶解后未经冷却即注入容量瓶,冷却至室温后溶液体积变小,导致所配溶液浓度偏大,故D正确。。
[答案] D
8.要配制500 mL 0.2 mol·L-1的FeSO4溶液,实验操作步骤有:
①在天平上称取a g绿矾(FeSO4·7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解。
②将所得溶液沿玻璃棒注入500 mL容量瓶中。
③继续向容量瓶中加水至液面距刻度线1~2 cm
8
处,改用胶头滴管加蒸馏水至液面底部与刻度线相切。
④用少量水洗涤烧杯和玻璃棒2~3次,每次洗液都转入容量瓶。
⑤将容量瓶瓶塞塞紧,充分摇匀。
填写下列空白:
(1)a g绿矾的实际质量为________g。
(2)上述操作步骤的正确顺序为__________________________。
(3)若配制时遗漏步骤④,会使所配溶液的浓度________(填“偏高”偏低”或“无影响”)。
(4)若加蒸馏水时不慎超过刻度线,处理方法是____________;若操作步骤②时有溶液溅在容量瓶外,处理方法是________________。
[解析] (1)绿矾质量为0.2 mol·L-1×0.5 L×278 g·mol-1=27.8 g。(2)配制溶液的步骤为:计算→称量→溶解→洗涤→定容→摇匀。(3)若没洗涤烧杯和玻璃棒,溶质损失,浓度偏低。(4)若水超过了刻度线,已无法补救,只能重新配制。同样溶液外溅的处理方法也是必须重新配制。
[答案] (1)27.8 (2)①→②→④→③→⑤
(3)偏低 (4)重新配制 重新配制
[能力提升]
9.下列对实验操作分析错误的是( )
A.配制0.1 mol·L-1 NaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的量浓度偏低
B.NH4NO3溶解吸热,若配制0.5 mol·L-1NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则所得溶液的物质的量浓度偏高
C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的量浓度偏高
D.配制一定物质的量浓度溶液时,若定容中不小心加水超过刻度线,立刻将超出的水吸出,则所得溶液的物质的量浓度偏低
[解析] A项,配制0.1 mol·L-1 NaCl溶液时,若没有洗涤烧杯和玻璃棒,则溶质的物质的量减少,所得溶液物质的量浓度偏低,正确;B项,NH4NO3溶解吸热,若配制NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则根据热胀冷缩可知所得溶液的体积偏大,因此物质的量浓度偏低,错误;C项,配制一定物质的量浓度溶液时,若所用砝码已经生锈,则砝码质量增加,溶质的质量偏大,因此所得溶液的物质的量浓度偏高,正确;D项,配制一定物质的量浓度溶液时,若定容时不小心加水超过刻度线,立刻将超出的水吸出,则溶质的物质的量减少,所得溶液的物质的量浓度偏低,正确。
[答案] B
10.在标准状况下,将A气体V L(摩尔质量是M g·mol-1)溶于0.5 L
8
水中,所得溶液的密度为a g·cm-3,则此溶液的物质的量浓度为( )
A. mol·L-1
B. mol·L-1
C. mol·L-1
D. mol·L-1
[解析] 由题意可知:n= mol,V=== L,
c== mol·L-1。
[答案] C
11.V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO的物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
[解析] n(Fe3+)=,
n(SO)=× mol= mol,
c(SO)== mol·L-1。
[答案] D
12.在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
8
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
[解析] (1)根据图像可知钠离子的浓度是1.0 mol·L-1,所以溶液中氯化钠的浓度是1.0 mol·L-1,该混合液中NaCl的物质的量为1.0 mol·L-1×0.4 L=0.4 mol;溶液中镁离子的浓度是0.5 mol·L-1,所以溶液中氯化镁的浓度是0.5 mol·L-1,则含溶质MgCl2的质量为0.4 L×0.5 mol·L-1×95 g·mol-1=19.0 g。(2)溶液中氯离子的浓度是3.0 mol·L-1,所以根据溶液显电中性可知溶液中钙离子的浓度是(3.0 mol·L-1-1.0 mol·L-1-2×0.5 mol·L-1)÷2=0.5 mol·L-1,因此该混合液中CaCl2的物质的量为0.5 mol·L-1×0.4 L=0.2 mol。将该混合液加水稀释至体积为1 L,由于稀释前后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为=0.2 mol·L-1。(3)溶液中氯离子的物质的量是0.4 L×3.0 mol·L-1=1.2 mol,所以根据方程式Ag++Cl-===AgCl↓可知,向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是1.2 mol。
[答案] (1)0.4 19.0 (2)0.2 0.2 (3)1.2
13.某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如右图所示,则该图操作应在下图中的________(填选项字母)之间。
8
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表:砝码规格
a
b
c
d
e
砝码大小/g
100
50
20
10
5
(4)下列操作对所配溶液的浓度高低有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏高”“偏低”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会________。
[解析] 容量瓶选取应遵循“大而近”的原则,故应选择500 mL容量瓶;配制1.0 mol·L-1NaOH溶液的步骤为:计算所需NaOH固体的质量→用托盘天平称量→在烧杯中溶解→冷却至室温→向容量瓶中转移溶液→摇动容量瓶→洗涤烧杯及玻璃棒→向容量瓶中加水定容→反复上下颠倒,摇动容量瓶。根据实验步骤即判断出图示为“定容”操作,应在④~⑤之间;n(NaOH)=c·V=0.5 mol·L-1·0.5 L=0.25 mol
m(NaOH)=n·M=0.25 mol×40 g·mol-1=10.0 g
再加上烧杯的质量共33.1 g,应选择30 g砝码。
[答案] (1)500 (2)C (3)10.0 cd c
(4)①偏低 ②无影响
14.实验室用Na2CO3·10H2O晶体配制460 mL 0.100 mol·L-1 Na2CO3溶液。现有下列仪器:
8
A.烧杯 B.500 mL容量瓶 C.药匙 D.玻璃棒
E.托盘天平(带砝码)
请回答下列问题:
(1)配制时,使用的仪器有________(填字母),还缺少的仪器是________。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为________,若定容时加蒸馏水不慎超过刻度线,处理的方法是______________。
(3)若实验时遇到下列情况,所配溶液浓度偏大的是________(填字母)。
A.溶解后未冷却至室温便进行定容
B.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
C.定容时俯视容量瓶的刻度线
D.容量瓶内壁附有水珠而未进行干燥
E.称取的Na2CO3·10H2O晶体失去了部分结晶水
(4)若取50.0 mL上述已配好的溶液,与150 mL 0.200 mol·L-1的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为____________(溶液的体积变化忽略不计)。
[解析] (1)称量需要用托盘天平、药匙,溶解需要用烧杯、玻璃棒,转移溶液需要用500 mL容量瓶、玻璃棒,定容时需要用胶头滴管。(2)所需溶质质量为m(Na2CO3·10H2O)=n×M=0.05 mol×286 g·mol-1=14.3 g。(3)A项,溶液未冷却至室温便进行定容,待恢复室温后液面低于刻度线,造成所配溶液浓度偏大;C项,定容时俯视容量瓶的刻度线,导致所配溶液体积偏小,浓度偏大;E项,Na2CO3·10H2O晶体失去了部分结晶水时,所称的晶体中Na2CO3的质量偏大,造成所配溶液浓度偏大。
(4)c(Na2CO3)
=
=0.175 mol·L-1。
[答案] (1)ABCDE 胶头滴管
(2)14.3 g 重新配制 (3)ACE
(4)0.175 mol·L-1
8
相关文档
- 2020届高考化学一轮复习物质的量 2021-07-035页
- 2019届二轮复习物质的量与阿伏加德2021-07-0344页
- 2021高考化学人教版一轮复习规范演2021-07-0311页
- 2021届高考化学一轮复习物质的量气2021-07-037页
- 2020届一轮复习鲁科版第1章第1讲物2021-07-026页
- 2019届一轮复习人教版物质的量浓度2021-07-0225页
- 2020版一轮复习新课改省份专用版1-2021-07-0219页
- 2019届一轮复习人教版第1讲物质的2021-07-02161页
- 2018届二轮复习物质的量在化学实验2021-07-0214页
- 高考化学一轮复习教学案第26讲有关2021-07-029页