- 3.01 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题三 氧化还原反应
一、氧化还原反应的基本概念及相互关系
1.氧化还原反应的实质是电子的得失或电子
对的偏移,特征是反应前后元素化合价的升降;
判断某反应是否属于氧化还原反应可根据反应
前后化合价是否发生了变化这一特征。
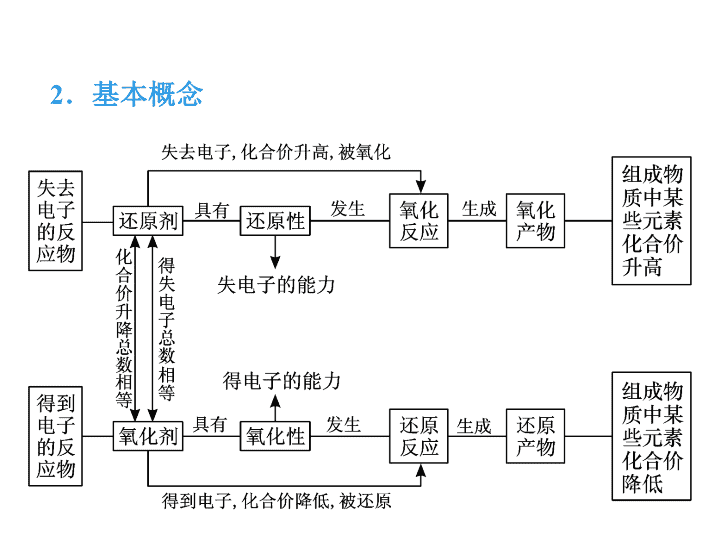
2.基本概念
(1)氧化反应: 失去 电子(化合价 升高 )的反应。
(2)还原反应: 得到 电子(化合价 降低 )的反应。
(3)氧化剂(被还原): 得到 电子的物质(所含元素化
合价降低的物质)。
(4)还原剂(被氧化): 失去 电子的物质(所含元素化
合价升高的物质)。
(5)氧化产物: 还原剂 失电子后对应的产物(包含化
合价升高的元素的产物)。
(6)还原产物: 氧化剂 得电子后对应的产物(包含化
合价降低的元素的产物)。
3.氧化还原反应的表示方法
(1)双线桥法
箭头必须由反应物指向生成物,且两端对准 同种
元素。
箭头方向不代表电子转移方向,仅表示电子转移前
后的变化。
在“桥”上标明电子的“得”与“失”,且得失电
子总数应 相等。
(2)单线桥法
箭头必须由还原剂中失电子的元素指向氧化剂中
得电子的元素。
箭头方向表示 电子转移的方向 。
在“桥”上标明转移的 电子总数 。
1.氧化还原反应与四种基本反应类型的关系
(1)有单质参加的化合反应一定是氧化还原反应;
(2)有单质生成的分解反应一定是氧化还原反应;
(3)置换反应一定是氧化还原反应;
(4)复分解反应一定不是氧化还原反应。
2.常见的氧化剂和还原剂
重要的氧化剂一般有以下几类:
(1)活泼的非金属单质,如Cl2、Br2、O2等。
(2)元素(如Mn等)处于高化合价时的氧化物,如
MnO2等。
(3)元素(如S、N等)处于高化合价时的含氧酸,如
浓H2SO4、HNO3等。
(4)元素(如Mn、Cl、Fe等)处于高化合价时的盐,
如KMnO4、KClO3、FeCl3等。
(5)过氧化物,如Na2O2、H2O2等。
重要的还原剂一般有以下几类:
(1)活泼的金属单质,如Na、Al、Zn、Fe等。
(2)某些非金属单质,如H2、C、Si等。
(3)元素(如C、S等)处于低化合价时的氧化物,如
CO、SO2等。
(4)元素(如Cl、S等)处于低化合价时的酸,如HCl、
H2S等。
(5 )元素 (如S、Fe等 )处于低化合价时的盐,如
Na2SO3、FeSO4等。
二、氧化性、还原性及其强弱比较
氧化性→得电子能力,得到电子越容易→氧化性越
强 。
还原性→失电子能力,失去电子越容易→还原性越
强 。
物质的氧化性或还原性的强弱只取决于得到或失去
电子的 难易程度 ,与得失电子的数目无关。如:
Na、Mg、Al的还原性强弱依次为Na>Mg>Al;浓
HNO3、稀HNO3的氧化性强弱为浓HNO3>稀
HNO3。
1.根据氧化还原反应的方向
氧化性: 氧化剂>氧化产物,氧化剂>还原剂 ;
还原性: 还原剂>还原产物,还原剂>氧化剂 。
2.根据元素的化合价
如果物质中某元素具有最高价,该元素只有 氧
化性 ;物质中某元素具有最低价,该元素只有
还原性 ;物质中某元素具有中间价态,该元素
既有 氧化性 又有 还原性 。
3.根据金属活动性顺序表
在金属活动性顺序表中,位置越靠前,其还原性
就 越强 ,其阳离子的氧化性就 越弱 。
4.根据非金属活动性顺序来判断
一般来说,越活泼的非金属,得到电子还原成非
金属阴离子越容易,其阴离子失电子氧化成单质越
难,还原性越弱。
5.根据元素周期表
同周期元素,随着核电荷数的递增,氧化性逐渐
增强 ,还原性逐渐 减弱 ;同主族元素,随着
核电荷数的递增,氧化性逐渐 减弱 ,还原性逐
渐 增强 。
6.根据反应的难易程度
氧化还原反应越 容易 进行(表现为反应所需
条件越低),则氧化剂的氧化性和还原剂的还原性就
越 强 。
不同的还原剂(或氧化剂)与同一氧化剂(或还原剂)
反应时,条件越易或者氧化剂(或还原剂)被还原(或
被氧化)的程度 越大 ,则还原剂(或氧化剂)的还
原性(或氧化性)就越 强 。
7.根据电化学原理判断
a.根据原电池原理判断:两种不同的金属构成原电池的两极。
负极金属是电子流出的极,正极金属是电子流入的极。其还
原性:负极>正极。
b.根据电解池原理判断:用惰性电极电解混合液时,若混合
液中存在多种金属阳离子时,在阴极先放电的阳离子的氧化
性较强(相应的金属单质的还原性较弱),若混合液中存在多
种阴离子,在阳极先放电的阴离子的还原性较强(相应的非金
属单质的氧化性较弱)。
8.其他条件
一般溶液的酸性越强或温度越高,则氧化剂的氧化性和还原
剂的还原性就越 强 ,反之则越弱。
氧化性还原性强弱的比较是考试的一个难
点,基本考查方式一是比较氧化性还原性的
强弱,二是根据氧化性还原性强弱,判断反
应能否进行。总的解题依据是一个氧化还原
反应能进行,一般是氧化剂的氧化性强于氧
化产物的氧化性,还原剂的还原性强于还原
产物的还原性。但要考虑到某些特殊情况如
符合特定的平衡原理而进行的某些反应。
三、氧化还原反应规律
1.价态变化规律
(1)归中规律:含同种元素不同价态的物质间发生
氧化还原反应时,该元素价态的变化一定遵循
“高价+低价→中间价”的规律。这里的中间价
可以相同(谓之“靠拢”),也可以不同,但此时
必是高价转变成较高中间价,低价转变成较低中
间价(谓之“不相交”)。
(2)歧化规律:同一种物质中的同一元素部分化合
价升高,另一部分化合价降低,发生自身的氧化
还原反应。如:
2.优先规律
在同一溶液里存在几种不同的还原剂且浓度相差
不大时,当加入氧化剂时,还原性 强 的还原剂优
先被 氧化 ;同时存在几种不同的氧化剂且其浓度
相差不大时,当加入还原剂时,氧化性 强 的氧化
剂优先被 还原 。如:把少量Cl2通入FeBr2溶液中,
Fe2+先失电子;把少量Cl2通入FeI2溶液中,I-先失
电子。
3.得失电子守恒规律
在任何氧化还原反应中,氧化剂得电子总数与还原
剂失电子总数一定 相等 。对于氧化还原反应的计
算,利用得失电子守恒规律,抛开烦琐的反应过程,
可不写化学方程式,能更快、更便捷地解决有关问题。
1.HCl和KClO3的反应中转移电子数目是几个?
此反应是个价态归中反应,根据不交叉规律,
KClO3不能被还原为KCl,所以转移电子数目是5个。
2.氧化还原反应方程式的配平
(1)配平原则:电子守恒、原子守恒、电荷守恒
(2)配平步骤(以高锰酸钾和浓盐酸反应制氯气为例):
①标出化合价变化了的元素的化合价。如:
③调整系数,使化合价升降总数相等。
②根据元素存在的实际形式调整发生了氧化还原
反应的物质的系数,使之成1︰1的关系。如:
④根据化合价升降总数相等确定发生氧化还原反应
的物质的化学计量数。如:
2KMnO4+10HCl KCl+2MnCl2+5Cl2↑+H2O
⑤利用元素守恒,用观察法配平没有参加氧化还原
反应的其他物质的系数。如:
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
⑥检查方程式两边各原子的个数是否相等,离子方
程式还要检查方程式两边的离子所带的电荷数是否
相等。
【典例1】对于反应IBr+H2O HBr+HIO的说
法正确的是( )
A.IBr只作氧化剂
B.IBr只作还原剂
C.IBr既是氧化剂又是还原剂
D.IBr既不是氧化剂又不是还原剂
【解析】这一题的关键是正确判断共价化合物IBr、
HIO中I、Br元素的化合价。分析可知,该反应不属于
氧化还原反应,故D正确。
D
【点拨】 氧化还原反应中的重要概念理解要深刻,
不能混淆。抓住两条线,氧化剂被还原,化合价
降低,得到还原产物;还原剂被氧化,化合价升
高,得到氧化产物。在反应中,氧化剂是得到电
子(或电子对偏向)的物质,反应时所含元素的化合
价降低,还原剂是失去电子(或电子对偏离)的物质,
所含元素的化合价升高。电子转移数可以只看化
合价升高的数目或者只看化合价降低的数目,不
能将得失电子数相加。
【迁移训练1】 制备氰氨基化钙的化学方程式为
CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑,
在反应中( )
A.氢元素被氧化,碳元素被还原
B.HCN既是氧化剂又是还原剂
C.CaCN2是氧化产物,H2为还原产物
D.CO是氧化产物,H2为还原产物
【解析】根据化合价不交叉规律,该反应的电子转移
情况为:
【参考答案】BC
【典例2】常温下,往H2O2溶液中滴加少量FeSO4溶
液,可发生如下两个反应:
2Fe2++H2O2+2H+ 2Fe3++2H2O ①
2Fe3++H2O2 2Fe2++O2↑+2H+ ②
下列说法正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不
变
D.H2O2生产过程要严格避免混入Fe2+
【解析】由氧化还原反应的强弱规律知,氧化性是
氧化剂大于氧化产物,还原性是还原剂大于还原产
物,由方程①知,氧化剂H2O2氧化性比氧化产物
Fe3+强,由方程②知,还原剂H2O2还原性比还原
产物Fe2+强,A错误;方程①和方程②相加,即
H2O2分解生成H2O和O2,H2O2呈弱酸性,故随着
反应进行,pH升高,B错误;H2O2分解时Fe3+或
Fe2+作催化剂,所以总量不变,C正确;因Fe2+
可导致H2O2分解,所以H2O2生产过程要避免混入
Fe2+,D正确。
【点拨】氧化性、还原性强弱比较的方法有很多,
最基本的即为氧化剂的氧化性大于氧化产物的氧
化性,还原剂的还原性大于还原产物的还原性,
对于一个自发的氧化还原反应,一般是强氧化性
和强还原性物质生成弱氧化性和弱还原性物质。
【参考答案】CD
【迁移训练2】某反应中反应物与生成物有:AsH3、
H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未
知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原
剂是______。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,
则X的化学式为______。
【解析】(1)在反应中KBrO3得到电子,化合价降低是氧
化剂,而还原剂是化合价升高的物质,所以只能是
AsH3。
(2)0.2 mol KBrO3在反应中得到1 mol电子生成X,说明
溴元素化合价变化为5,即产物为0价的Br2。
AsH3
Br2
(4)将氧化剂和还原剂的化学式及其配
平后的化学计量数填入下列方框中,
并标出电子转移的方向和数目:_____________
(3)根据上述反应可推知______。
A.氧化性:KBrO3>H3AsO4
B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
【解析】 (3)氧化性:氧化剂>氧化产物,还原性:还
原剂>还原产物。
(4)电子转移的方向和数目,要注意电子转移是由还原
剂指向氧化剂。
AC
【典例3】向NaBr、NaI、Na2SO3混合液中通入一
定量氯气后,将溶液蒸干并充分灼烧,得到固体
剩余物质的组成可能是( )
A.NaCl、Na2SO4 B.NaBr、Na2SO4
C.NaCl、Na2SO4、I2 D.NaCl、
【解析】 向NaBr、NaI、Na2SO3混合液中,通入一
定量氯气后,发生反应的次序分别为:
Na2SO3+Cl2+H2O Na2SO4+2HCl、
2NaI+Cl2 2NaCl+I2、
2NaBr+Cl2 2NaCl+Br2。
将溶液蒸干则HCl、Br2、Cl2挥发,灼烧I2升华,
若通入的氯气是过量的,得到固体剩余物质的组成
是NaCl、Na2SO4;若通入的氯气是不足量的,则
还有可能留下NaBr。
【点拨】要注意优先原理的应用。越易失电子的
物质,失去后就越难得到电子,越易得到电子的
物质,得到后就越难失去电子;当一种氧化剂同
时和几种还原剂相遇时,还原性最强的优先发生
反应。同理,一种还原剂遇多种氧化剂时,氧化
性最强的优先发生反应。
【参考答案】A
【迁移训练3】已知Co2O3在酸性溶液中易被还原
成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次
减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2 2FeCl3+4FeI3
B.Cl2+FeI2 FeCl2+I2
C.Co2O3+6HCl 2CoCl2+Cl2↑+3H2O
D.2Fe3++2I- 2Fe2++I2
【解析】由于还原性I->Fe2+,故A不可能发生,
B、D可能发生。又因为氧化性Co2O3>Cl2,故C
也可能发生。
A
【典例4】“神七”登天标志着我国的航天事业进入了新
的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。
为了防止火箭温度过高,在火箭一面涂上一种特殊的涂
料,该涂料的性质最可能的是________。
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
【解析】防止火箭温度过高,即应该在温度较高的情
况下能气化降温。
B
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4
作为燃料,其反应的方程式是
___N2O4+N2H4―→N2+H2O。请配平该反应方程式:
N2O4+____N2H4―→____N2+____H2O
该反应中被氧化的原子与被还原的原子的物质的量之
比是__________。这个反应应用于火箭推进器,除释
放大量的热和快速产生大量气体外,还有一个很大的
优点是____________。
【解析】(2)配平的关键是将化合价的升降标注清楚,
N2O4中N为+4价,N2H4中N为-2价,反应后均生
成N2,所以N2H4的化学计量数应为N2O4的2倍。
1
2 3 4
2:1
产物无污染
【迁移训练4】将NO+Zn+OH-+H2O NH3+
Zn(OH)配平后,离子方程式中H2O的化学计量数是
( )
A.2 B.3 C.6 D.8
【解析】用化合价升降法配平得方程式:
NO+4Zn+7OH-+6H2O===NH3↑+4Zn(OH)。
【参考答案】C
主干知识整合
要点热点探究
► 探究点一 氧化还原反应的概念分析及计算
1.解答氧化还原反应概念题的两个关键是:
(1)要理清知识线索
(2)要明确解题的方法思路
找变价、判类型、分升降、定其他。其中“找变价”是非常
关键的一步,特别是反应物中含有同种元素的氧化还原反应,
必须弄清它的变化情况。
2.氧化还原反应的相关计算
(1)基本方法——得失电子守恒法
对于氧化还原反应的计算,关键是氧化还原反应的实质——
得失电子守恒,列出守恒关系求解,即n(氧化剂)×变价原子
个数×化合价变化值=n(还原剂)×变价原子个数×化合价变
化值。
(2)特殊题型
对于多步连续进行的氧化还原反应,只要中间各步反应过程
中电子无损耗,可直接根据起始物和最终产物得失电子相等,
删去中间产物,建立二者的守恒关系,迅速求解。例
如: ,则Cu失去电子的物质的量等于
H2O2得电子的物质的量,忽略HNO3参加反应的过程。
例1、在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3Sn2++2H3AsO3+6H++18Cl-==2As+3SnCl62-+6M。
关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As
③每生成1 mol As,反应中转移电子的物质的量为3 mol
④M为OH- ⑤SnCl62-是氧化产物
A.①②④⑤ B.①③⑤
C.①②③④ D.只有①③
B 【解析】 此反应中SnCl2→SnCl62-锡元素价态升
高,则SnCl2是还原剂,SnCl62-是氧化产物;故⑤
正确;H3AsO3→As中,As元素的化合价降低,故
H3AsO3是氧化剂,则生成1 mol As,转移电子的物
质的量为3 mol,故①③正确;Cl-不是还原剂,故
②错误;由电荷守恒知M为H2O,故④错误。
【点评】 氧化还原反应的概念分析是解决氧化还
原反应所有题目的基础,而找变价是氧化还原反
应有关概念分析的关键。
二氧化氯是目前国际上公认的新一代高效、广谱、安全杀菌剂。
可采用氯酸钠(NaClO3)与浓盐酸反应的方法制备,此法的缺点
主要是在得到二氧化氯的同时产生了大量的氯气。下列有关该反
应的说法不正确的是( )
A.二氧化氯中Cl的化合价为-1
B.制备二氧化氯的反应中,NaClO3是氧化剂,HCl是还原剂
C.二氧化氯是NaClO3的还原产物
D.生成标准状况下的22.4 L二氧化氯时转移电子1 mol
A 【解析】 ClO2中Cl的化合价为+4,O的化
合价为-2,A项错误;制备ClO2的化学方程式
为:2NaClO3+4HCl(浓)==2NaCl+2ClO2↑+
Cl2↑+2H2O,由此可知,选项B、C、D正确。
例2、在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,
再加入50 mL 0.5 mol·L-1KNO3溶液,恰好反应完全。该反应
的 方 程 式 为 : “ _ _ _ _ F e S O 4 + _ _ _ _ K N O 3 +
____H2SO4=____K2SO4+____Fe2(SO4)3+____NxOy+
____H2O”,则对该反应的下列说法正确的是( )
A.反应中还原产物是NO
B.氧化产物和还原产物的物质的量之比为1∶ 4
C.反应过程中转移的电子数为8e-
D.化学方程式中按物质顺序的化学计量数是:8、2、5、1、4、
1、5
D 【解析】 设还原产物中N的化合价为a,由电子守恒可得,
×1=0.5 mol·L-1×50×10-3 L×(5-a),解得a=1,所以
还原产物为N2O;由得失电子守恒和原子守恒配平化学方程
式得8FeSO4+2KNO3+5H2SO4=K2SO4+4Fe2(SO4)3+
N2O+5H2O,由化学方程式可知氧化产物和还原产物的物质
的量之比为4∶ 1,反应过程中转移的电子数为
0.1×6.02×1023。
【点评】 守恒定律是自然界最重要的基本定律,是化学科学
的基础。在化学反应中,守恒包括原子守恒、电荷守恒、得
失电子守恒等。任何化学反应在反应前后应遵守电荷或原子
守恒。电荷守恒即反应前后阴、阳离子所带电荷数必须相等;
原子守恒(或称质量守恒),也就是反应前后各元素原子个数
相等;得失电子守恒是指在氧化还原反应中,失电子总数一
定等于得电子总数,即得失电子数目保持守恒。守恒法是解
答化学计算题最常用的方法之一。
某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]
处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后
得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下
列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)
B.处理废水中的Cr2O的物质的量为nx/2
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中,3x=y
A 【解析】Cr2O72-中Cr的化合价为+6价,具有强氧化性,
被+2价铁还原为+3价,根据生成物的化学式可判断部分铁
被氧化,被氧化的铁的化合价升高为+3价,因此根据得失
电子守恒D项正确。铬元素的化合价由+6价降低为+3价,
即1 mol Cr得到3 mol电子,因此C项正确。由质量守恒判断
B项也正确。
► 探究点二 氧化还原反应的基本规律
1.物质氧化性、还原性强弱的判断
物质氧化性、还原性的强弱取决于元素得失电子的难易程度,
与得失电子的数目无关,可从“热>冷” (温度 )、“浓>
稀”(浓度)、“易>难”(反应条件、剧烈程度),以及金属活
动性顺序表、元素在周期表中的位置、原电池原理、电解池中
离子的放电顺序等角度判断;还要学会从化学反应方向的角度
判断“剂>物”(同一反应中氧化剂的氧化性大于氧化产物的
氧化性,还原剂的还原性大于还原产物的还原性)。
[特别注意](1)含有最高价态元素的化合物不一定具有强氧化性。
如:HClO的氧化性强于HClO4,稀硫酸无强氧化性。
(2)物质的氧化性、还原性是相对的,如H2O2与MnO4-反应作还
原剂,与I-、Fe2+、S2-、SO32-反应作氧化剂。
(3)反应环境对物质氧化性、还原性的影响。NO只有在酸性条件
下才有强氧化性,而ClO-无论在酸性、中性、还是在碱性条件
下都有强氧化性。
(4)利用原电池正、负极判断金属的还原性时,要注意Al和Fe的
特殊性。如Mg、Al、NaOH溶液形成的原电池中Mg作正极、Al
作负极;Al或Fe、Cu、浓硝酸形成的原电池中,Al或铁为正极、
Cu为负极。
2.氧化还原反应的一般规律
(1)得失电子守恒规律。
(2)价态与表现性质规律:最高价态的元素只有氧化性,最
低价态的元素只有还原性,中间价态的元素既有氧化性又有
还原性。
(3)性质强弱规律:氧化性——氧化剂>氧化产物;还原
性——还原剂>还原产物。如:2FeCl3+Cu==2FeCl2+
CuCl2,氧化性:Fe3+>Cu2+,还原性:Cu>Fe2+。
(4)反应先后规律:如把Cl2通入FeBr2溶液中,由于还原性
Fe2+>Br-,当通入少量Cl2时,根据先后规律,Cl2首先
将Fe2+氧化;但Cl2足量时,就可将Fe2+、Br-一并氧化。
(5)价态归中规律:即同种元素不同价态之间的反应,高价
态的元素化合价降低,低价态的元素化合价升高,但升高与
降低的化合价不能相交。如KClO3+6HCl==KCl+3Cl2↑+
3H2O,氯酸钾中Cl元素的化合价由+5价降低到0价,而非
-1价,作还原剂的HCl是5 mol,而不是6 mol。利用此规律
可根据化合价判断混合体系中氧化剂、还原剂及氧化产物、
还原产物,如某一混合体系有N2O、FeSO4、Fe(NO3)3、
HNO3和Fe2(SO4)3,则氧化剂为HNO3,氧化产物为
Fe(NO3)3和Fe2(SO4)3;还原剂为FeSO4,还原产物为N2O。
(6)邻位价态规律:氧化还原反应发生时,其价态一般先变为邻
位价态。如Cl-一般被氧化成Cl2,而不是更高价态的氯元素;
S2-一般被氧化成S单质,而S单质一般被氧化成SO2。但ClO-、
ClO3-作氧化剂时,一般被还原成Cl-,而不是Cl2(ClO-、
ClO3-与Cl-在酸性条件下发生归中反应生成Cl2除外)。
(7)歧化原则:中间价态→高价态+低价态。一般有:中间价态
物质可以在碱液中歧化,而歧化产物又可以在酸液中发生归中反
应:3S+6OH-==2S2-+SO32-+3H2O,2S2-+SO32-+6H+
=3S↓+3H2O。
记忆口诀:“高氧低还中两性,归中靠拢不交叉;歧化反应价升
降,相邻价态不反应。”
例3 、根据下表信息,下列叙述中正确的是( )
序号 氧化剂 还原剂 其他反应物 氧化产物 还原产物
① Cl2 FeBr2 Cl-
② KMnO4 H2O2 H2SO4 O2 Mn2+
③ KClO3 浓盐酸 Cl2
④ KMnO4 浓盐酸 Cl2 Mn2+
A.表中①组反应的氧化产物只能是FeCl3
B.氧化性强弱比较:KMnO4>Fe3+>Cl2>Fe2+
C.④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
C 【解析】 Fe2+的还原性强于Br-,因此向
FeBr2溶液中通入Cl2时优先氧化Fe2+,故其氧化产
物有FeCl3,也可能有Br2,A、B两项错误;表中③
发生的是“归中反应”,其氧化产物和还原产物都
是氯气,D项错误;根据电子守恒配平④的离子方程
式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++
8H2O,C项正确。
【点评】 在可能发生多个氧化还原反应的体系中,
按氧化还原反应的“先后反应规律”分析问题,能
优化思维过程,形成有序、条理的解题思路。
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、
Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶
液中不可能发生的是( )
A.3Cl2+6FeI2===2FeCl3+4FeI3
B.Cl2+FeI2===FeCl2+I2
C.Co2O3+6HCl===2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-===2Fe2++I2
A 【解析】 找出选项中反应的氧化剂与氧化产物,
根据氧化性:氧化剂>氧化产物,若符合题干中的
氧化性顺序Co2O3>Cl2>FeCl3>I2就可以发生,
可知B、C、D项都符合,正确;A项中Cl2应先氧化I
-,再氧化Fe2+,反应方程式应为:3Cl2+
2FeI2=2FeCl3+2I2,故A错误。
已知:还原性HSO3->I-,氧化性IO3->I2。在含3
mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和
析出I2的物质的量的关系曲线如图3-1所示。下列有关说
法正确的是( )
A.当溶液中n(I-)∶ n(I2)=1∶ 1时,加入
的n(KIO3)=9/8mol
B.a点时剩余NaHSO3的物质的量为1.2 mol
C.b点时的还原产物可能是I2
D.反应过程中的氧化产物均为SO3
A 【解析】 分析题给已知条件和反应过程的图像
可知,0~b段发生反应的离子方程式为3HSO3-+
IO3-==3SO42-+I-+3H+,b→c段发生反应
的离子方程式为IO3-+5I-+6H+==3I2+3H2O。
a点n(IO3-)=0.4 mol,参加反应的NaHSO3的物
质的量为1.2 mol,剩余NaHSO3的物质的量为1.8
mol;b点时第一个反应恰好完成,还原产物只有I
-;整个反应过程中的氧化产物有SO42-和部分
I2。
1.在2KI+O3+H2O==2KOH+O2+I2的反应中,
当有2 mol的KI被氧化时,被还原的氧原子为( )
A.1 mol B. 1/2mol
C.2/3 mol D. 1/3mol
【解析】 A 分析化合价变化,O3中3个氧原子,只
有1个氧原子化合价降低为-2,所以被还原的氧原
子为1 mol。
2.已知物质K2EO4具有很强的氧化性,是一种高效绿
色氧化剂,可用于废水和生活污水的处理。根据下列
框图回答问题(答题时,化学式和化学方程式中的M、
E用对应的元素符号表示):
(1)M和E相比,还原性较强的是______(填化学式)。
( 2 )在K 2 E O 4的水溶液中能大量共存的离子是
_______(填字母)。
A.Fe2+ B.S2- C.SO32- D.Cl-
(3)写出X与稀硫酸和H2O2混合液反应的离子方程
式:__________________________。
(4)在Z―→K2EO4的反应中,氧化剂与还原剂的物
质的量之比为________。
【答案】 (1)Fe (2)D
(3)2Fe2++H2O2+2H+==2Fe3++2H2O
(4)3∶ 2
【解析】 由Y 红色溶液可知,Y中含有Fe3+,
逆推可知X中含有Fe2+,进一步逆推可得金属E为Fe,蓝色
溶液中的MSO4为CuSO4,金属M为Cu,物质K2EO4是K2FeO4。
(1)Fe的金属活动性强于Cu,因此,Fe的还原性强于Cu。
(2)由Fe(OH)3+KOH+Cl2―→KCl+K2FeO4+H2O可知,Cl-
在K2FeO4的水溶液中能大量共存,而Fe2+、S2-、SO32-不
能在此溶液中大量共存。
(3)根据化合价升降总数相等和电荷守恒可写出反应
的离子方程式为:2Fe2++H2O2+2H+=2Fe3+
+2H2O。
(4)在Fe(OH)3+KOH+Cl2→KCl+K2FeO4+H2O
中,Cl的化合价由0降到-1价,Cl2是氧化剂,Fe
的化合价由+3升高到+6价,Fe(OH)2是还原剂,
根据电子守恒可得,氧化剂与还原剂的物质的量之
比为3∶ 2。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页