- 502.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
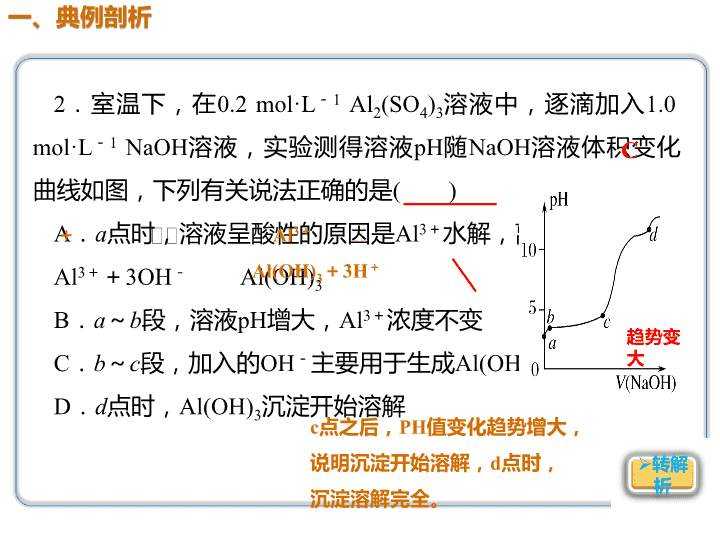
2.室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0
mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化
曲线如图,下列有关说法正确的是( )
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3++3OH- Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
C
A l 3 + + 3 H 2 O
Al(OH)3+3H+
趋势变
大
c点之后,PH值变化趋势增大,
说明沉淀开始溶解,d点时,
沉淀溶解完全。
解析 A项,a点时,即为Al2(SO4)3溶液,由于Al3+
水解:Al3++3H2O
Al(OH)3+3H+,溶液呈酸性,错误;B项,a~b
段,主要是滴入的NaOH溶液中和了水解生成的H+,
c(H+)减小,溶液pH增大,另外,一方面,c(H+)减小
一定程度上促进了Al3+的水解,另一方面溶液体积增
大,故c(Al3+)减小,错误;C项,b~c段,pH变化缓
慢,主要发生反应:Al3++3OH-===Al(OH)3↓,正确;
D项,c点后pH变化较快的一段,为Al3+沉淀完全,
Al(OH)3未溶解而c(OH-)增大的过程,d点前pH变化较
缓慢的一段反应为:Al(OH)3+OH-===AlO2-+2H2O,
故d点时,Al(OH)3已完全溶解,错误。
4.(2018·衡阳模拟)将一定质量的镁铝混合物投入200 mL硫
酸中,固体全部溶解后,向所得溶液中加入5 mol·L-1的
NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V
的变化如图所示:
则下列说法不正确的是( )
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
D 镁、
铝
元素
守恒
特殊点选择:
沉淀最高点时,溶液中只
有Na2SO4
守恒可算酸的浓度
[说明] 前两“看”较直观,难度较小。第三
“看”难度大些,只有在正确书写出变化过
程中的反应方程式并理清化学方程式中化学
计量数与题目相关量的数量关系才能顺利破
题。
解答图像题思维模板
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页