- 892.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二章 化学反应与能量
病 例 分 析
格林太太有两颗假牙,一颗是黄金的――这是她财富的标志;另一颗是不锈钢的――这是一次车祸留下的
痕迹。令人百思不解的是自从那可怕的车祸后,格林太太就经常头疼、夜间失眠、心情烦躁。四处求医也
没能治好,直到她遇到一位化学家。
化学家说,用于制作假牙的金与铁(钢的主要成分)是活动性不同的两种金属,而唾液中含有电解质,
这三者之间构成原电池,产生微小的电流。正是这电流导致格林太太头疼。你能为她开一个药方吗?
能源
一次能源:直接从自然界取得的能源。 如原煤、石油、天然气、水能、风能、地热能、潮汐能、太阳能
等
二次能源:一次能源经过加工、转换得到的能源。如电能、蒸汽能、氢能等
电能(电力):二次能源
火力发电原理及过程
火力发电的优点
a.我国煤炭资源丰富,廉价方便.
b.电能清洁安全,又快捷方便.
火力发电的缺点
a.排出大量的温室效应气体.
b.有废气可能导致酸雨
c.废料废水
d.储量有限
e.能量转换效率低
温馨引导:
什么样的化学反应才具备将化学能转化为电能的前提呢?请说明原因。
化学能 电能?
1、当氧化剂和还原剂直接接触进行反应时,化学能要经过一系列能量转换才能转换为电能。
2、把氧化剂和还原剂分开,使氧化反应和还原反应在两个不同区域进行。
3、需要在氧化剂和还原剂之间架设桥梁使电子从氧化剂区域流向还原剂区域。
4、考虑氧化反应和还原反应发生的条件和环境,化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。
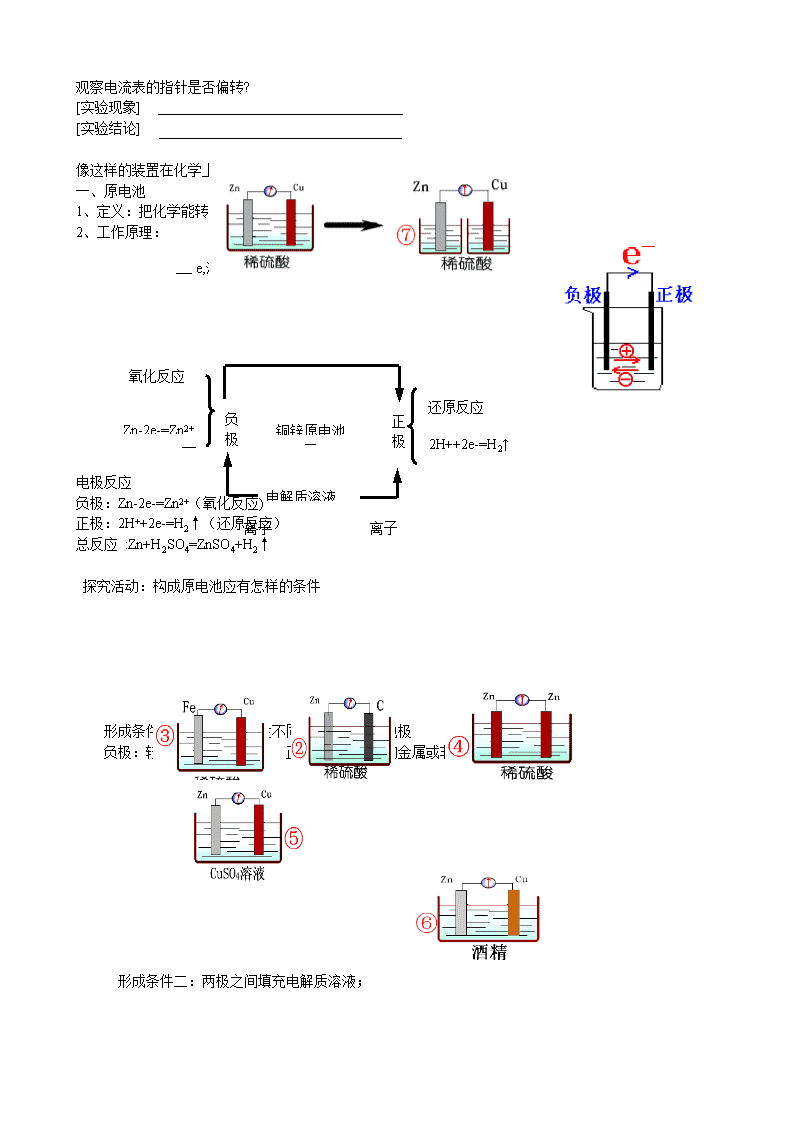
【实验一】
分别把锌片和铜片插入到稀 H2SO4 中,
观察现象
发生的反应
【实验二】
再用导线把锌片和铜片连接起来,观察铜片上有无气泡产生?
在导线中间接入一个电流表,
直接
观察电流表的指针是否偏转?
[实验现象]
[实验结论]
像这样的装置在化学上称为原电池
一、原电池
1、定义:把化学能转变为电能的装置.
2、工作原理:
电极反应
负极:Zn-2e-=Zn2+(氧化反应)
正极:2H++2e-=H2↑(还原反应)
总反应 :Zn+H2SO4=ZnSO4+H2↑
探究活动:构成原电池应有怎样的条件
形成条件一:通常用活泼性不同的两种材料作电极
负极:较活泼的金属 正极:较不活泼的金属或非金属(如石墨等)
形成条件二:两极之间填充电解质溶液;
离子离子
氧化反应
还原反应
正
极
负
极 铜锌原电池Zn-2e-=Zn2+
2H++2e-=H2↑
电解质溶液
e,沿导线传递,有电流产生
形成条件三:必须形成闭合回路
形成条件四:必须存在自发的氧化还原反应
问题:锌片插入稀硫酸中,被腐蚀。(化学腐蚀)
锌片在锌,铜(稀硫酸)原电池中作为负极,也被腐蚀。(电化学腐蚀)分析锌,铁
(稀硫酸)原电池中的电极反应。
哪个更快?
4、原电池原理的应用
①制作化学电源
②加快反应速率:
如实验室制 H2 时,由于锌太纯,反应一般较慢,可加入少量 CuSO4 以加快反应速率。
③判断金属活动性的强弱
例 1
1,Zn—Zn 与稀硫酸进行实验.
3,Zn—石墨与稀硫酸进行实验.
4,Fe—Zn 与稀硫酸进行实验.
5,Cu—Zn 与乙醇进行实验.
6,Cu—Zn 与一个西红柿(或一个苹果)进行实验.
7,Cu—Zn 与两个西红柿进行实验.
8,Cu—Zn 与橙汁进行实验.
以上组合可以组成原电池
例 2,把 a、b、c、d 四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若 a、b 相 连时,a
为负极;c、d 相连时,电流由 d 到 c;a、c 相连时,c 极上产生大量气泡,b、d 相连时,b 上有大量
气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
例 3, 请根据反应: 2Fe3+ + Fe = 3 Fe 2+设计原电池,你有哪些可行方案?
负极 正极 电解质溶液
例
4、在
用锌
片、
铜片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
A、锌片是正极,铜片上有气泡产生
B、电流方向是从 锌片流向铜片
C、溶液中硫酸的物质的量减小
D、电解液的 PH 保持不变
例 5、一个原电池的总反应的离子方程式 Zn + Cu2+ = Zn2+ + Cu,该反应的原电
池的组成正确的是( )
二,发展中的化学电源
(1)干电池结构及电极反应原理
负极:Zn — 2e- == Zn2+
正极:2NH4+ + 2e- == 2NH3↑+H2↑
电池总反应式: Zn + 2NH4+ == Zn2++2NH3↑+H2↑
特点:
a:一次性电池,不可逆
b:用 KOH 代替 NH4Cl 能提高 性能,延长寿命
(2)充电电池(又称二次电池)
铅蓄电池
负极: Pb +SO42- - 2e- == PbSO4
正极:PbO2 + 4H+ +SO42- +2e- == PbSO4 + 2H2O
电池总反应式:Pb + PbO2 + 2H2SO4 === 2PbSO4 + 2H2O
Pb + PbO2 + 4H+ +2SO42- == 2PbSO4 + 2H2O
特点:二次电池,可再次充电使用
(3)燃料电池
新型电池中,电极的导电材料一般多孔的金属板,负极是通入还原剂的一方,正极是通入氧化剂的一方。
氢氧燃料电池,电解质溶液为 30%的氢氧化钾溶液.
正极: O2+ 4e + 2H2O === 4OH-
负极: 2H2– 4e + 4OH-=== 4H2O
总反应式: 2H2+O2==2H2O
特点:高效,环境污染少,外加设备供给氧化剂
新型燃料电池:该电池用金属铂片插入 KOH
溶液中作电极,又在两极上分别通甲烷和氧
气。电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应: CH4 + 2O2 + 2KOH=K2CO3 + 3H2O
4、镍铬电池
特点:比铅蓄电池耐用,可密封反复使用。
NiO2(S)+Cd(S)+2H2O(L)
=Ni(OH)2(S)+Cd(OH)2(S)
Ag2O(S)+Cd(S)+H2O(L)
=2Ag(S)+Cd(OH)2(S)