- 546.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 元素周期表
课程标准
核心素养
1.了解元素周期表的编排规则及结构特点。
2.能描述元素在元素周期表中的位置。
3.理解原子结构与元素在周期表中位置的关系。
证据推理与模型认知
构建“位”“构”“性”关系认识模型;发展对元素及其化合物化学性质的认识模型。
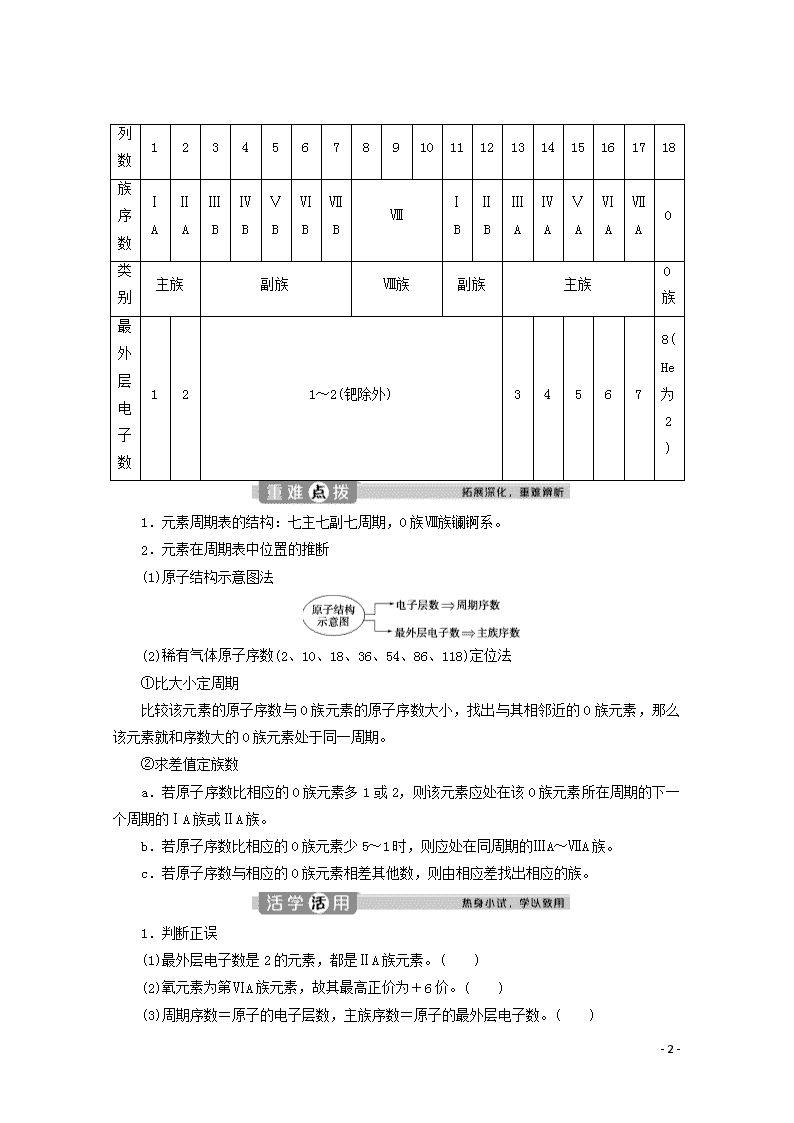
元素周期表的结构
1.元素周期表方格中的信息
2.元素周期表的结构
(1)元素周期表的编排原则
①横行
②纵列
(2)周期
周期
类别
周期
序数
起止元素
原子序数
包括元素种数
核外电子
层数
短周期
1
1~2
2
1
2
3~10
8
2
3
11~18
8
3
长周期
4
19~36
18
4
5
37~54
18
5
6
55~86
32
6
7
87~118
32
7
(3)族
- 13 -
列数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
族序数
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
类别
主族
副族
Ⅷ族
副族
主族
0族
最外层电子数
1
2
1~2(钯除外)
3
4
5
6
7
8(He为2 )
1.元素周期表的结构:七主七副七周期,0族Ⅷ族镧锕系。
2.元素在周期表中位置的推断
(1)原子结构示意图法
(2)稀有气体原子序数(2、10、18、36、54、86、118)定位法
①比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和序数大的0族元素处于同一周期。
②求差值定族数
a.若原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
b.若原子序数比相应的0族元素少5~1时,则应处在同周期的ⅢA~ⅦA族。
c.若原子序数与相应的0族元素相差其他数,则由相应差找出相应的族。
1.判断正误
(1)最外层电子数是2的元素,都是ⅡA族元素。( )
(2)氧元素为第ⅥA族元素,故其最高正价为+6价。( )
(3)周期序数=原子的电子层数,主族序数=原子的最外层电子数。( )
- 13 -
(4)Fe元素位于周期表的ⅧB族。( )
(5)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素。( )
答案:(1)× (2)× (3)√ (4)× (5)×
2.(1)写出下列元素在周期表中的位置:
Na____________;Si____________;Cl____________;
K______________;Se____________;Br____________。
(2)据报道,某些花岗岩会产生氡(Rn),而对人体产生伤害。Rn的原子结构示意图为________________________________________________________________________,
Rn在周期表中的位置是______________。
答案:(1)第3周期ⅠA族 第3周期ⅣA族 第3周期ⅦA族 第4周期ⅠA族 第4周期ⅥA族 第4周期ⅦA族
(2) 第6周期0族
3.X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。已知X、Y、Z三种元素的质子数之和为40,请回答:
X
Y
Z
(1)写出X、Y、Z三种元素的元素符号:
X________,Y________,Z________。
(2)写出Y在周期表中的位置:______________。
解析:(1)假设X的原子序数是a,则与X同一主族的下一周期元素的原子序数是a+8,Y的原子序数是a+9,Z的原子序数是a+10。X、Y、Z三种元素的质子数之和为40,则a+a+9+a+10=40,a=7,所以X是N元素,Y是S元素,Z是Cl元素。
(2)S元素原子的核外电子排布是2、8、6,即元素原子核外有3个电子层,最外层有6个电子,因此在周期表中的位置是第3周期ⅥA族。
答案:(1)N S Cl (2)第3周期ⅥA族
ⅡA族、ⅤA族与过渡元素的性质
1.Ⅱ A族元素(碱土金属元素)的性质
元素
铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)
原子核外
最外层电子数均为2,电子层数依次增多
- 13 -
电子排布
单质的
物理性质
均为亮白色固体、具有良好的导电性
化学性质
均易失去最外层的2个电子,化学性质活泼,在自然界中都以化合态存在
2.焰色试验:多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,亦称焰色反应,这是金属元素的物理(填“物理”或“化学”)性质。常见金属元素的焰色:钠元素为黄色、钾元素为浅紫色、钡元素为黄绿色、钙元素为砖红色、铜元素为蓝绿色。
[知识拓展] 焰色试验的操作步骤
观察K的焰色时要透过蓝色钴玻璃,以滤去黄光,排除Na元素的干扰。
3.ⅤA族元素(氮族元素)的性质
元素
氮(N)、磷(P)、砷(As)、
锑(Sb)、铋(Bi)、镆(Mc)
原子核外
电子排布
最外层电子数均为5,电子层数依次增多
化学性质
得电子能力逐渐减弱,失电子能力逐渐增强
4.过渡元素的性质
元素
元素周期表中第3~12列(副族和Ⅷ族)中的元素,包括了大部分金属元素,如铁、铜、镍、银和金等
原子核外
电子排布
最外层电子数为1~2(钯除外)
单质的物
理性质
大部分单质既坚硬又有光泽,金、铜等单质具有独特的色泽;均具有良好的导电性
单质的化
学性质
多数单质比较稳定,与空气和水反应缓慢或根本不能反应
1.下列有关ⅡA族和ⅤA族的说法正确的是( )
- 13 -
A.两族元素在自然界中均无游离态
B.两族元素均含金属元素与非金属元素
C.“生命元素”N元素位于第2周期ⅤA族
D.“国防金属”Mg元素位于第2周期ⅡA族
解析:选C。N元素存在游离态的N2,A错;ⅡA族只含金属元素(即Be、Mg、Ca、Sr、Ba、Ra),B错;N元素被称为“生命元素”,位于第2周期ⅤA族,C对;Mg被称为“国防金属”,位于第3周期ⅡA族,D错。
2.下列对砷(As)的有关判断正确的是( )
A.砷原子序数为33,它与铝同主族
B.砷的原子半径小于磷的原子半径
C.剧毒药品砒霜的主要成分是As2O3,其中砷元素的化合价为+3价
D.砷原子的得电子能力比氮原子的得电子能力强
解析:选C。砷与氮同主族,位于第ⅤA族,而铝位于第ⅢA 族,A错;砷与磷位于同一主族且在磷的下方,故原子半径砷大于磷,B错;由化学式As2O3可知砷的化合价为+3价,C对;砷与氮同主族且电子层数比氮多,故砷的得电子能力比氮的得电子能力弱,D错。
3.小明同学在灼烧下列物质时,记录了如下现象,你认为不正确的是( )
A.Na2O—淡黄色
B.Cu(NO3)2—绿色
C.KCl—紫色(透过蓝色钴玻璃)
D.BaSO4—紫红色
解析:选D。钡元素焰色试验为黄绿色。
课堂小结
合格考训练
1.(2019·临川一中高一开学考试)如图是钛元素在元素周期表中的信息示意图。从图中获取的信息正确的是( )
A.钛元素属于非金属元素
B.钛原子的中子数为25.87
C.钛原子的核外电子数为47
- 13 -
D.钛原子的质子数为22
解析:选D。根据图中元素周期表中的信息示意图可以获得的信息:左上角的数字表示原子序数,原子序数=核电荷数=质子数=核外电子数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,依此进行分析判断。
2.(2019·广南第三中学高二开学考试)下列对元素周期表的认识正确的是( )
A.有9个横行,分为7个周期
B.有16个纵列,分为16个族
C.有3个短周期、4个长周期
D.非金属元素存在主族与副族中
解析:选C。元素周期表有7个横行,分为7个周期;有18个纵列,分为16个族,其中7个主族、7个副族、1个Ⅷ族和1个0族;有7个周期,其中1、2、3为短周期,4、5、6、7为长周期;副族中没有非金属元素,非金属元素全部是主族或0族元素。
3.(2019·盈江第一高级中学高二开学考试)下列元素不属于主族元素的是( )
A.磷 B.钙
C.锌 D.硅
解析:选C。磷位于周期表第ⅤA族,属于主族元素;钙位于周期表第ⅡA族,属于主族元素;锌位于周期表第ⅡB族,不属于主族元素;硅位于周期表第ⅣA族,属于主族元素。
4.(2019·安徽高一期末)今年是门捷列夫发现元素周期律150周年,联合国将2019年定为“国际化学元素周期表年”。下列有关化学元素周期表的说法正确的是( )
A.元素周期表共有16个纵列
B.第ⅦA元素的非金属性自上而下逐渐减弱
C.主族元素均呈现与其族序数相同的最高化合价
D.第3周期主族元素的原子半径自左向右依次增大
解析:选B。元素周期表共有18个纵列,分为16个族;第ⅦA元素为卤族元素,非金属性自上而下逐渐减弱;氧元素没有最高正化合价,氟元素没有正化合价;第3周期主族元素的原子半径自左向右依次减小。
5.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)第ⅡA族元素的最外层电子数____________;
(2)第3周期主族元素的最高正化合价____________;
(3)F-、Na+、Mg2+、Al3+的离子半径____________。
- 13 -
解析:(1)第ⅡA族元素的最外层电子数相等;(2)第3周期主族元素的最高正化合价从左到右依次升高;(3)四种离子有相同的电子层结构,核电荷数越小,离子半径越大。
答案:(1)b (2)c (3)a
6.元素周期表是学习和研究化学的重要工具。如下表所示是元素周期表的部分信息:
(1)地壳中含量最多的金属元素的原子序数是________。
(2)分析元素周期表的规律可推知,表中X的元素符号为________。
(3)Ca在元素周期表中的位置为________________。
(4)写出一个由原子序数分别为1、7、17的三种元素组成的常见化合物的化学式:__________________。
解析:(1)地壳中含量最多的金属元素是Al,其原子序数为13。(2)由元素周期表的规律可推知,X应为S。(3)Ca 位于元素周期表中第4周期第ⅡA族。(4)H、N、Cl三种元素组成的常见化合物为NH4Cl。
答案:(1)13 (2)S (3)第4周期第ⅡA族
(4)NH4Cl
等级性测试
1.(2019·湖南高一期末)某金属元素的一个原子失去两个电子后,转变为具有Ne原子的电子层结构的离子,则该金属元素在元素周期表中的位置是( )
A.第3周期ⅠA族
B.第3周期ⅡA族
C.第4周期ⅠA族
D.第4周期ⅡA族
解析:选B。Ne为10号元素,其原子结构示意图为,该金属离子得到2个电子推出该金属元素的原子结构示意图为即该金属元素位于第3周期ⅡA族,故选项B正确。
- 13 -
2.(2019·巴中中学高一期中)如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是( )
A
C
B
A.B为第2周期的元素
B.C为第ⅤA族元素
C.三种元素不全是非金属元素
D.C是化学性质最活泼的非金属元素
解析:选D。由周期表中短周期的一部分,设A的质子数为x,则B的质子数为x+9,C的质子数为x+2,由A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数可知,x+(x+9)+(x+2)=2(x+9),解得x=7,则A为N元素,B为S元素,C为F元素。B为S元素,是第3周期的元素,A项错误;C为F元素,为第ⅦA族元素,B项错误;N、S、F都是非金属元素,C项错误;F为第ⅦA族元素,极易得电子,F元素是化学性质最活泼的非金属元素,D项正确。
3.(2019·哈尔滨六中高一期末)“嫦娥一号”需完成的四大科学目标之一是探测下列14种元素在月球的含量和分布:K、Th、U、O、Si、Mg、Al、Ca、Fe、Ti、Na、Mn、Cr、Gd,其中属于短周期元素的有( )
A.4种 B.5种
C.6种 D.7种
解析:选B。短周期即1、2、3周期,K、Th、U、O、Si、Mg、Al、Ca、Fe、Ti、Na、Mn、Cr、Gd中O、Si、Mg、Al、Na位于短周期。
4.(2019·重庆高一期末)下列各表是元素周期表的一部分,表中数字表示的原子序数与其在周期表中的位置相符合的是( )
- 13 -
解析:选D。1号元素和2号元素不应只隔1纵列,且1号元素与11号元素之间还有一周期的元素,还要有一横行;4号元素(Be)和13号元素(Al)中间应有10纵列过渡元素;10号元素(Ne)为0族元素,与15、16号元素不在同一周期;9、17、35号元素是第ⅦA族元素,16号元素是第3周期第ⅥA族元素,18号元素是第3周期0族元素,中间一行的16、17、18号元素是第3周期元素,符合位置关系,D正确。
5.已知In的原子结构示意图为,则下列关于In的说法不正确的是( )
A.In为长周期元素
B.In为过渡元素
C.In是第5周期ⅢA族元素
D.In在反应中容易失电子
解析:选B。从该元素的原子结构示意图可知,该元素有5个电子层,最外层有3个电子,故该元素在第5周期ⅢA族,所以A、C正确,B不正确;该元素最外层有3个电子,在反应中易失去3个电子而达到稳定结构,所以D正确。
6.0.75 mol RO中共有30 mol电子,则R在元素周期表中的位置是( )
A.第2周期ⅤA族 B.第3周期ⅣA族
C.第2周期ⅥA族 D.第3周期ⅦA族
解析:选B。设R的原子序数为x,则RO核外共有电子数为x+3×8+2=x+26,由题意得:(x+26)×0.75 mol=30 mol,则x=14,即R为硅元素,Si原子核外有3个电子层,
- 13 -
最外层有4个电子,因此硅元素位于元素周期表中第3周期ⅣA族。
7.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )
A.原子半径:Br>Se>P
B.还原性:S2->Se2->Br-
C.Se在元素周期表中位于第4周期ⅥA族
D.Se、Br位于同一主族
解析:选C。由图示信息可知Se为34号元素,Br为35号元素,Se和Br位于同一周期且Se位于Br的左侧,原子半径Se>Br,A、D项错误;Se和S位于同一主族,且Se位于S的下一周期,故还原性Se2->S2-,B项错误;由图示信息可知Se位于第4周期ⅥA族,C项正确。
8.我国的纳米基础研究能力已跻身世界前列,例如曾制得一种合成纳米材料,其化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的( )
A.第3周期ⅤA族
B.第4周期ⅤA族
C.第5周期ⅢA族
D.第4周期ⅢA族
解析:选D。化合物RN中N是-3价,则R是+3价,已知该化合物中的R3+核外有28个电子,则R的原子序数是28+3=31,所以R是Ga元素,位于元素周期表的第4周期ⅢA族。
9.短周期中有X、Y、Z三种元素,Z可分别与X、Y组成化合物XZ2、ZY2,这三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可推知X、Y、Z依次为( )
A.Na、F、O B.N、O、P
C.C、F、O D.C、O、S
解析:选D。短周期中的X、Y、Z三种元素,令它们的核外电子数分别为a、b、c,三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,则a+b+c=30,a+2c=38,故c-b=8,且Y与Z可以形成ZY2,可推知Y为O元素,Z为S元素,故X原子的核外电子数=30-8-16=6,X为C元素。
10.短周期元素X、Y、Z在周期表中的相对位置如图所示,下列判断正确的是( )
A.X是最活泼的非金属元素
- 13 -
B.Y的最高化合价为+7
C.Z原子的最外层电子数是6
D.3种元素的单质分子都是双原子分子
解析:选C。由于X、Y、Z都属于短周期元素,则X一定在第 1周期,而第1周期只有两种元素,X一定是He,不难判断出Y、Z分别为F、S。He为稀有气体元素,化学性质非常稳定,是单原子分子,A、D错误;F是最活泼的非金属元素,没有正价,B错误;S原子的最外层电子数是6,C正确。
11.(2019·安徽高一开学考试)结合元素周期表,用化学用语回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的上边界。
(2)表中所列元素,属于短周期元素的有____________,属于主族元素的有________种;i元素位于第________周期________族。
(3)元素f是第________周期________族元素,请在如图方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
(4)在元素周期表中,同一族(纵列)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是________(填字母)。
A.He和Ne B.B和Mg
C.Al和Si D.F和Cl
解析:(1)第1周期有2种元素,第2、3周期各有8种元素,则元素周期表的上边界补全后如下图:
(2)元素周期表中前3周期为短周期,表中所列元素,属于短周期元素的有H、C、Na、Mg、Al、S、Ar,属于主族元素的有H、C、Na、Mg、Al、S共6种;i元素为锌,在元素周期表中位于第4周期ⅡB族。
- 13 -
(3)元素f为S元素,位于第3周期ⅥA族,原子序数为16,相对原子质量为32,根据要求可写为。
(4)A.He和Ne均为稀有气体元素,化学性质均比较稳定,符合题意,正确;B.B和Mg的最外层电子数分别为3和2,化学性质不相似,错误;C.Al和Si的最外层电子数分别是3和4,化学性质不相似,错误;D.F和Cl同为卤族元素,最外层电子数均为7,易得电子,化学性质相似,正确。
答案:
(1)
(2)H、C、Na、Mg、Al、S、Ar 6 4 ⅡB
(3)3 ⅥA
(4)AD
12.A、B、C、D、E五种元素在周期表中所处的相对位置如图所示,其中A、B、C位于短周期。又知A、C两元素的原子核外电子数之和等于B元素原子的质子数,B元素原子核内质子数和中子数相等。
请回答下列问题:
(1)A、B、C三种元素的名称分别为________、________、________。
(2)B元素位于元素周期表中第________周期________族。
(3)与C元素位于同主族的另一种短周期元素的元素符号是________。
(4)A元素的单质与H2反应的化学方程式为______________________。
(5)E的元素符号是________;D的原子序数为________。
解析:设A与C中间的元素的原子序数为x,则A、B、C元素的原子序数分别为x-1、x+8、x+1,则x-1+x+1=x+8,x=8,则A为氮元素,B为硫元素,C为氟元素。据此即可解答。
答案:(1)氮 硫 氟 (2)3 ⅥA
(3)Cl (4)N2+3H22NH3
- 13 -
(5)Br 33
- 13 -