- 1.30 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.了解铝的重要化合物的主要性
质及应用。
2.了解铝的化合物相互转变的图
象。
3.了解与Al(OH)3相关的简单计
算。
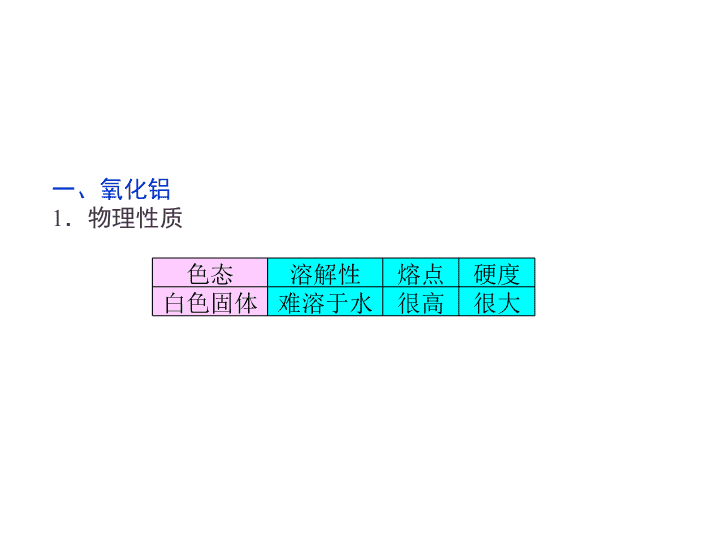
一、氧化铝
1.物理性质
色态 溶解性 熔点 硬度
白色固体 难溶于水 很高 很大
2.化学性质
Al2O3是 氧化物,与 或 溶液都能反应生
成盐和水。
(1)与强酸反应的离子方程式:Al2O3+6H+===2Al3+
+3H2O。
(2)与强碱反应的离子方程式:Al2O3+2OH-
===2AlO2
-+H2O。
3.用途
(1)冶炼金属铝的原料。
(2)良好的 材料。
两性 酸 强碱
耐火
二、氢氧化铝
1.物理性质
溶于水的 物质。
2.化学性质 不 白色胶状
3.用途
(1)能凝聚水中的悬浮物并能 ,可用
来净水。
(2)利用其 性,可用作胃酸中和剂。弱碱
吸附色素
已学过的物质中既能与盐酸,又能与NaOH
溶液反应的有哪些?
【思考·提示】 有Al、Al2O3、Al(OH)3、
NaHCO3、(NH4)2CO3等。
思考
三、硫酸铝钾[KAl(SO4)2]
1.电离方程式:KAl(SO4)2===K++Al3+
+2SO42-。
2.十二水合硫酸铝钾
化学式: ,俗名: ,
无色晶体,可溶于水,在天然水中生
成 ,可用作净水剂。
KAl(SO4)2·12H2
O明矾
Al(OH)3胶体
“铝三角”及其之间的相互转化
1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应:
Al3++3OH-(少量)===Al(OH)3↓
(2)可溶性铝盐与氨水反应:
Al3++3NH3·H2O===Al(OH)3↓+3NH4
+
2.Al(OH)3―→Al3+
Al(OH)3溶于强酸溶液:
Al(OH)3+3H+===Al3++3H2O
3.Al3+―→AlO2
-
可溶性铝盐与过量的强碱反应:
Al3++4OH-(过量)===AlO2
-+2H2O
4.AlO2
-―→Al3+
偏铝酸盐溶液与足量的盐酸反应:
AlO2
-+4H+===Al3++2H2O
5.AlO2
-―→Al(OH)3(1)偏铝酸钠溶液中加入少量盐酸:
AlO2
-+H+(少量)+H2O===Al(OH)3↓
(2)偏铝酸钠溶液中通入CO2:
2AlO2
-+CO2(少量)+3H2O===2Al(OH)3↓+CO32-
AlO2
-+CO2(过量)+2H2O===Al(OH)3↓+HCO3
-
6.Al(OH)3―→AlO2
-
Al(OH)3溶于强碱溶液:
Al(OH)3+OH-===AlO2
-+2H2O
因Al(OH)3易溶于NaOH溶液,所以在制备
Al(OH)3时,不用Al3+与强碱反应,可向可溶性
铝盐中加入氨水,或向NaAlO2溶液中通入CO2来
制备。
特别提醒
A、B、C、D、E五种化合物,均含有常见
元素,它们的转化关系如图所示,其中A为澄清
溶液,C为难溶的白色固体,E则易溶于水,若
取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴
玻璃)。
(1)写出化学式:A________,C________,
D________,E________。
(2)写出下列反应的离子方程式。
A→B:__________________________
_______________________________________
_______,
F→E:___________________________
_______________________________________
______。
【解析】 题目应以B物质作为突破口:
【答案】 (1)KAlO2 Al2O3 AlCl3 NaAlO2
(2)AlO2
-+CO2+2H2O===Al(OH)3↓+HCO3
-
2Al+2OH-+2H2O===2AlO2
-+3H2↑
A.Al(OH)3 B.AlCl3
C.HCl D.NaOH解析:选A。由Al3+转变为Al(OH)3,再转变为AlO2
-,是通过加入OH-实现
的,故由AlO2
-再转变为Al3+,应加入H+,AlO2
-首先转化为Al(OH)3,然后转化为
Al3+,A项符合题意。
1.相关图象
有关Al(OH)3沉淀的图象分析及有关计算
试剂
内容
向AlCl3溶液中滴加
NaOH溶液至过量
向NaAlO2溶液中加入盐酸
至过量
现象
立即产生白色沉淀→
渐多→最多→渐少→
消失
立即产生白色沉淀→渐多
→最多→渐少→消失
反应
Al3++3OH-
===Al(OH)3↓Al(OH)3
+OH-=== AlO2
-+
2H2O
AlO2
-+H++
H2O===Al(OH)3↓Al(OH)3
+3H+===Al3++3H2O
试剂
内容
向AlCl3溶液中滴加
NaOH溶液至过量
向NaAlO2溶液中加入盐
酸至过量
图象
2.滴加过程中铝元素的存在形式分析
(1)向1 L 1 mol/L的AlCl3溶液中滴加
NaOH溶液
(2)向1 L 1 mol/L的NaAlO2溶液中滴加稀
盐酸
向AlCl3溶液中加NaOH溶液和向NaAlO2溶
液中加盐酸,只要沉淀量未达最大值(如图中a),
则产生沉淀对应的碱或酸的量有两种情况,计算
时要注意讨论。
特别提醒
向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100
mL KOH溶液,充分反应得到3.9 g沉淀,则KOH溶
液的物质的量浓度可能是( )
A.1 mol·L-1 B.3 mol·L-1
C.1.5 mol·L-1 D.3.5 mol·L-1
【思路点拨】 本题可用两种方法求解:
法一:根据Al3+和Al(OH)3沉淀的量的关系,计
算KOH的浓度,要分别考虑KOH不足和KOH过量两
种情况。
法二:利用图象法,根据题意画出Al3+与KOH反应生成沉淀的图象,分析求解。
【解析】 首先写出有关反应的化学方程式,根据所给的数据找出已
知量和未知量的关系。
法二:用图象法求解,如图所示,当生成沉淀0.05 mol时,①需KOH
0.15 mol;②需KOH 0.35 mol。
【答案】 CD
若将上题中“50 mL”改为100 mL,KOH的浓度
可能是多少?
【提示】 可能为1.5 mol/L或7.5 mol/L,反应
的图象为
根据线段间比例可以得出a=0.15 b=0.75
2.向用HCl酸化过的AlCl3溶液中逐滴滴
入NaOH溶液,图中能正确表示这个反应的是(
)
解析:选D。向AlCl3溶液中逐滴滴入NaOH溶液,先生成白色沉淀,
再加入NaOH溶液,沉淀逐渐溶解,最后完全消失,生成1 mol Al(OH)3需3
mol NaOH,溶解1 mol Al(OH)3需1 mol NaOH。NaOH的用量应是3∶ 1,A、B
错误,用HCl酸化过的AlCl3溶液中含有酸,加入NaOH溶液先中和溶液中的酸,
然后才生成Al(OH)3沉淀,故C也是错误的。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页