- 708.16 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 原子结构与化学键
考点清单
基础知识
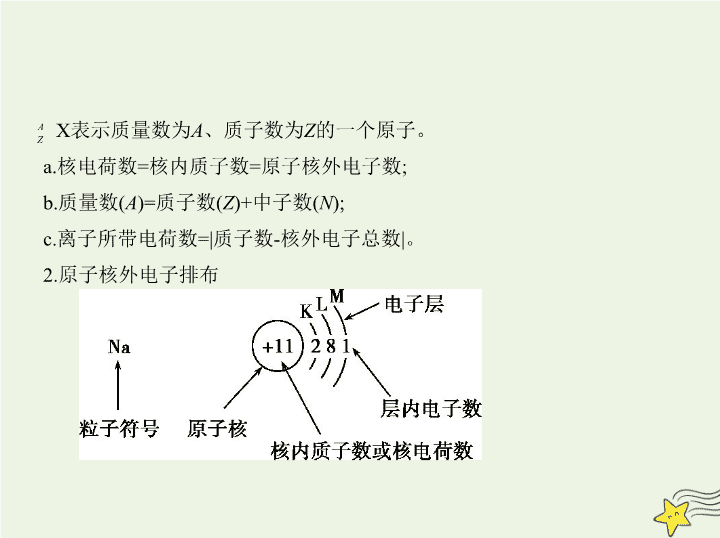
1.原子的构成及各微粒之间的数量关系
(1)原子的构成
原子
X)
X表示质量数为
A
、质子数为
Z
的一个原子。
a.核电荷数=核内质子数=原子核外电子数;
b.质量数(
A
)=质子数(
Z
)+中子数(
N
);
c.离子所带电荷数=|质子数-核外电子总数|。
2.原子核外电子排布
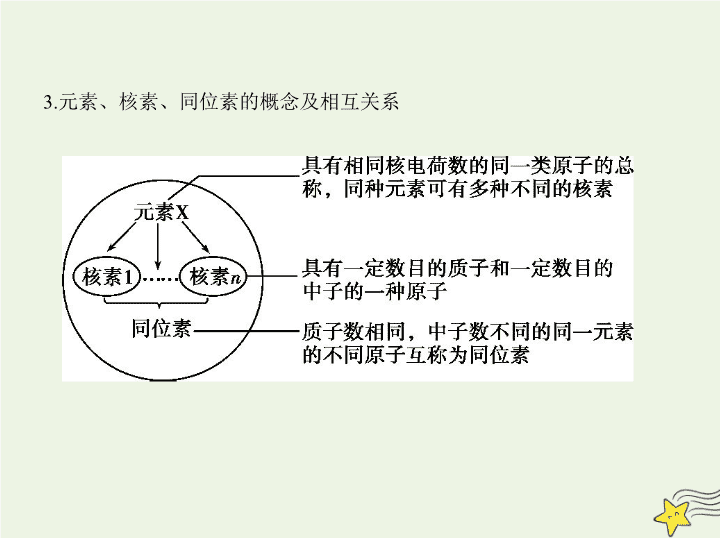
3.元素、核素、同位素的概念及相互关系
4.离子键、共价键的比较
离子键
共价键
非极性键
极性键
概念
阴、阳离子通过静电
作用所形成的化学键
原子间通过共用电子对(电子云重叠)而形成的化
学键
成键粒子
阴、阳离子
原子
成键实质
阴、阳离子的静电作用
共用电子对不偏向任何一方
共用电子对偏向一方
原子
形成条件
活泼金属元素与活泼
非金属元素经电子得
失,形成离子键
同种元素原子之间成
键
不同种元素原子之间
成键
形成的物质
离子化合物
非金属单质;某些共价
化合物或离子化合物
共价化合物或离子化
合物
5.化学键与物质类别的关系
特别提示 ①离子化合物中一定含有离子键,离子键只能存在于离子化合
物中。
②共价键可存在于离子化合物、共价化合物和单质中。
③熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导
电的化合物是共价化合物,如HCl。
6.化学键的表示方法——电子式
(1)概念:在元素符号周围用“·”或“
×
”来代表原子的最外层电子(价电
子)的式子。
考点二 元素周期表与元素周期律
基础知识
一、元素周期表
1.元素周期表的结构
2.元素原子最外层电子数与族的关系
(1)最外层电子数为1~2的元素:ⅠA族、ⅡA族、副族、0族(He)。
(2)最外层电子数在3~7之间的元素一定是主族元素。
(3)最外层电子数为8的元素:0族(He除外)。
3.元素周期表的构成规律
(1)同构规律
稀有气体原子与同周期非金属元素的阴离子、下周期金属元素的阳离子,
具有相同的电子层结构。
(2)同主族序数差规律
a.ⅠA族元素随电子层数的增加,原子序数依次相差2、8、8、18、18、32;
b.ⅡA族元素随电子层数的增加,原子序数依次相差8、8、18、18、32;0族
元素依次差8、8、18、18、32、32;
c.ⅢA~ⅦA族元素随电子层数的增加,原子序数依次相差8、18、18、32、
32。
(3)对角线关系
对角线元素(图中的A与D)存在着相似性,如Li与Mg、Be与Al等,但只适用
于第二、三周期。这是由A、D的原子半径相近引起的。
项目
同周期(左→右)
同主族(上→下)
原子
结构
核电荷数
逐渐增大
逐渐增大
电子层数
相同
逐渐增多
原子半径
逐渐减小(稀有气体元
素除外)
逐渐增大
离子半径
阳离子逐渐减小,阴离
子逐渐减小,
r
(阴离子)>
r
(阳离子)
逐渐增大
二、元素周期律
性质
化合价
最高正化合价由+1→+7(O、F除外),最低负化合价=-(8-主族序数)
最高正化合价=主族序
数(O、F除外)
元素的金属性和非金
属性
金属性逐渐减弱非金属性逐渐增强(稀有气体元素除外)
金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原
性
阳离子氧化性逐渐增强阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱阴离子还原性逐渐增强
气态氢化物稳定性
逐渐增强
逐渐减弱
最高价氧化物对应的
水化物的酸碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
第一电离能
呈增大趋势(ⅡA、
ⅤA族元素除外)
逐渐减小
电负性
逐渐增大
逐渐减小
项目
同周期(左→右)
同主族(上→下)
一、元素金属性、非金属性强弱的比较
1.比较元素金属性强弱的方法
(1)金属与水(或非氧化性酸)的反应越容易,其对应元素的金属性越强。
(2)最高价氧化物对应水化物的碱性越强,则对应金属元素的金属性越强。
(3)在金属活动性顺序中,金属元素的位置越靠前,其金属性越强。
(4)同一周期,金属元素越靠前,其金属性越强;同一主族,金属元素越靠下,其
金属性越强。
知能拓展
(5)
金属与盐溶液的置换反应
,
若
A
元素的单质能置换出
B
元素的单质
,
则
A
元素的金属性强于
B
元素。
(6)
一般金属阳离子的氧化性越强
,
则对应金属元素的金属性越弱。
(
注
:
氧
化性Fe
3+
>Cu
2+
>Fe
2+
,金属性Fe>Cu)
(7)电化学原理:不同金属形成原电池时,通常作负极的金属的金属性强;通
常在电解池阴极上先析出的金属的金属性弱。
2.比较元素非金属性强弱的方法
(1)非金属单质与H
2
越易化合,则其对应元素的非金属性越强。
(2)形成的简单氢化物越稳定,则其对应元素的非金属性越强。
(3)最高价氧化物对应水化物的酸性越强,其对应元素的非金属性越强。
(4)同一周期(稀有气体元素除外),非金属元素越靠右,其非金属性越强;同
一主族,非金属元素越靠上,其非金属性越强。
(5)非金属之间的置换反应,若A元素的单质能置换出B元素的单质,则A元
素的非金属性强于B元素。
二、微粒半径大小的比较
1.微粒半径大小的比较规律
原子
半径
①同一周期,随着原子序数递增,原子半径逐渐减
小(稀有气体元素除外)。如:
r
(Na)>
r
(Mg)>
r
(Al)>
r
(Si)>
r
(P)>
r
(S)>
r
(Cl)
②同一主族,随着电子层数递增,原子半径逐渐增
大。如:
r
(Li)<
r
(Na)<
r
(K)<
r
(Rb)<
r
(Cs)
③不同周期和主族,选参照进行比较。如Rb和Ca
比较,因
r
(K)>
r
(Ca),
r
(Rb)>
r
(K),所以
r
(Rb)>
r
(Ca)
离子
半径
①同种元素的粒子半径:阴离子大于原子,原子大
于阳离子,低价阳离子大于高价阳离子。如:
r
(Cl
-
)>
r
(Cl),
r
(Fe)>
r
(Fe
2+
)>
r
(Fe
3+
)
②电子层结构相同的离子,核电荷数越大,半径越
小。如:
r
(O
2-
)>
r
(F
-
)>
r
(Na
+
)>
r
(Mg
2+
)>
r
(Al
3+
)
③带相同电荷的离子,电子层数越多,半径越大。
如:
r
(Li
+
)<
r
(Na
+
)<
r
(K
+
)<
r
(Rb
+
)<
r
(Cs
+
),
r
(O
2-
)<
r
(S
2-
)
<
r
(Se
2-
)<
r
(Te
2-
)
④核电荷数、电子层数均不同的离子可选一种
离子作为参照进行比较。如比较
r
(K
+
)与
r
(Mg
2+
)
可选
r
(Na
+
)为参照:
r
(K
+
)>
r
(Na
+
)>
r
(Mg
2+
)
2.“三看”法快速判断简单粒子半径大小
一看电子层数:最外层电子数相同时,电子层数越多,半径越大。
二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
三看核外电子数:当核电荷数相同时,核外电子数越多,半径越大。
例 (2019江西上饶六校一联,12)X、Y、Z、W、R是5种短周期元素,原子
序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是
次外层电子数的3倍, Z、W、R处于同一周期,R与Y处于同一族,Z、W原
子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确
的是
( )
A.Y、Z、W离子具有相同的电子层结构,半径依次增大
B.元素Z、W、R的最高价氧化物对应水化物两两之间可以反应
C.元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类
型的共价键
D.元素Y、R分别与元素X形成的简单化合物的热稳定性:X
m
Y
Na
+
>A
,故A错误;B项,最高价氧化物对应的水化物分别是NaOH、Al(OH)
3
、H
2
SO
4
,氢氧化铝为两性氢氧化物,因此两两之间可以反应,故B正确;C项,形
成的化合物是H
2
O和H
2
O
2
,H
2
O中只含极性键,H
2
O
2
中含有极性键和非极性
键,故C错误;D项,形成的化合物分别是H
2
O、H
2
S,O的非金属性强于S,则
H
2
O的稳定性强于H
2
S,故D错误。
答案 B
应用元素推断常见“套路”,结合原子半径大小比较规律、元素金属性强
弱比较规律、元素非金属性强弱比较规律以及晶体类型与化学键关系,解
决元素推断类问题。
实践探究
例 (2019江苏常州教育学会学业水平监测,8)短周期主族元素X、Y、Z、
W原子序数依次增大,Ⅹ是空气中含量最多的元素,Y是海水中质量分数最
大的元素,Z元素原子是短周期主族元素中原子半径最大的,W与X处于同
一主族。下列说法正确的是( )
A.原子半径:W>Z>Y
B.由Y、Z组成的化合物中均不含共价键
C.X的最高价氧化物对应水化物的酸性比W的强
D.X的简单气态氢化物的热稳定性比Y的强
思路分析 根据题意分析可得元素X、Y、Z、W分别为N、O、Na、P。
原子半径:
r
(Na)>
r
(P)>
r
(O),即
r
(Z)>
r
(W)>
r
(Y);Na与O形成的Na
2
O
2
中含有共
价键;HNO
3
酸性比H
3
PO
4
强;NH
3
的热稳定性比H
2
O弱。
答案 C
题目价值 能从宏观和微观上收集证据,对有关的化学问题提出假设,能依
据证据证明或证伪假设,体会证据推理与模型认知过程。