- 146.75 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
选择题专项训练八 化学反应速率与化学平衡
1.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始n(H2O)n(CH4)=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如右图所示。下列说法正确的是( )
A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中n(H2O)n(CH4)=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
答案:A
解析:A项,随着温度的升高,φ(CH4)减小,说明升温平衡正向移动,正反应吸热,ΔH>0,正确;B项,n(H2O)n(CH4)=Z,Z越大,CH4转化率越大,平衡时CH4体积分数越小,则b>3>a,错误;
C项, CH4 + H2O CO + 3H2
起始: a 3a 0 0
转化: x x x x
平衡: a-x 3a-x x x
n(H2O)n(CH4)=3a-xa-x=3(a-13x)a-x>3,错误;
D项,加压平衡逆向移动,φ(CH4)增大,错误。
2.一定条件下,在容积为2 L的密闭容器中,3 mol X和3 mol Y发生反应:3X(g)+Y(g)2Z(g) ΔH>0,经60 s反应达到平衡,生成0.4 mol Z。下列说法正确的是( )
A.60 s内反应速率为v(X)=0.05 mol·L-1·s-1
B.其他条件不变,升高温度,正反应速率增大,逆反应速率减小
C.其他条件不变,若初始投入2 mol X和2 mol Y,则物质Y的转化率减小
D.其他条件不变,将容器容积变为4 L,Z的平衡浓度变为原来的12
答案:C
解析:反应经60 s达到平衡,生成0.4 mol Z,则v(Z)=0.4mol2 L×60 s=1300 mol·L-1·s-1,故v(X)=32v(Z)=0.005 mol·L-1·s-1,A错误;其他条件不变,升高温度,正、逆反应速率均增大,B错误;其他条件不变,若初始投入2 mol X和2 mol Y,对比初始投入3 mol X和3 mol Y,相当于降低了体系的压强,故平衡左移,Y的转化率减小,C正确;其他条件不变,将容器容积变为4 L,由于压强减小,平衡左移,导致Z的浓度在容积加倍的基础上继续降低,故Z的浓度将小于原来的12,D错误。
- 3 -
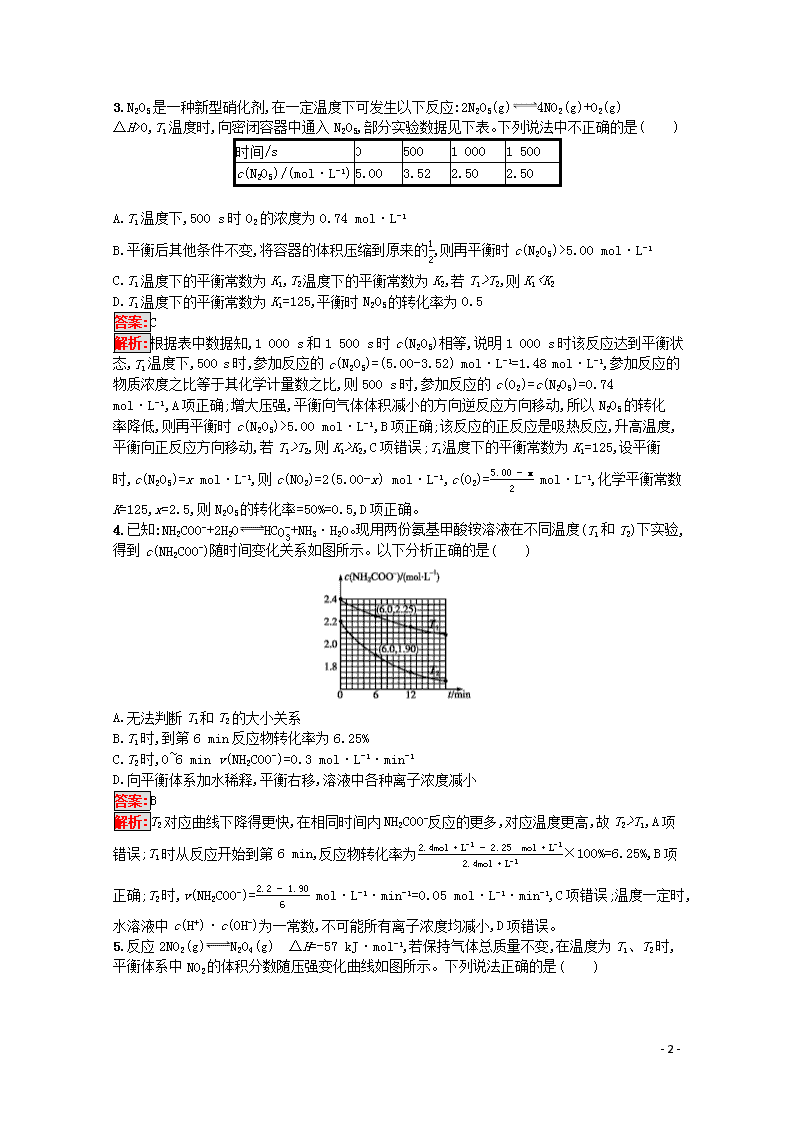
3.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)4NO2(g)+O2(g) ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表。下列说法中不正确的是( )
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
A.T1温度下,500 s时O2的浓度为0.74 mol·L-1
B.平衡后其他条件不变,将容器的体积压缩到原来的12,则再平衡时c(N2O5)>5.00 mol·L-1
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K15.00 mol·L-1,B项正确;该反应的正反应是吸热反应,升高温度,平衡向正反应方向移动,若T1>T2,则K1>K2,C项错误;T1温度下的平衡常数为K1=125,设平衡时,c(N2O5)=x mol·L-1,则c(NO2)=2(5.00-x) mol·L-1,c(O2)=5.00-x2 mol·L-1,化学平衡常数K=125,x=2.5,则N2O5的转化率=50%=0.5,D项正确。
4.已知:NH2COO-+2H2OHCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是( )
A.无法判断T1和T2的大小关系
B.T1时,到第6 min反应物转化率为6.25%
C.T2时,0~6 min v(NH2COO-)=0.3 mol·L-1·min-1
D.向平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
答案:B
解析:T2对应曲线下降得更快,在相同时间内NH2COO-反应的更多,对应温度更高,故T2>T1,A项错误;T1时从反应开始到第6 min,反应物转化率为2.4mol·L-1-2.25 mol·L-12.4mol·L-1×100%=6.25%,B项正确;T2时,v(NH2COO-)=2.2-1.906 mol·L-1·min-1=0.05 mol·L-1·min-1,C项错误;温度一定时,水溶液中c(H+)·c(OH-)为一常数,不可能所有离子浓度均减小,D项错误。
5.反应2NO2(g)N2O4(g) ΔH=-57 kJ·mol-1,若保持气体总质量不变,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
- 3 -
A.A、C两点气体的颜色:A浅,C深
B.A、C两点气体的平均相对分子质量:A>C
C.B、C两点的平衡常数:KB=KC
D.状态A通过升高温度可变成状态B
答案:A
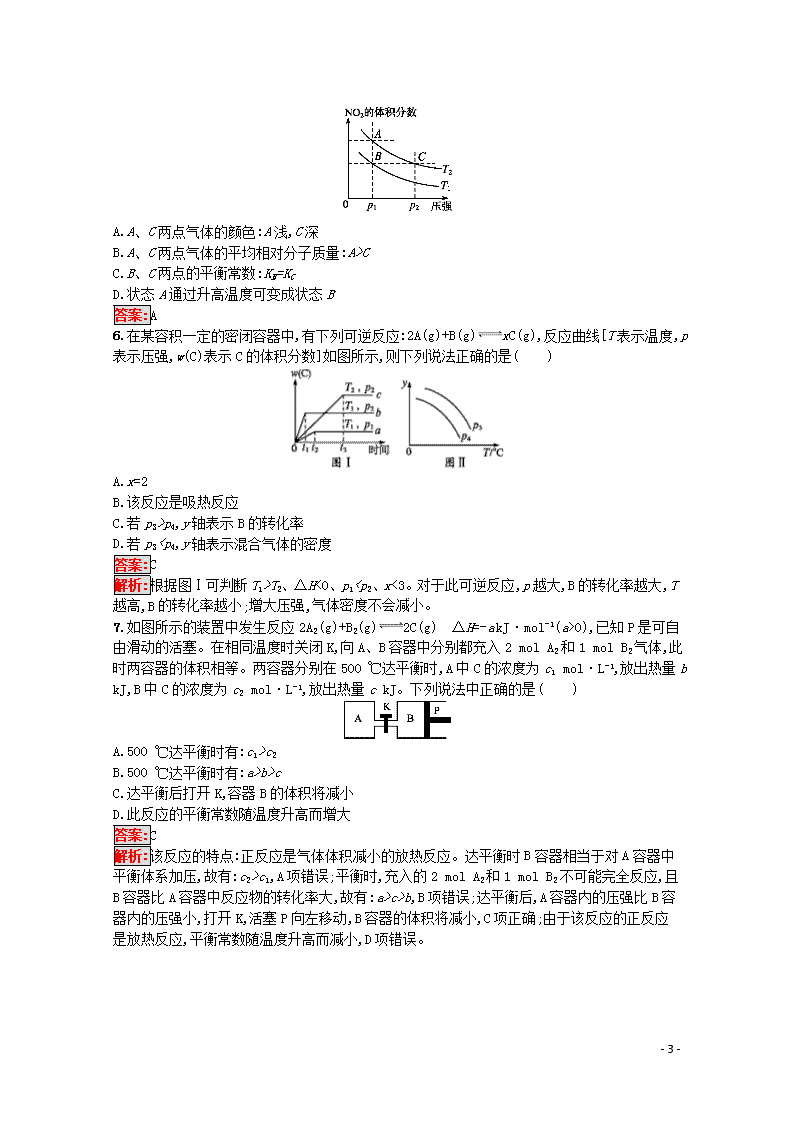
6.在某容积一定的密闭容器中,有下列可逆反应:2A(g)+B(g)xC(g),反应曲线[T表示温度,p表示压强,w(C)表示C的体积分数]如图所示,则下列说法正确的是( )
A.x=2
B.该反应是吸热反应
C.若p3>p4,y轴表示B的转化率
D.若p3T2、ΔH<0、p10),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别都充入2 mol A2和1 mol B2气体,此时两容器的体积相等。两容器分别在500 ℃达平衡时,A中C的浓度为c1 mol·L-1,放出热量b kJ,B中C的浓度为c2 mol·L-1,放出热量c kJ。下列说法中正确的是( )
A.500 ℃达平衡时有:c1>c2
B.500 ℃达平衡时有:a>b>c
C.达平衡后打开K,容器B的体积将减小
D.此反应的平衡常数随温度升高而增大
答案:C
解析:该反应的特点:正反应是气体体积减小的放热反应。达平衡时B容器相当于对A容器中平衡体系加压,故有:c2>c1,A项错误;平衡时,充入的2 mol A2和1 mol B2不可能完全反应,且B容器比A容器中反应物的转化率大,故有:a>c>b,B项错误;达平衡后,A容器内的压强比B容器内的压强小,打开K,活塞P向左移动,B容器的体积将减小,C项正确;由于该反应的正反应是放热反应,平衡常数随温度升高而减小,D项错误。
- 3 -
相关文档
- 广西专用2020版高考化学二轮复习选2021-07-033页
- 广西专用2020版高考化学二轮复习选2021-07-023页
- 名言警句、诗词、俗语、成语哲理选2021-06-0919页
- 名言警句、诗词、俗语、成语哲理选2021-06-0319页
- 2020高考物理二轮复习选择题专项训2021-06-027页
- 2013年高三物理选择题专项训练(7套2021-06-0216页
- 【物理】2020届二轮复习选择题专项2021-06-025页
- 【物理】2020届二轮复习选择题专项2021-06-026页
- 2020高考物理二轮复习选择题专项训2021-06-016页
- 新课标高考物理选择题专项训练20套2021-05-3139页