- 1.21 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题8 化学反应速率和化学平衡
【考情探究】
课
标
解
读
考点
化学反应速率
化学平衡状态和化学平衡常数
影响化学平衡移动的因素
有关化学平衡的计算
解读
1.了解化学反应速率的概念和定量表示方法
2.了解反应活化能的概念,了解催化剂的重要作用
3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释其一般规律
1.了解化学反应的可逆性及化学平衡的建立
2.掌握化学平衡的特征
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律
2.了解化学反应速率和化学平衡的调控在生活、生产和科研领域中的重要作用
1.能正确计算化学反应的转化率(α)
2.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算
考情分析
本专题的考题以中等题或难题为常见。设题形式通常有选择题和填空题
备考指导
2021年高考备考重点关注化学反应速率、化学平衡状态和化学平衡常数等基础知识。狠练基本功,站得稳,才能飞得高
【真题探秘】
基础篇固本夯基
【基础集训】
考点一 化学反应速率
- 11 -
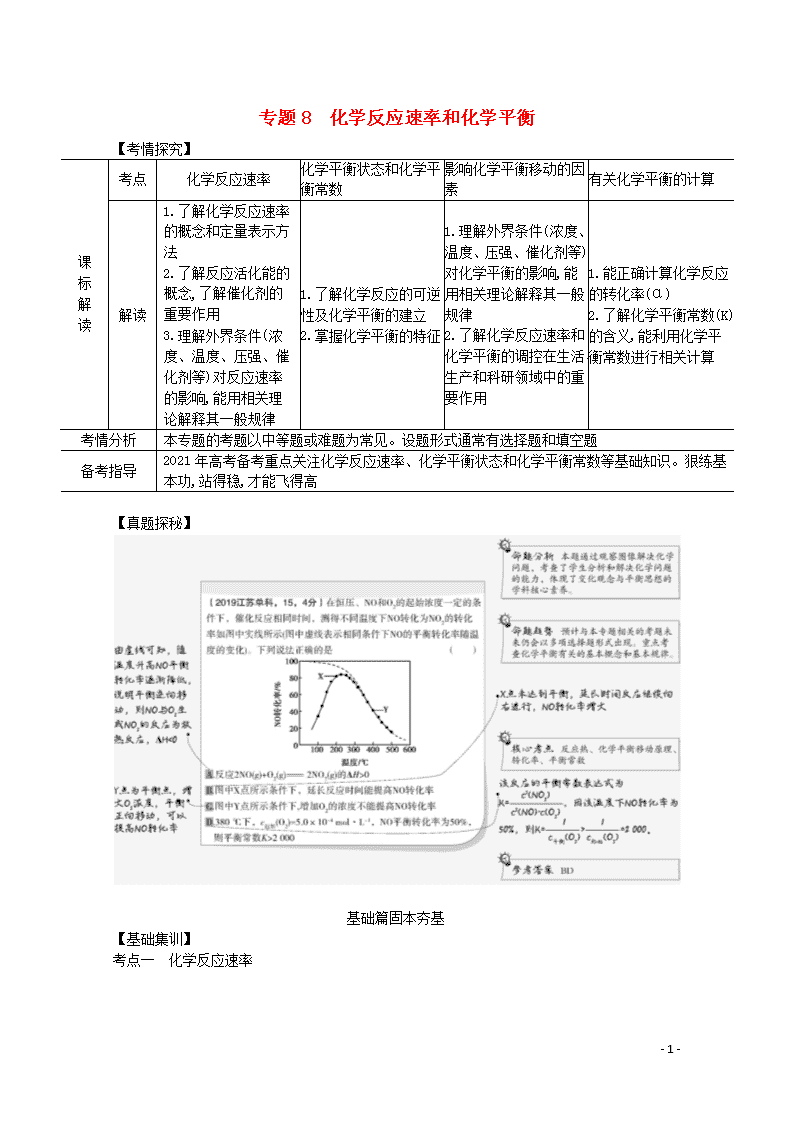
1.向体积均为2L的两个恒容密闭容器中分别充入1molSiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) ΔH=akJ·mol-1,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
A.T1>T2
B.T1℃时,0~100min反应的平均速率v(SiHCl3)=0.001mol·(L·min)-1
C.T2℃时,反应的平衡常数:K=164
D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同
答案 AC
2.下列图示与对应的叙述相符的是( )
A.图1表示恒温恒容条件下,反应N2+3H22NH3中c(NH3)与反应时间的关系,NH3的生成速率a点大于b点
B.图2表示1LpH=12CH3COONa溶液加水稀释至VL,溶液pH随lgV的变化关系图
C.图3表示AgCl在水中的沉淀溶解平衡曲线,a、b、c三点中a点表示不饱和溶液
D.图4表示用0.01mol·L-1NaOH溶液滴定20mL0.01mol·L-1H2SO4溶液时pH的变化
答案 C
3.一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)2SO3(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
t1
t2
t3
t4
n(SO3)/mol
0
0.8
1.4
1.8
1.8
下列说法正确的是( )
A.反应在0~t1s内v(O2)=0.4t1mol·L-1·s-1
B.保持其他条件不变,将体积压缩到1.0L,平衡常数不变
C.平衡时,再向容器中充入1molSO2和1molSO3,平衡向逆反应方向移动
D.保持温度不变,向该容器中再充入2molSO2、1molO2,反应达到新平衡时n(SO3)/n(O2)增大
- 11 -
答案 BD
考点二 化学平衡状态和化学平衡常数
4.两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器在不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是( )
容器
起始物质的量
NO
CO
Ⅰ
1mol
3mol
Ⅱ
6mol
2mol
A.N点的平衡常数为0.04
B.M、N两点容器内的压强:p(M)>2p(N)
C.若将容器Ⅰ的容积改为1L,T1温度下达到平衡时c(CO2)=0.25mol·L-1
D.若将容器Ⅱ改为绝热容器,实验起始温度为T1℃,达平衡时NO的转化率小于16.7%
答案 AD
5.在编号为①、②、③的容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
下列说法正确的是( )
A.该反应的正反应为放热反应
B.三个容器容积:①>②>③
C.在P点,CO转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时v(CO)正0,CO2的浓度与时间的关系如图所示:
- 11 -
①该温度下反应的平衡常数的值为 ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度为 mol·L-1。
②下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母)。
A.容器中的压强不变
B.气体的密度不再改变
C.v正(CO2)=v逆(CO)
D.c(CO2)=c(CO)
E.容器内气体总物质的量不变
答案 ①2.0 0.67(或23) ②A ③BC
考点三 影响化学平衡移动的因素
7.在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g)2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O平衡转化率如右下图所示:
容器
容积/L
起始物质的量/mol
N2O
N2
O2
Ⅰ
V1
0.1
0
0
Ⅱ
1.0
0.1
0
0
Ⅲ
V3
0.1
0
0
Ⅳ
1.0
0.06
0.06
0.04
下列说法正确的是( )
A.该反应的正反应放热
B.相同温度下反应时,平均反应速率:v(Ⅰ)>v(Ⅲ)
C.图中A、B、C三点处容器内总压强:p(Ⅰ)Av(N2O)逆
答案 CD
8.一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1,测得n(H2)随时间变化如曲线Ⅰ所示。下列说法正确的是( )
A.该反应在0~8min内CO2的平均反应速率是0.375mol·L-1·min-1
B.若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的体积分数大于20%
- 11 -
C.若起始时向上述容器充入4molCO2(g)、2molH2(g)、2molCH3OH(g)和1molH2O(g),则此时反应向正反应方向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
答案 BC
考点四 有关化学平衡的计算
9.一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)COCl2(g),其中容器Ⅰ中5min时达到平衡。
容器
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
CO
Cl2
COCl2
COCl2
Ⅰ
500
1.0
1.0
0
0.8
Ⅱ
500
1.0
a
0
0.5
Ⅲ
600
0.5
0.5
0.5
0.7
下列说法中正确的是( )
A.容器Ⅰ中前5min的平均反应速率v(CO)=0.16mol·L-1·min-1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55mol
D.若起始时向容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
答案 C
10.已知:CH4(g)+2H2S(g)CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,平衡时各物质的物质的量分数随温度的变化如下图所示:
下列说法正确的是( )
A.该反应的ΔH<0
B.X点CH4的转化率为20%
C.X点与Y点容器内压强比为55∶51
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)0,有关实验数据如下表所示:
容器
容积/L
温度/℃
起始量/mol
平衡量/mol
平衡
常数
C(s)
H2O(g)
H2(g)
甲
2
T1
2.0
4.0
3.2
K1
乙
1
T2
1.0
2.0
1.2
K2
- 11 -
下列说法正确的是( )
A.K1=12.8
B.T1nⅡ(H2)
D.达平衡时,若容器Ⅲ中H2的物质的量大于0.040mol,则该反应ΔH>0
答案 AC
2.(2019宿迁期末,15)一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0,测得反应的相关数据如下表:
容器1
容器2
容器3
反应温度T/K
600
600
500
反应物投入量
0.2molCO
0.4molH2
0.4molCO
0.8molH2
0.2molCH3OCH3
0.2molH2O
平衡v(CO)/
(mol·L-1·s-1)
v1
v2
v3
平衡n(H2)/mol
0.2
n2
n3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率α
α1(CO)
α2(CO)
α3(CH3OCH3)
平衡常数K
K1
K2
K3
下列说法正确的是( )
A.v10.4
B.K2=2.5×103,p2>p3
C.2p1α2(CO)
D.n3<0.4,α2(CO)+α3(CH3OCH3)<1
答案 BD
3.(2018盐城三模,15)在三个容积均为1L的恒温恒容密闭容器中,起始时按表中相应的物质的量加入物质,在相同温度下发生反应:3CO(g)+3H2(g)(CH3)2O(g)+CO2(g)(不发生其他反应)。CO的平衡转化率与温度和压强的关系如图所示。
容器
起始物质的量/mol
平衡转化率
CO
H2
(CH3)2O
CO2
CO
Ⅰ
0.3
0.3
0
0
50%
Ⅱ
0.3
0.3
0
0.1
- 11 -
Ⅲ
0
0
0.2
0.4
下列说法正确的是( )
A.该反应的ΔH<0,图中压强p1>p2
B.达到平衡时,容器Ⅱ中CO的平衡转化率大于50%
C.达到平衡时,容器Ⅰ与容器Ⅱ的总压强之比小于4∶5
D.达到平衡时,容器Ⅲ中n[(CH3)2O]是容器Ⅱ中的2倍
答案 AC
【五年高考】
考点一 化学反应速率
1.(2017江苏单科,10,2分)H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
答案 D
2.(2016江苏单科,10,2分)下列图示与对应的叙述不相符合的是( )
- 11 -
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
答案 A
3.[2015江苏单科,16(1)(3),6分]以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见下图。清液pH>11时CaSO4转化的离子方程式为 ;
能提高其转化速率的措施有 (填序号)。
A.搅拌浆料 B.加热浆料至100℃
C.增大氨水浓度 D.减小CO2通入速率
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是 。
答案 (1)CaSO4+2NH3·H2O+CO2CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-CaCO3+SO42- AC
(3)浸取液温度上升,溶液中c(H+)增大,促进固体中Ca2+浸出
4.(2019课标Ⅰ,28,14分)水煤气变换[CO(g)+H2O(g)CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO H2(填“大于”或“小于”)。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为 (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
- 11 -
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式 。
(4)Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。
计算曲线a的反应在30~90min内的平均速率
- 11 -
相关文档
- 广西专用2020版高考化学二轮复习选2021-07-053页
- 广西专用2020版高考化学二轮复习专2021-07-056页
- 高中化学 第二章 化学反应速率与化2021-07-059页
- 2020届高考化学二轮复习化学反应速2021-07-053页
- 2018届二轮复习化学反应速率与化学2021-07-0518页
- 2021版新高考化学一轮复习专题7化2021-07-0552页
- 高考化学备考优生百日闯关系列专题2021-07-0320页
- 2018届二轮复习化学反应速率与化学2021-07-0331页
- 2021版高考化学一轮复习专题7化学2021-07-0258页
- 2021版新高考地区选考化学(人教版)一2021-07-0211页