- 329.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
温馨提示:
此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。
题组训练过关
脂肪烃的结构和性质
1.鉴别甲烷、乙烯、乙炔三种气体可采用的方法是 ( )
A.通入溴水中,观察溴水是否褪色
B.通入酸化的高锰酸钾溶液中,观察颜色是否变化
C.点燃,检验燃烧产物
D.点燃,观察火焰明亮程度及产生黑烟量的多少
【解析】选D。乙烯和乙炔均可以使溴水和酸性高锰酸钾溶液褪色,故A、B项错;三者均属于烃类物质,因此燃烧的产物均为CO2和H2O,故无法从产物中鉴别,C项错;由于它们三者中碳的百分含量有着显著的差别,故燃烧时产生的烟是不同的,甲烷为明亮火焰,无黑烟;乙烯为黑烟;乙炔为浓烟,D项正确。
2.β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有 ( )
A.2种 B.3种 C.4种 D.6种
【解析】选C。因分子存在三种不同的碳碳双键,如图所示;1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,
也可以在①③位置上发生加成或在②③位置上发生加成,还可以1分子Br2在①②发生1,4-加成反应,另1分子Br2在③上加成,故所得产物共有4种。
【归纳提升】
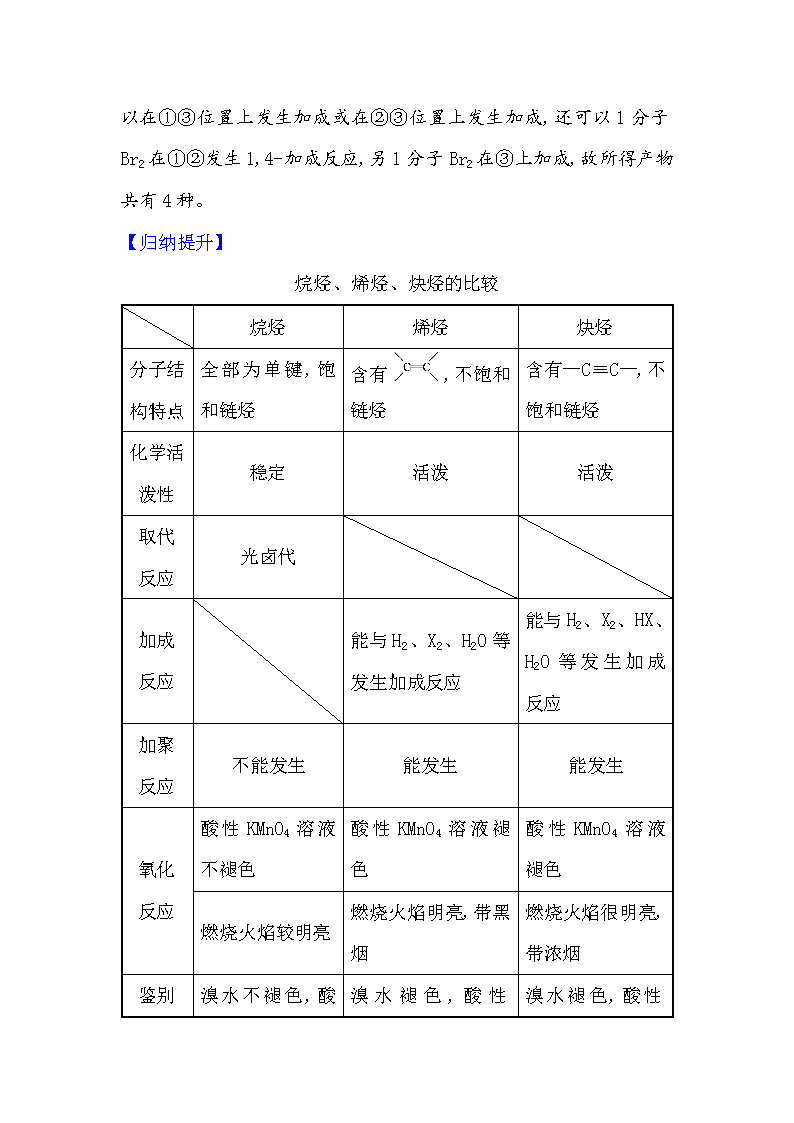
烷烃、烯烃、炔烃的比较
烷烃
烯烃
炔烃
分子结
构特点
全部为单键,饱和链烃
含有,不饱和链烃
含有—C≡C—,不饱和链烃
化学活
泼性
稳定
活泼
活泼
取代
反应
光卤代
加成
反应
能与H2、X2、H2O等发生加成反应
能与H2、X2、HX、H2O等发生加成反应
加聚
反应
不能发生
能发生
能发生
氧化
反应
酸性KMnO4溶液不褪色
酸性KMnO4溶液褪色
酸性KMnO4溶液褪色
燃烧火焰较明亮
燃烧火焰明亮,带黑烟
燃烧火焰很明亮,带浓烟
鉴别
溴水不褪色,
溴水褪色,酸性
溴水褪色,酸性
酸性KMnO4溶液不褪色
KMnO4溶液褪色
KMnO4溶液褪色
乙烯和乙炔的制备及性质实验
3.(2020·九江模拟)实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2-二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化产生CO2、SO2,进而与Br2反应生成HBr等酸性气体。
已知:CH3CH2OHCH2=CH2↑+H2O。
(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插入A中,D接A②;A③接________接________接________接________。
(2)装置C的作用是________________________________________________。
(3)装置F中盛有10% NaOH溶液的作用是 ____________________________。
(4)在反应管E中进行的主要反应的化学方程式为
_____________________。
(5)处理上述实验后三颈烧瓶中废液的正确方法是______________________。
A.废液经冷却后倒入下水道中
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入空废液缸中
【解析】(1)乙醇与浓硫酸在170 ℃制取乙烯,由于浓硫酸有氧化性,而乙醇有还原性,二者容易发生氧化还原反应产生SO2、CO2酸性气体,可以用碱性物质,如NaOH来吸收除去,产生的乙烯与溴水发生加成反应就产生了1,2-二溴乙烷。所以B经A①插入A中,D接A②;A③接C接F接E接G。(2)装置C的作用是作安全瓶,防止装置内压强太大而发生危险。(3)装置F中盛有10% NaOH溶液的作用是除CO2、SO2等酸性气体。(4)在反应管E中进行的主要反应的化学方程式为
CH2=CH2+Br2CH2Br—CH2Br。(5)A中方法会污染地下水,C中方法可能导致瓶中废液暴沸而喷出伤人,因为瓶中还残留较多浓硫酸。
答案:(1)C F E G (2)作安全瓶
(3)除CO2、SO2等酸性气体
(4)CH2=CH2+Br2CH2Br—CH2Br (5)B
4.电石中的碳化钙和水能完全反应:
CaC2+2H2OC2H2↑+Ca(OH)2
使反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置:
序号
1
2
3
4
5
6
导管及
仪器
每个橡皮塞上都打了两个孔
如果所制气体流向为从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是( )接( )接( )接( )接( )接( )。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不产生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是________。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有________杂质。
(4)若实验时称取的电石为1.60 g,测量排出水的体积后,折算成标准状况,乙炔的体积为448毫升,此电石中碳化钙的质量分数是________。
【解析】(1)装置6与3是气体发生装置,然后应通过导气管1
连接贮水瓶5,被挤压出的水应通过导管2流向仪器4。
(2)操作步骤一般有检查气密性—装药品—发生反应—测量气体体积—关闭仪器。
(3)若电石中混有能与水反应且产生气体的杂质,则会使测定结果偏大。
(4)水的体积即是C2H2的体积,再利用关系式:CaC2~C2H2,即可求出CaC2的物质的量及质量。
答案:(1)6 3 1 5 2 4
(2)②①③⑤④
(3)其他可与水反应产生气体的
(4)80%
【归纳提升】
乙炔性质验证的实验方法
装置①发生的反应为CaC2+2H2OCa(OH)2+C2H2↑。
装置②中CuSO4溶液的作用:除去杂质,如CuSO4+H2SCuS↓+H2SO4。
装置③中酸性KMnO4溶液褪色,证明乙炔能发生氧化反应。
装置④中溴的四氯化碳溶液褪色,反应为CH≡CH+2Br2CHBr2CHBr2,证明乙炔能发生加成反应。
装置⑤处现象:有明亮的火焰并有浓烟产生,
证明乙炔可燃且含碳量高。
烃的燃烧规律
5.(原创)气态烷烃A和气态烯烃B,等物质的量时充分燃烧得到相同量的CO2,将二者以一定比例混合。将一定体积的混合气体在氧气中完全燃烧,生成的CO2和水蒸气的体积分别是混合气体体积的2倍和2.4倍(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为 ( )
A.3∶2 B.1∶3 C.2∶3 D.3∶1
【解析】选C。根据阿伏加德罗定律,相同状况下,气体的体积之比等于物质的量之比。可知1 mol混合烃充分燃烧后生成2 mol CO2和2.4 mol H2O,则混合烃的平均分子组成为C2H4.8。又知烷烃和烯烃等物质的量时燃烧所得CO2量相同,即分子里的碳原子数相同,可以判定它们分别是C2H6和C2H4。因此符合题意的烷烃和烯烃的体积比,将由它们分子里所含的H原子个数决定。可用十字交叉法求解:
=。
6.(双选)(2020·上饶模拟改编)下列说法正确的是 ( )
A.某有机物燃烧只生成CO2和H2O,二者物质的量相等,此有机物的组成为CnH2n或CnH2nOx
B.相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳元素的含量越大
C.某气态烃CxHy与足量O2恰好完全反应,
如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;反之,则y<4
D.一定条件,完全燃烧14 g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a) g
【解析】选A、D。某有机物燃烧只生成CO2和H2O,二者物质的量相等,此有机物的组成为CnH2n或CnH2nOx,故A正确;相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中的碳原子的数目大,但含量不一定大,故B错误;燃烧的化学方程式为CxHy+(x+)O2xCO2+H2O,如果反应前后气体体积不变(温度>100℃),则1+x+=x+,y=4;若体积减小,则1+x+>x+,y<4;反之,则y>4,故C错误;C、H元素质量分数之和=1-a,故H元素质量分数=(1-a)×=,生成水的质量为14 g×××18=18(1-a)g,故D正确。
【归纳提升】
烃的燃烧规律
1.等物质的量的烃CxHy完全燃烧时,消耗氧气的量取决于“x+”的值,此值越大,耗氧量越多。
2.等质量的烃完全燃烧时,消耗氧气的量取决于CxHy中的值,此值越大,耗氧量越多。
3.若烃分子的组成中碳、氢原子个数比为1∶2,则完全燃烧后生成的二氧化碳和水的物质的量相等。
4.等质量的且最简式相同的各种烃完全燃烧时其耗氧量、生成的二氧化碳和水的量均相等。
5.气态烃CxHy完全燃烧后生成CO2和H2O:
CxHy+(x+)O2xCO2+H2O
当H2O为气态时(>100℃),1 mol气态烃燃烧前后气体总体积的变化有以下三种情况:
当y=4时,ΔV=0,反应后气体总体积不变,常温常压下呈气态的烃中,只有甲烷、乙烯、丙炔;
当y>4时,ΔV=-1,反应后气体总体积增大;
当y<4时,ΔV=-1,反应后气体总体积减小。
关闭Word文档返回原板块
相关文档
- 化学名师讲练大一轮复习方略人教通2021-07-056页
- 2021版化学名师讲练大一轮复习鲁科2021-07-053页
- 2021版化学名师讲练大一轮复习鲁科2021-07-052页
- 化学名师讲练大一轮复习方略人教通2021-07-052页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0513页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0512页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0520页
- 2021版化学名师讲练大一轮复习鲁科2021-07-056页
- 2021版化学名师讲练大一轮复习鲁科2021-07-052页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0517页