- 2.03 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
共 9 页 第 1 页
江苏省 2020-2021 学年度第一学期新高考质量检测模拟试题
高三化学试题
考生注意:
1.本试卷共 4 页。
2.答卷前,考生务必用蓝、黑色字迹的钢笔或圆珠笔将自己的姓名、班级、学号填写在相
应位置上。
3.本次考试时间 90 分钟,满分 100 分。
4.请在密封线内作答,保持试卷清洁完整。
一、单项选择题(本题包括 10 小题,每小题 2 分,共 20 分。在每小题给出的四个选项中,
只有一项是符合题目要求的。)
1.2019 年政府工作报告提出:继续坚定不移地打好包括污染防治在内的“三大攻坚战”。
下列做法不符合这一要求的是( )
A.推广新能源汽车,减少氮氧化物排放
B.研发可降解塑料,控制白色污染产生
C.直接灌溉工业废水,充分利用水资源
D.施用有机肥料,改善土壤微生物环境
2.下列化学用语表示正确的是( )
A.CO2 的比例模型: B.次氯酸结构式:H—Cl—O
C.NH3 分子的电子式: D.硫离子的结构示意图:
3.下列有关物质性质与用途具有对应关系的是( )
A.晶体硅熔点高硬度大,可用于制造半导体材料
B.碳酸钠溶液显碱性,可用于除去金属器件表面的油脂
C.碳酸氢钠能与碱反应,可用作焙制糕点的膨松剂
D.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
4.常温下,下列各组离子在指定条件下能大量共存的是( )
A.无色溶液中:K+、H+、I-、MnO-
4
B.c(H+)=1×10-3mol·L-1 的溶液中:Cl-、Al3+、NH+
4 、Na+
C.含 Na2S 的水溶液中:H+、NO-
3 、NH+
4 、SO2-
4
D.能使酚酞变红的溶液中:Na+、Cu2+、CO2-
3 、NO-
3
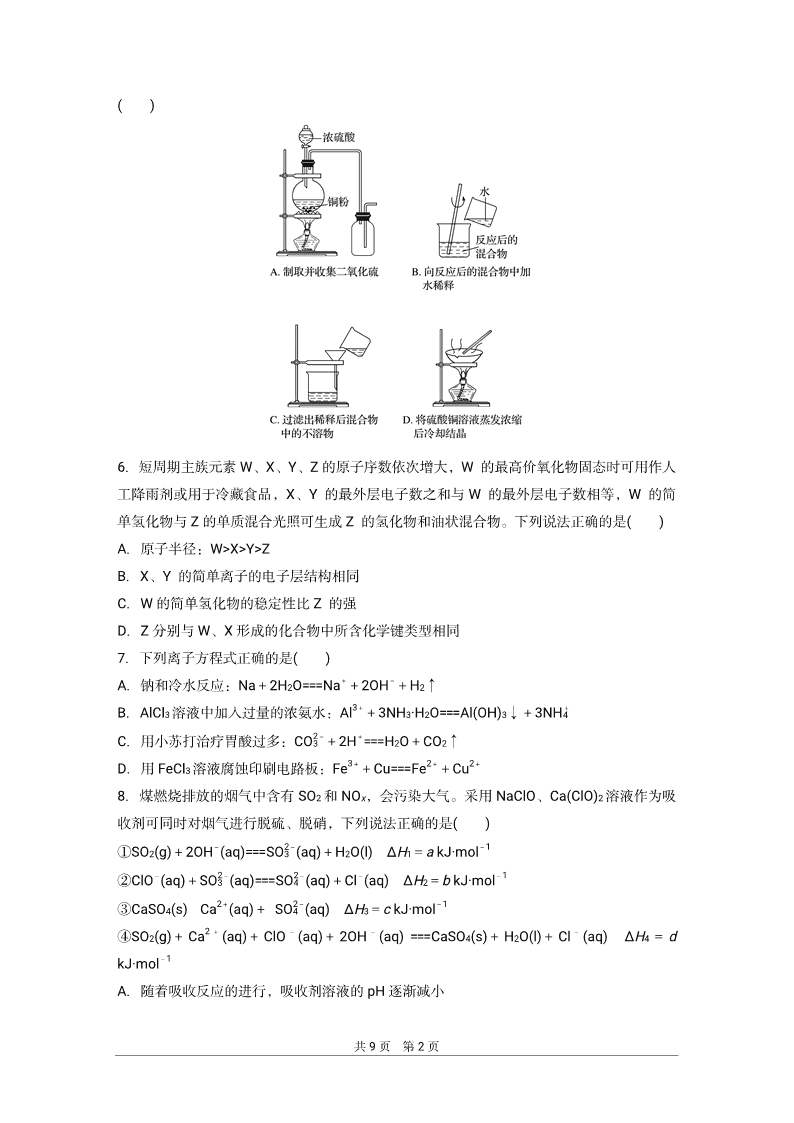
5.下列实验装置用加热铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
共 9 页 第 2 页
( )
6.短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 的最高价氧化物固态时可用作人
工降雨剂或用于冷藏食品,X、Y 的最外层电子数之和与 W 的最外层电子数相等,W 的简
单氢化物与 Z 的单质混合光照可生成 Z 的氢化物和油状混合物。下列说法正确的是( )
A.原子半径:W>X>Y>Z
B.X、Y 的简单离子的电子层结构相同
C.W 的简单氢化物的稳定性比 Z 的强
D.Z 分别与 W、X 形成的化合物中所含化学键类型相同
7.下列离子方程式正确的是( )
A.钠和冷水反应:Na+2H2O===Na++2OH-+H2↑
B.AlCl3 溶液中加入过量的浓氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+
4
C.用小苏打治疗胃酸过多:CO2-
3 +2H+===H2O+CO2↑
D.用 FeCl3 溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
8.煤燃烧排放的烟气中含有 SO2 和 NOx,会污染大气。采用 NaClO、Ca(ClO)2 溶液作为吸
收剂可同时对烟气进行脱硫、脱硝,下列说法正确的是( )
①SO2(g)+2OH-(aq)===SO2-
3 (aq)+H2O(l) ΔH1=a kJ·mol-1
②ClO-(aq)+SO2-
3 (aq)===SO2-
4 (aq)+Cl-(aq) ΔH2=b kJ·mol-1
③CaSO4(s) Ca2+(aq)+ SO2-
4 (aq) ΔH3=c kJ·mol-1
④SO2(g)+ Ca2 + (aq)+ ClO - (aq)+ 2OH - (aq) ===CaSO4(s)+ H2O(l)+ Cl - (aq) ΔH4 = d
kJ·mol-1
A.随着吸收反应的进行,吸收剂溶液的 pH 逐渐减小
共 9 页 第 3 页
B.反应①、②均为氧化还原反应
C.反应 Ca(OH)2(aq)+H2SO4(aq)===CaSO4(s)+2H2O(l)的ΔH=-c kJ·mol-1
D.d=a+b+c
9.在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A.S――→O2
点燃 SO3――→H2O H2SO4
B.Cu―――→稀H2SO4 CuSO4―――→BaNO32 Cu(NO3)2
C.Cu2(OH)2CO3―――→HClaq CuCl2(aq)――→Na Cu(s)
D.饱和 NaCl 溶液――――→NH3、CO2 NaHCO3(s)――→△ Na2CO3(s)
10.下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁
到导带后,然后流向对电极。下列说法不正确的是( )
A.对电极的电极反应式为:2H++2e-===H2↑
B.半导体电极发生还原反应
C.电解质溶液中阳离子向对电极移动
D.整个过程中实现了太阳能→电能→化学能的转化
二、不定项选择题(本题包括 5 小题,每小题 4 分,共 20 分。每小题只有一个或两个选项符
合题意。)
11.根据下图(其他产物未写出)分析,下列说法正确的是( )
A.A 和 B 生成 C 的反应为加成反应
B.C 中所有原子可能在同一平面
C.B 的分子式为 C4H7OBr
D.C 中苯环上的二氯代物只有两种
12.电石(主要成分为 CaC2)是重要的基本化工原料。已知 2 000 ℃时,电石生产原理如下:
①CaO(s)+C(s)===Ca(g)+CO(g)
ΔH1=a kJ·mol-1 平衡常数 K1
共 9 页 第 4 页
②Ca(g)+2C(s)===CaC2(s)
ΔH2=b kJ·mol-1 平衡常数 K2
以下说法不正确的是( )
A.反应①K1=c(Ca)·c(CO)
B.反应1
2Ca(g)+C(s)===1
2CaC2(s)平衡常数 K= K2
C.2 000 ℃时增大压强,K1 减小,K2 增大
D.反应 2CaO(s)+CaC2(s)===3Ca(g)+2CO(g) ΔH=(2a-b)kJ·mol-1
13.将 5 mL 0.005 mol·L-1FeCl3 溶液和 5 mL 0.015 mol·L-1KSCN 溶液混合。达到平衡后溶
液呈红色。再将混合液等分为 5 份,分别进行如下实验:
实验①:滴加 4 滴水,振荡
实验②:滴加 4 滴饱和 FeCl3 溶液,振荡
实验③:滴加 4 滴 1 mol·L-1 KCl 溶液,振荡
实验④:滴加 4 滴 1 mol·L-1 KSCN 溶液,振荡
实验⑤:滴加 4 滴 6 mol·L-1 NaOH 溶液,振荡
下列说法不正确的是( )
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加生成物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
14.常温下,Ka(CH3COOH)=1.75×10-5,Ka(HCN)=6.2×10-10,下列说法正确的是( )
A.0.1 mol·L-1CH3COONa 溶液与 0.1 mol·L-1KCN 溶液:c(Na+)-c(CH3COO-)>c(K+)-c(CN
-)
B.20 mL 0.1 mol·L-1CH3COONa 与 10 mL 0.1 mol·L-1HCl 溶液混合后所得酸性溶液:c(Na
+)
>c(CH3COOH)>c(CH3COO-)
C.0.2 mol·L-1HCN 溶液与 0.1 mol·L-1NaOH 溶液等体积混合所得溶液:c(Na+)>c(CN-)>c(OH-)
>c(H+)
D.向浓度均为 0.1 mol·L-1 的 CH3COOH 和 HCN 混合溶液中滴加 0.1 mol·L-1NaOH 溶液,
当恰好中和时所得溶液:c(CH3COOH)+c(HCN)+c(H+)=c(OH-)
15 . 利 用 CO 和 H2 在 催 化 剂 的 作 用 下 合 成 甲 醇 , 发 生 的 反 应 如 下 : CO(g)+
2H2(g)===CH3OH(g)。在体积一定的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,测得
平衡混合物中 CH3OH 的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
共 9 页 第 5 页
( )
A.该反应的ΔH<0,且 p1<p2
B.反应速率:v 逆(状态 A)Al>Cl>C,故 A 错误;Na+、Al3+ 的电子层结构相同,故 B 正确;HCl
的稳定性比 CH4 的强,故 C 错误;CCl4 中含有共价键、NaCl 中含有离子键,故 D 错误。]
7.B [钠和冷水反应生成氢氧化钠和氢气,即 2Na+2H2O===2Na++2OH-+H2↑,A 错误;
AlCl3 溶液中加入过量的浓氨水生成氢氧化铝和氯化铵,即 Al3++3NH3·H2O===Al(OH)3↓+
3NH+
4 ,B 正确;用小苏打治疗胃酸过多,则离子方程式为 HCO-
3 +H+===H2O+CO2↑,C 错
误;用 FeCl3 溶液腐蚀印刷电路板,离子方程式为 2Fe3++Cu===2Fe2++Cu2+,D 错误。]
8.A [由反应①和④可知,随着吸收反应的进行,不断消耗 OH-,因此导致吸收剂溶液的
pH 逐渐减小,A 正确;反应①没有发生化合价的变化,不是氧化还原反应,B 错误;反应
Ca(OH)2(aq)+H2SO4(aq)===CaSO4(s)+2H2O(l)的离子方程式为:Ca2++ SO2-
4 +2OH-+2H
+ CaSO4↓ +2H2O,该离子反应不是反应③的逆反应,因此ΔH≠-c kJ·mol-1,C 错误;
共 9 页 第 11 页
根据盖斯定律可知④=①+②-③,所以 d=a+b-c,D 错误。]
9.D [A 项,S 与 O2 反应只能生成 SO2,错误;C 项,Na 与 CuCl2 溶液反应时,Na 先与水
反应生成 NaOH,而不是钠置换出 Cu,错误;D 项,为侯氏制碱法,正确。]
10.B [由图示分析可以知道在对电极上发生的反应是水电离出的氢离子得到电子生成氢
气,电极反应为: 2H++2e-===H2↑,A 正确;在光照下,电子(e-)由价带跃迁到导带后,
然后流向对电极,所以半导体电极为负极,发生氧化反应,B 错误;阳离子向阴极移动,对
电极为阴极,因此电解质溶液中阳离子向对电极移动,C 正确;由分析可以知道,该装置是
光能转化为电能,电能转化为化学能的过程,整个过程中实现了太阳能→电能→化学能的转
化,D 正确。]
11.D [A 和 B 生成 C 的反应为取代反应,故 A 错误;C 中含有甲基,所有原子不可能在同
一平面,故 B 错误;B 的分子式为 C3H5OBr,故 C 错误;C 中苯环上有两种不同的氢原子,
所以苯环上的二氯代物只有两种,故 D 正确。]
12.C [平衡常数只与温度有关系,2 000 ℃时增大压强,K1、K2 均不变,C 错误;根据盖斯
定律可知①×2-②即得到反应 2CaO(s)+CaC2(s)===3Ca(g)+2CO(g) ΔH=(2a-b)kJ·mol
-1,D 正确。]
13.B [实验②与实验①对比,只改变了 Fe3+浓度,故 A 说法正确;FeCl3 溶液和 KSCN 溶
液反应的实质是 Fe3++3SCN- Fe(SCN)3,改变钾离子或氯离子的浓度对平衡无影响,故 B
说法错误;实验④与实验①对比,只改变了 SCN-浓度,故 C 说法正确;在原平衡体系中加
入 NaOH 溶液,Fe3+与之反应生成氢氧化铁沉淀,溶液中 Fe3+的浓度减小,故 D 说法正确。]
14.CD [0.1 mol·L-1CH3COONa 溶液中电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH
-),因此 c(Na+)-c(CH3COO-)=c(OH-)-c(H+);0.1 mol·L-1KCN 溶液中电荷守恒为:c(K+)
+
c(H+)=c(CN-)+c(OH-),因此 c(K+)-c(CN-)=c(OH-)-c(H+);因为 Ka(CH3COOH)>
Ka(HCN),所以酸性 CH3COOH 强于 HCN,根据盐类水解规律,0.1 mol·L-1CH3COONa 溶液
的碱性弱于 0.1 mol·L-1KCN 溶液的碱性,因此 c(Na+)-c(CH3COO-)c(CN-)>c(OH-)>c(H+),C 正确;向浓度均为
共 9 页 第 12 页
0.1 mol·L - 1 的 CH3COOH 和 HCN 混合溶液中滴加 0.1 mol·L - 1NaOH 溶液,反应生成
CH3COONa 和 NaCN,当恰好中和时 CH3COONa 和 NaCN 的物质的量浓度相等,
由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CN-),由物料守恒可知:c(Na
+)=c(CH3COO-)+c(CH3COOH)+c(CN-)+c(HCN),二者联立可得 c(CH3COOH)+c(HCN)
+c(H+)=c(OH-),D 正确。]
15.BC [A 项,由图可知,升高温度,CH3OH 的体积分数减小,平衡逆向移动,则该反应
的ΔH<0,300 ℃时,增大压强,平衡正向移动,CH3OH 的体积分数增大,所以 p1>p2,错
误;B 项,B 点对应的温度和压强均大于 A 点,温度升高、增大压强均使该反应的化学反应
速率加快,因此 v 逆(状态 A)<v 逆(状态 B),正确;C 项,设向密闭容器中充入了 1 mol CO 和
2 mol H2,CO 的转化率为α,则
CO(g)+2H2(g) CH3OH(g)
起始/mol 1 2 0
变化/mol α 2α α
平衡/mol 1-α 2-2α α
在 C 点时,CH3OH 的体积分数= α
1-α+2-2α+α=0.5,解得α=0.75,正确;D 项,由等
效平衡可知,在恒温恒压条件下向密闭容器中充入不同量的 CH3OH,达平衡时 CH3OH 的体
积分数都相同,错误。]
16.(1)2NH+
4 +3O2===2NO-
2 +2H2O+4H+
(2)①节省进一步氧化所需的耗氧量,同时减少了反硝化反应中加入的碳源(甲醇)
②硝化产生的酸和反硝化产生的碱中和,减少了 NaHCO3 的投加
③NH+
4 +NO-
2 ===N2↑+2H2O 不需要,NH+
4 和 NO-
2 正好反应完全
(3)O2 不足,NH+
4 未被完全氧化为 NO-
2 ,N 元素被氧化为 N2O
解析 (2)①该工艺将硝化过程中的产物控制在 NO-
2 阶段,防止生成 NO-
3 ,从而减少进一步
氧化所需的耗氧量,并且能减少碳源(甲醇)的消耗。②将硝化阶段和反硝化阶段放在同一个
反应器中进行,能将硝化过程中的产物控制在 NO-
2 阶段,可以使硝化产生的酸和反硝化产生
的碱发生中和反应,从而减少 NaHCO3 的消耗。③在无氧气的环境下,NH+
4 与 NO-
2 反应生成
N2 和 H2O,反应的离子方程式:NH+
4 +NO-
2 ===N2↑+2H2O,由于 NH+
4 和 NO-
2 恰好完全反应,
所以不需要进一步消耗碳源。
(3)当 O2 不足时,NH+
4 未被完全氧化为 NO-
2 ,N 元素由-3 价升高到+1 价,从而导致 N2O
的生成。
17.(1)羰基、羧基 (2)还原反应
(3)
共 9 页 第 13 页
(4)
(5) ―――→Mg
无水乙醚 ――→CrO3
――→浓H2SO4
△
解析 (3)C 的分子式为 C10H12O2,由 和 可知 C
的结构简式为: 。
(4)①属于芳香族化合物,说明含有苯环,②不能与金属钠反应,说明不含有羟基,③有 3 种
不同化学环境的氢原子,说明有三种位置不同的氢原子,符合这三个条件的 J 的同分异构体
为: 。
(5) 在无水乙醚和 Mg 的条件下生成 , 和 、H2O 反
应生成 , 被 CrO3 氧化为 ,根据已
知 条 件 与 、 H2O 生 成 ,
在 浓 硫 酸 、 加 热 的 条 件 下 发 生 消 去 反 应 生 成
。
18.(1)0.5 mol (2)H2C2O4+H2O2===2CO2↑+2H2O
(3)消耗 KMnO4 的物质的量为 0.100 0 mol·L-1×0.024 L=0.002 4 mol,
依据化学方程式:5C2O2-
4 +2MnO-
4 +16H+===2Mn2++8H2O+10CO2↑,
可知:n(C2O2-
4 )=(0.002 4 mol÷2) ×5=0.006 mol。
250 mL 原溶液中 C2O2-
4 的物质的量为 0.006 mol×10=0.06 mol,
共 9 页 第 14 页
则 n(K3[Fe(C2O4)3])=0.06 mol×1
3=0.02 mol。
9.820 g 三草酸合铁酸钾晶体中结晶水的质量为 9.820 g-437 g·mol-1×0.02 mol=1.08 g,
则 n(H2O)=
1.08 g
18 g·mol-1
=0.06 mol。
综上所述,该晶体的化学式为 K3Fe(C2O4)3·3H2O。
解析 (1)根据反应:6FeC2O4+3H2O2+6K2C2O4===4K3[Fe(C2O4)3]+2Fe(OH)3 和 2Fe(OH)3
+3K2C2O4+3H2C2O4===2K3[Fe(C2O4)3]+6H2O 得关系式:3H2O2~6K3[Fe(C2O4)3],则制备 1
mol 三草酸合铁酸钾至少需要 H2O2 的物质的量为 0.5 mol。
19.(1)4Fe(CrO2)2+7O2+8Na2CO3=====高温 2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与
Na2CO3 反应
(2)pH 计 (3)沿玻璃棒加水至浸没沉淀,待水自然流出后重复 2~3 次
(4)将重铬酸钠还原为氢氧化铬
(5)向 Na2Cr2O7 溶液中加入适量 NaOH 调节 pH 大于 3.7,过滤,向滤液中加入硫酸溶液至
pH 小于 3.0,再加入适量 KCl 固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
解析 (1)根据流程图可知高温下碳酸钠、氧气与 Fe(CrO2)2 反应转化为 Na2CrO4 的化学方程
式为 4Fe(CrO2)2+7O2+8Na2CO3=====高温 2Fe2O3+8Na2CrO4+8CO2。由于陶瓷在高温下会与
Na2CO3 反应,所以焙烧时不能使用陶瓷容器。(2)要精确测定溶液的 pH,应该选择 pH 计。
(4)硫离子具有还原性,则 Na2S 的作用除了调节溶液的酸碱度外,还有将重铬酸钠还原为氢
氧化铬的作用。
20.(1)①Al2O3+6H+===2Al3++3H2O ②生成的 CaSO4 覆盖在固体反应物表面,阻止铁、
铝氧化物的溶解
(2)Fe3+完全沉淀与 Al3+开始沉淀的 pH 相近
(3)①增大 FeSO4 溶液的浓度,有利于使吸收 NO 的平衡向正反应方向移动(或增大氧气含量,
有利于 NO 与 O2、H2O 反应转化为 HNO3 等被吸收或减缓通入气体的速率,增大气液接触时
间)(答案合理即可) ②C6H12O6+6[Fe(NO)2]2+=====微生物 6Fe2++ 6N2↑+ 6CO2↑+6H2O
(4)①阴 ②增大阳极熔融物的密度
解析 (1)②硫酸钙微溶于水。当硫酸质量分数大于 50%时,生成的硫酸钙覆盖在固体反应物
表面,阻止铁、铝氧化物的溶解,使得金属氧化物浸出率明显下降。
(2)根据金属离子以氢氧化物沉淀时离子浓度随 pH 变化图像知,Fe3+完全沉淀与 Al3+开始沉
淀的 pH 相近,导致浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差。
(3)①FeSO4 溶液吸收 NO 的原理为 Fe2++2NO [Fe(NO)2]2+,为提高烟气中 NO 的吸收率,
可采取的措施有增大 FeSO4 溶液的浓度,有利于使吸收 NO 的平衡向正反应方向移动;根据
烟气中 O2 的体积分数对 NO 吸收率的影响图像,可以增大氧气含量,有利于 NO 与 O2、H2O
共 9 页 第 15 页
反应转化为 HNO3 等被吸收;也可以减缓通入气体的速率,增大气液接触时间。 (4)①根据
电解目的,要将粗铝通过电解得到高纯铝,需要将粗铝作阳极,高纯铝作阴极,该装置工作
时,电极 A 作阴极。②熔融粗铝时加入铜可以增大阳极熔融物的密度,使之在最下层。
21.(1) O>C>Li
(2)不相同 正四面体
(3)1 LiC2 (4)面心立方最密堆积 LiB6H6
a
2
解析 (2)H3PO4 中 P 原子的杂化轨道数是 4,P 原子的杂化方式是 sp3,H2CO3 中 C 原子的
杂化轨道数是 3,C 原子的杂化方式是 sp2,杂化方式不同;PO3-
4 中 P 原子的杂化轨道数是 4,
无孤电子对,所以 PO3-
4 立体构型为正四面体。(3)根据均摊原则,每个碳环实际占用 2 个碳
原子,每个锂离子占用碳环是 1+6×1
3=3,石墨嵌入化合物的 Li、C 原子数比为 1∶6,所
以 LixC6 中 x=1;若每个六元环都对应一个 Li+,则石墨嵌入化合物的 Li、C 原子数比为 1∶2,
所以化学式是 LiC2。(4)根据阴离子在晶胞中位置图,阴离子在晶胞顶点和面心,所以堆积方
式为面心立方最密堆积;根据“均摊法”,阴离子数 8×1
8+6×1
2=4,Li+占据阴离子组成的
所有正四面体中心,晶胞中共 8 个锂离子,故该化合物的化学式 LiB6H6;根据晶胞结构,晶
胞边长为 a nm,Li+占据阴离子组成的所有正四面体中心,晶胞边长为 a nm,所以两个最近
的 Li+的距离为相邻的两个正四面体的体心间距(或两个八分之一晶胞立方的体心间距),是晶
胞边长的一半,即a
2 nm。
相关文档
- 2018-2019学年江苏省扬州中学高一2021-07-056页
- 2017-2018学年江苏省苏州市高二下2021-07-0512页
- 【化学】西藏自治区林芝市第二高级2021-07-059页
- 2017-2018学年江苏省东台市创新学2021-07-057页
- 化学(选修)卷·2019届江苏省东台市创2021-07-057页
- 2017-2018学年江苏省徐州五中高二2021-07-058页
- 2017-2018学年江苏省泰州中学高二2021-07-0518页
- 江苏省连云港市赣榆区2020届高三化2021-07-0511页
- 陕西省咸阳市武功县2020届高三上学2021-07-0523页
- 江苏省扬州中学2020届高三上学期112021-07-0512页