- 400.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
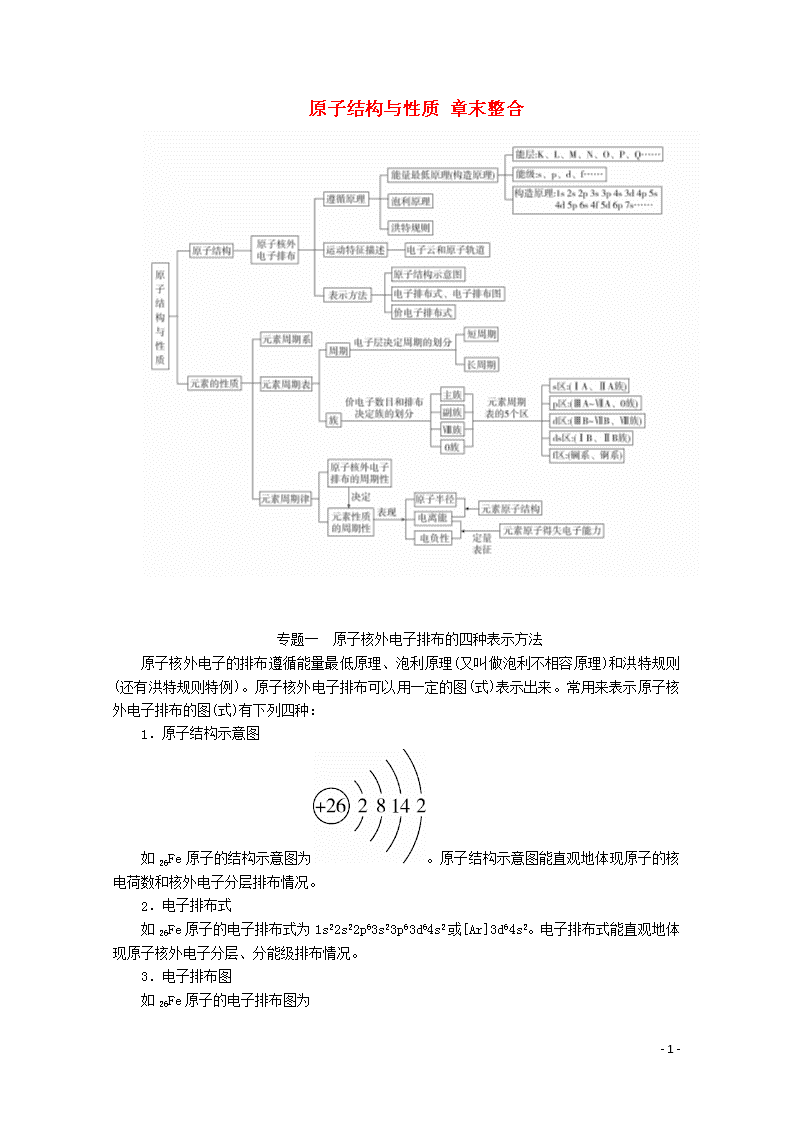
原子结构与性质 章末整合
专题一 原子核外电子排布的四种表示方法
原子核外电子的排布遵循能量最低原理、泡利原理(又叫做泡利不相容原理)和洪特规则(还有洪特规则特例)。原子核外电子排布可以用一定的图(式)表示出来。常用来表示原子核外电子排布的图(式)有下列四种:
1.原子结构示意图
如26Fe原子的结构示意图为。原子结构示意图能直观地体现原子的核电荷数和核外电子分层排布情况。
2.电子排布式
如26Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。电子排布式能直观地体现原子核外电子分层、分能级排布情况。
3.电子排布图
如26Fe原子的电子排布图为
- 2 -
。电子排布图能直观
地体现原子核外电子分层、分能级、分轨道排布情况以及电子的自旋状态。
4.价电子排布式
价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。如26Fe的电子排布式为
1s22s22p63s23p63d64s2,价电子排布式为3d64s2。
综上所述可知,对原子核外电子排布表达的具体化程度最低的是原子结构示意图,最高的是电子排布图。对这些图(式)的应用,要根据实际需要适当选择。同时要注意将这些图(式)应用于表示与某原子相对应的离子的核外电子排布。
专题二 元素金属性、非金属性强弱的比较方法
- 2 -
相关文档
- 2020届高考化学一轮复习原子结构与2021-07-0522页
- 2020届一轮复习人教通用版第36讲原2021-07-057页
- 2020版高考化学一轮复习原子结构与2021-07-0514页
- 2019届一轮复习人教版原子结构与性2021-07-057页
- 2019届高考化学二轮复习原子结构与2021-07-0519页
- 2018届高考二轮复习人教版第十七讲2021-07-055页
- 2019届高考化学二轮复习原子结构与2021-07-057页
- 2019届一轮复习人教版原子结构与性2021-07-0525页
- 2021高三化学人教版一轮学案:第十一2021-07-0531页
- 2020届一轮复习人教通用版第32讲原2021-07-0510页