- 781.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
乙醇俗称酒精
跟我们日常生活密切联系
《
乙 醇
》
主菜单
知识总结
化学性质
乙醇结构
乙醇用途
结束退出
物理性质
乙醇制法
启迪思考
精选练习
课件制作
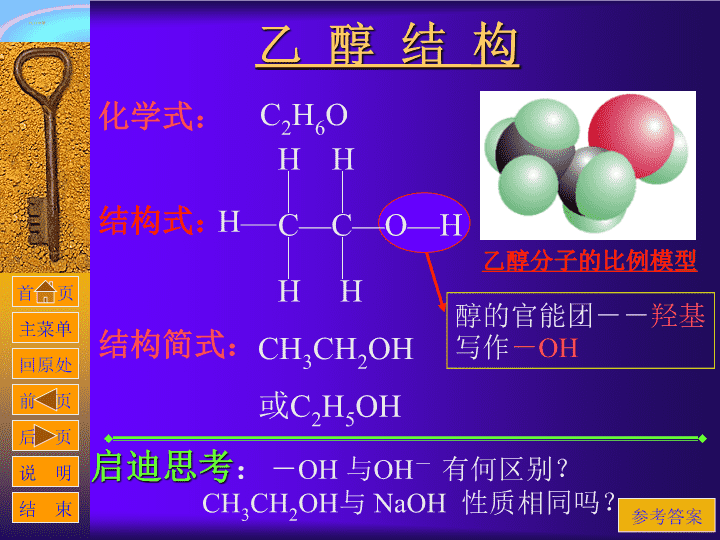
C—C—O—H
H
H
H
H
H
结构式:
CH
3
CH
2
OH
或C
2
H
5
OH
醇的官能团--
羟基
写作
-
OH
乙醇分子的比例模型
化学式:
启迪思考
:
-
OH
与
OH
-
有何区别?
CH
3
CH
2
OH
与
NaOH
性质相同吗?
乙 醇 结 构
C
2
H
6
O
结构简式:
参考答案
让
我
好好想想
???
物 理 性 质
颜 色 :
气 味 :
状 态:
密 度
:
溶解性:
挥发性:
无色
透明
特殊香味
液体
比水小
20
0
C
时的密度是
0.7893g/cm
3
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发
乙醇俗称
酒精
启迪思考
:
如何分离水和酒精?
工业上如何制取无水的乙醇?
参考答案
酒的
知识
化 学 性 质
结构与性质分析
与金属反应
与氢卤酸反应
氧化反应
脱水反应
化 学 性 质
结构与性质分析
C—C—O—H
H
H
H
H
H
官能团--
羟基(-
OH
)
-
C
原子
-
C
原子
乙醇分子是由乙基(
—C
2
H
5
)
和羟基(
—OH
)
组成的,羟基比较活泼,它决定着乙醇的主要性质。在处均可断键反应。
在后面的化学性质中要注意是在哪里断键的。
①
②
④
③
化 学 性 质
2C
2
H
5
OH+2Na 2C
2
H
5
ONa+H
2
与金属反应
(演示实验同时做钠与水反应比较实验)
分析
:
乙醇跟金属钠反应,生成乙醇钠,并放出氢气。与水跟金属钠的反应相比,乙醇跟钠的反应要缓和得多。 其它活泼金属如
钾、镁、铝
等也能够把乙醇的羟基里的氢取代出来。
乙醇分子可以看作是水分子里的一个氢原子被乙基所取代的产物,但乙醇在水溶液里比水还难于电离。
启迪思考
:
试比较
乙醇和 水的酸性强弱
?
能否通过此反应测定有机物的羟基数目?
参考答案
化 学 性 质
与氢卤酸反应
乙醇可与氢卤酸发生作用,反应时乙醇分子里的羟基键断裂,卤素原子取代了羟基的位置而生成卤代烃,同时生成水。
C—C—H
H
H
H
H
O—H
C
2
H
5
Br+H
2
O
C
2
H
5
OH+H Br
溴乙烷
羟基被取代
启迪思考
:
上述反应是什么类型反应?
若将乙醇、食盐、浓硫酸
(1
:
1)
混合加热时,反应中硫酸的作用是什么?有关反应是什么?
参考答案
化 学 性 质
氧化反应
:(一)
乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。
因此:
乙醇可用作内燃机的燃料,实验
室里也常用它作为燃料。
启迪思考
:
在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。 得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应。
乙醇被氧化成别的物质呢?
且
看下
页
分解
2CO
2
+3H
2
O
+
热
C
2
H
5
OH + 3 O
2
点燃
分析:
乙醇在加热和有催化剂(
Cu
或
Ag
)
存在的条件下,能够被空气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。
化 学 性 质
氧化反应
:(二)
演示实验
:
将热铜丝插入乙醇中,反复多次,闻液体气味变化 。
现象:
气味变成刺激性气味。
2CH
3
CH
2
OH + O
2
2CH
3
CHO + 2H
2
O
催化剂
C—C—H
H
H
H
H
O—H
--C
被氧化还原
两个氢脱去与
O
结合成水
启迪思考
:
当
--C
上
没有氢或只有一个氢的情况又如何氧化呢?
提示
化 学 性 质
脱水反应--(分子内脱水)
乙醇和浓硫酸加热到
170℃
左右,每一个乙醇分子会脱去一个水分子而生成乙烯。
实验室里可以用这个方法制取乙烯。
浓
H
2
SO
4
170
0
C
H C C H CH
2
=CH
2
+H
2
O
H
H
H
OH
实验
:
如图(乙醇与浓硫酸混合加热)
羟基和氢
脱去
结合成水
分子内脱水--制乙烯:
像乙醇的分子内脱水反应:
有机化合物在适当的条件下,由一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或叁键)化合物的反应,叫做
消去反应
。
化 学 性 质
C—C—H
H
H
H
H
O—H
消去(脱水)
- -
启迪思考
:
能发生消去反应的醇的分子结构特点是什么?
是不是所有的醇都能发生消去反应?
我要看
答案
乙醇能脱水主要是由于乙醇分子里含有羟基。如果反应条件(例如温度)不同,乙醇脱水的方式也不同,以致生成物也不同。例如乙醇和浓硫酸共热到
140℃
左右,那么每两个乙醇分子间会脱去一个水分子而生成乙醚。
脱水反应--(分子间脱水)
2CH
3
CH
2
OH CH
3
CH
2
OCH
3
CH
2
+ H
2
O
浓
H
2
SO
4
140
0
C
化 学 性 质
启迪思考
:
通过分子内脱水反应和分子间脱水反应,试比较这两个反应的异同点,有什么心得?
参考提示
所以,我们可以根据物质的化学性质,按照实际需要,控制
反应条件
,使化学反应朝着我们所需要的方向进行。
学以致用
乙 醇 用 途
乙醇有相当广泛的用途:
用作燃料,如酒精灯等
制造饮料和香精外,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树脂,制造涂料。
医疗上常用
75
%(体积分数)的酒精作消毒剂。
乙 醇 制 法
1
、发酵法
发酵法是制取乙醇的一种重要方法,所用原料是含糖类很丰富的各种农产品,如高梁、玉米、薯类以及多种野生的果实等,也常利用废糖蜜。这些物质经过发酵,再进行分馏,可以得到
95
%(质量分数)的乙醇。
2
、乙烯水化法
以石油裂解产生的乙烯为原料,在加热、加压和有催化剂(硫酸或磷酸) 存在的条件下,使乙烯跟水反应,生成乙醇。这种方法叫做乙烯水化法。用乙烯水化法生产乙醇,成本低,产量大,能节约大量粮食,所以随着石油化工的发展,这种方法发展很快。
CH
2
=CH
2
+H
2
O CH
3
CH
2
OH
催化剂
加热加压
知 识 总 结
乙醇结构:化学式、结构式和结构简式
官能团与性质关系。
物理性质:色、味、态、溶解度和挥发性
化学性质
: (1)
与活泼金属反应
(1)
与氢卤酸反应
(1)
氧化反应--燃烧与制醛
(1)
脱水反应--分子内脱水
--
分子间脱水
乙醇用途:
乙醇制法:发酵法和乙烯水化法
3
、如何分离水和酒精?
4
、工业上如何制取无水的乙醇?
参考
:
由于水和酒精是互溶的,所以通常用蒸馏的方法分离水和酒精。
参考
:
先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。
启 迪 思 考 题
5
、试比较
乙醇和 水的酸性强弱
?
6
、能否通过此反应测定有机物的羟基数目?
参考
:
乙醇和水都呈中性,但水中能电离出
H
+
离子,而乙醇则不能。
参考
:
能。
让钠与醇反应,通过钠与醇的物质的量作比较则可有结果。
启 迪 思 考 题
7
、乙醇与氢卤酸的反应是什么类型反应?
8
、 若将乙醇、食盐、浓硫酸
(1
:
1)
混合加热时,
反应中硫酸的作用是什么?有关反应是什么?
参考
:
是个取代反应。可看作是卤素原子取代了乙醇中的羟基(-
OH
)。
参考
:
硫酸是作为反应物制氢卤酸。
C
2
H
5
OH +
HCl
C
2
H
5
Cl + H
2
O
NaCl
+ H
2
SO
4
NaHSO
4
+
HCl
启 迪 思 考 题
参考
:
与-
OH
相连
的碳原子必须有
H
才能被氧化。
9
、当
-
C
上氢原子数目与醇的氧化有何关系?
C—C—H
H
H
H
H
O—H
--C
被氧化还原
两个氢脱去与
O
结合成水
①
在
--C
碳上有
2
个
H
时
②
在
--C
碳
上只有
1
个
H
时
做
练习
一
启 迪 思 考 题
RCH O RCH=O
H
H
Cu
~300
0
C
生成醛
C O C=O
R
R
R
R
H
H
Cu
~300
0
C
生成酮
参考
:
能发生消去反应的条件有:
①
连有-
OH
的碳原子周围有碳原子。
如
CH
3
OH
则
不能发生消去反应。
11
、能发生消去反应的醇的分子结构特点是什
么? 是不是所有的醇都能发生消去反应?
CH
3
CH
3
CH
3
C—C—H
H
O—H
②
与连有-
OH
的碳原子
相邻的碳原子上有氢
原子。如右物质则不
能发生消去反应。
启 迪 思 考 题
参考
:
它们都是脱去一个水分子;
不同的是:分子内脱水反应属于消去反应,而分子间反应属于取代反应;反应条件也不同。
所以,我们可以根据物质的化学性质,按照实际需要,控制反应条件,使化学反应朝着我们所需要的方向进行。
12
、通过分子内脱水反应和分子间脱水反应,
试比较这两个反应的异同点,有什么心得?
启 迪 思 考 题
练 习 题
C—C—O—H
H
H
H
H
H
①
②
④
③
1
:
与钠反应时在何处断键。
A: ①
2
:
发生消去反应时在何处断键。
A: ① ④
B: ②
B: ① ③
C: ③
C: ② ④
D:
④
D: ② ④
练 习 题
3
、
把质量为
m g
的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为
m g
的是:
A
:
稀硫酸
B
:
酒 精
C
: 稀
硝酸
D: CO
4
、
能用来检验酒精中是否含有水的试剂是:
A: CuSO
4
·
·
5H
2
O
B
:
无水硫酸铜
C
:
浓
硫酸
D
:
金属钠
5
、
相同质量的下列醇,与足量钠反应放出氢气最多的是:
A
:
甲 醇
B
:
乙 醇
C
:
乙二醇
D
:
甘 油
练 习 题
6
、
在下列物质中加入溴水数滴,振荡,溴水
不褪色的是:
A
:
浓硫酸
B
:浓
NaOH
溶液
C
: 碱
石灰
D
:
无水氯化钙
7
、
酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是:
A
:
NaOH
溶液
B
:
酒 精
C
:
SO
2
溶液
D
:
氢硫酸溶液
乙醚是醚类中最重要的一种。凡是两个烃基通过一个氧原子连结起来的化合物叫做醚。醚的通式是
R—O—R'
,
R
和
R'
都是烃基,可以相同,也可以不同。
乙醚是一种无色易挥发的液体,沸点是
4.51 ℃
,有特殊的气味。吸入一定量的乙醚蒸气,会引起全身麻醉,所以纯乙醚可用作外科手术时的麻醉剂。
乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解许多有机物。乙醚蒸气很容易着火,空气中如果混有一定比的乙醚蒸气,遇火就会发生爆炸,所以使用乙醚时要特别小心。
乙醚
软件使用说明
采用非线性结构,方便老师调用
鼠标左键或键盘
任意键
可逐步显示屏幕内容
单击各种按钮、热字可实现交互跳转
单击动画画面可暂停或继续播放该动画
任意时刻均可按 返首页
任意时刻均可按 到主菜单
任意时刻均可按 回到原处
任意时刻均可按 到默认上一张幻灯片
任意时刻均可按 到默认下一张幻灯片
任意时刻均可按 到本帮助说明
任意时刻均可按 结束幻灯片放映
前 页
后 页
结 束
首 页
主菜单
说 明
回
原处
乙醇是发生在生活中较熟悉的一种醇,本节主要介绍了乙醇的结构式、性质和用途,
由于在初中化学教材中对乙醇有过初步介绍,因此建议本节可从学生熟悉的内容谈起,再剖析乙醇的结构简式及结构特点,推测可能具有性质,结合具体演示实验分析乙醇的物理及化学性质。
本节教学的重点为乙醇的性质和用途。在讲述乙醇的化学性质时,要抓住官能团的特性,也要注意乙基对羟基的影响。
在化学反应中表现出一系列的化学性质,由此也体现出“结构决定性质”的重要规律。
在教学中,要做好演示实验(教师最好在教材基础上加以补充和改进),加深印象,利于对知识的掌握,从而突破难点。也要将乙醇的性质与生活实际联系起来,避免空洞、抽象地说教,有利于培养学生的兴趣,也利于培养学生的能力。
相关文档
- 化学卷·2019届福建省永春县第一中2021-07-069页
- 2019-2020学年甘肃省张掖市第二中2021-07-067页
- 2019高中化学 第一章 认识有机化合2021-07-065页
- 2018-2019学年内蒙古集宁一中高一12021-07-065页
- 2017-2018学年河北省邯郸三中高二2021-07-069页
- 化学卷·2019届云南省昆明市黄冈实2021-07-0616页
- 专题 从海水中获得的化学物质知识2021-07-063页
- 2021届一轮复习人教版化学反应速率2021-07-0613页
- 2019届高考化学二轮复习专题二 物2021-07-0620页
- 2017-2018学年四川省乐山沫若中学2021-07-066页