- 1.22 MB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
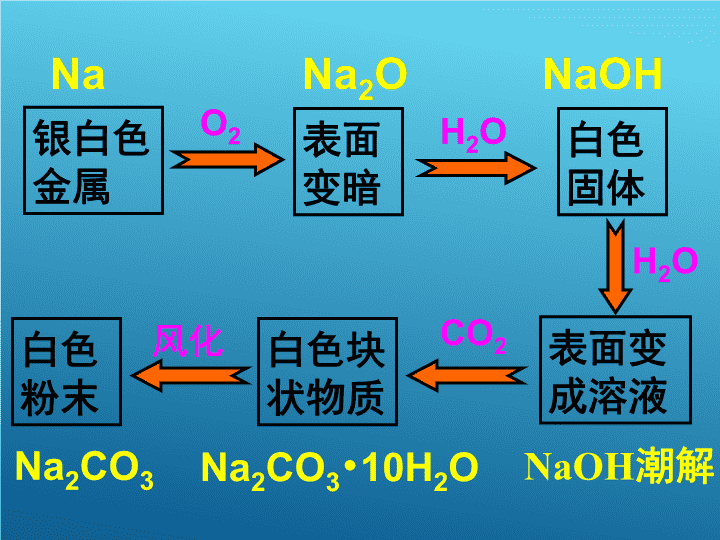
银白色
金属
表面
变暗
白色
固体
表面变
成溶液
白色块
状物质
O2 H2O
H2O
CO2风化白色
粉末
Na Na2O NaOH
NaOH潮解Na2CO3•10H2ONa2CO3
二.金属与水的反应
1.金属钠和水的反应
实验5: 将一小块金属钠投入滴有酚酞的水中
现 象 及 解 释
浮
游
熔
响
红
金属钠的密度小于水
产生的气体推动金属钠来回游动
反应放热,钠的熔点较低
剧烈反应,产生气体
有碱性物质生成
2Na + 2H2O = 2NaOH + H2↑
思考
1、金属钠引起火灾时应当怎
样灭火?
2、金属钠为什么保存在煤油中?
总结:钠的物理性质和化学性质
物理性质:银白色的固体,质软,密度
比水小(0.97g/cm3), 熔点较低(97.87℃)
化学性质: 化学性质很活泼
1.与氧气反应
4Na + O2 = 2Na2O
2Na + O2 === Na2O2
点燃
2.与水反应 2Na + 2H2O = 2NaOH + H2↑
2.铁与水蒸气的反应
铁不能与冷、热水反应,
但能否与水蒸气反应?
请设计一个简单的实验装置,使还
原铁粉与水蒸气反应。
思考:
1. 该反应装置包括哪几部分?
水蒸气的发生装置
水蒸气与铁粉反应装置
产物的检验(收集)装置
水蒸气的
发生装置
水蒸气与铁
粉反应装置
产物收
集装置
方案1:
方案2:
方案3:
4、实验是否安全
3Fe+4H2O (g) Fe3O4+4H2↑
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
2Al + 6HCl = 2AlCl3 + 3H2↑
离子方程式为:
2Al+6H+=2Al3+ +3H2 ↑
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
离子方程式为:
2Al + 2OH- + 2H2O =2AlO2
- + 3H2 ↑
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
2Al+6H+=2Al3+ +3H2 ↑
铝既能与强酸溶液反应也能与强碱溶
液反应,因此酸、碱可直接侵蚀铝的保护
膜以及铝制品本身,铝制品餐具不宜用来
蒸煮或长时间存放酸性、碱性或咸的食物
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
2Al+6H+=2Al3+ +3H2↑
2.铝与氢氧化钠溶液的反应
2Al + 2OH- + 2H2O =2AlO2
- + 3H2 ↑
以上我们学习了金属的一些化学性质,通过分
析不难发现,在反应中这些金属元素的化合价
都发生了变化,它们从0价升为正价。
在这些变化中,金属表现了强
的还原性,做还原剂
在自然界中金属多以化合态存在。只有
极少数金属以游离态存在
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
2Al + 6HCl == 2AlCl3 + 3H2
离子方程式为:
2Al+6H+==2Al3+ +3H2
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O==2NaAlO2+3H2
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可
直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸
煮或长时间存放酸性、碱性或咸的食物
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页