- 222.41 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微考点87 原子、离子的核外电子排布式与规则
1.下列各项叙述中,正确的是( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2
2.(2020·吉安质检)下列说法或有关化学用语的表达不正确的是( )
A.在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B.核外电子排布由1s22s22p63s1→1s22s22p6的变化需要吸收能量
C.Ca2+基态电子排布式为1s22s22p63s23p6
D.氧元素基态原子的电子排布图为
3.下列关于钠元素的几种表达式错误的是( )
A.Na+的电子排布图:
B.Na+的结构示意图:
C.Na的电子排布式:1s22s22p63s1
D.Na的简化电子排布式:[Na]3s1
4.A、B、C三种短周期元素,它们的原子序数依次增大。A元素原子的核外p电子数比s电子数少1;B元素原子核外有4种能级,且全部充满电子;C元素的主族序数与周期数的差为4。
(1)A的基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈________形。
(2)某同学推断B基态原子的核外电子排布图为,该同学所画的电子排布图违背了________。
6
(3)C位于______族______区,价电子排布式为________。
5.(1)[2018·全国卷Ⅱ,35(1)节选]基态Fe原子价层电子的电子排布图(轨道表达式)为____________________。
(2)[2018·全国卷Ⅲ,35(1)]Zn原子核外电子排布式为________________________________。
(3)[2018·江苏,21(2)]Fe2+基态核外电子排布式为__________________________________。
(4)[2017·全国卷Ⅲ,35(1)节选]Co基态原子核外电子排布式为_______________________。
(5)[2016·全国卷Ⅰ,37(1)节选]基态Ge原子的核外电子排布式为[Ar]_________________。
(6)[2016·全国卷Ⅱ,37(1)节选]镍元素基态原子的电子排布式为______________________。
(7)[2016·全国卷Ⅲ,37(1)]写出基态As原子的核外电子排布式_______________________。
(8)[2015·全国卷Ⅱ,37(1)节选]P原子的核外电子排布式为__________________________。
(9)[2014·新课标全国卷Ⅰ,37(2)节选]Fe3+的电子排布式为__________________________。
(10)[2014·新课标全国卷Ⅱ,37(1)节选]Cu的价层电子轨道示意图为__________________。
6.下列电子排布图所表示的元素原子中,其能量处于最低状态的是______(填序号)。
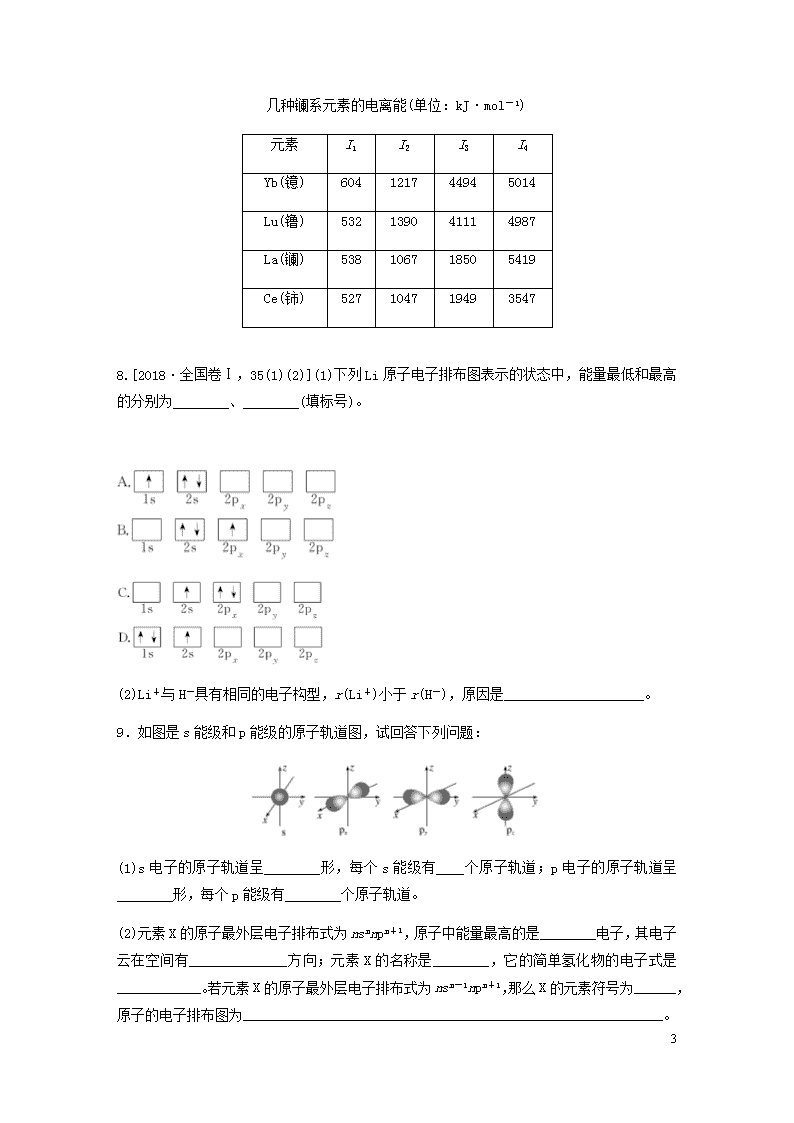
7.镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子价电子排布图:________________________________________________________________________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为________________________________________________________________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是________(填元素名称)。
6
几种镧系元素的电离能(单位:kJ·mol-1)
元素
I1
I2
I3
I4
Yb(镱)
604
1217
4494
5014
Lu(镥)
532
1390
4111
4987
La(镧)
538
1067
1850
5419
Ce(铈)
527
1047
1949
3547
8.[2018·全国卷Ⅰ,35(1)(2)](1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是____________________。
9.如图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈________形,每个s能级有____个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有______________方向;元素X的名称是________,它的简单氢化物的电子式是____________。若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为______,原子的电子排布图为____________________________________________________________。
6
10.按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A原子中只有一个能层且只含1个电子;B原子的3p轨道上得到1个电子后不能再容纳外来电子;C原子的2p轨道上有1个电子的自旋状态与其他电子的自旋状态相反;D原子第三能层上有8个电子,第四能层上只有1个电子;E原子的最外层电子排布式为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式:________________________________________________________________________
________________________________________________________________________(至少写出5种)。
(2)检验某溶液中是否含有D+,可通过__________反应来实现;检验某溶液中是否含有B-,通常所用的试剂是____________和____________。
(3)写出E的元素符号:________,要证明太阳上是否含有E元素,可采用的方法是__________________。
6
答案精析
1.C
2.D [2p轨道电子能量低于3s轨道电子能量,故A正确;失电子需要吸收能量,故B正确;Ca2+有18个电子,基态电子排布式为1s22s22p63s23p6,故C正确;氧元素基态原子的电子排布图违反洪特规则,故D错误。]
3.D
4.(1)3 哑铃 (2)泡利原理
(3)ⅦA p 3s23p5
解析 根据题意可知A为N,B为Mg,C为Cl。
5.(1)
(2)[Ar]3d104s2(或1s22s22p63s23p63d104s2)
(3)[Ar]3d6(或1s22s22p63s23p63d6)
(4)1s22s22p63s23p63d74s2(或[Ar]3d74s2)
(5)3d104s24p2
(6)1s22s22p63s23p63d84s2(或[Ar]3d84s2)
(7)1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3)
(8)1s22s22p63s23p3(或[Ne] 3s23p3)
(9)1s22s22p63s23p63d5(或[Ar]3d5)
(10)
6.③⑤
7.(1)
(2)[Ar]3d8(或1s22s22p63s23p63d8) (3)镧
8.(1)D C (2)Li+核电荷数较大
6
9.(1)球 1 哑铃 3
(2)2p 三个互相垂直的伸展 氮
10.(1)KOH、KClO、KClO3、HClO、HClO3(答案合理即可)
(2)焰色 AgNO3溶液 稀HNO3
(3)Ar 对太阳光进行光谱分析
解析 由A只有1个能层且只含1个电子,判断A为H元素;B原子3p轨道得1个电子达到饱和,则原有5个电子,即B的电子排布式为1s22s22p63s23p5,为Cl元素;C原子的电子排布图为。
6
相关文档
- 江西省吉安市遂川中学2019-2020学2021-07-0625页
- 2020届高考化学二轮复习常考题型大2021-07-068页
- 2020年高考真题——化学(天津卷) Wor2021-07-0620页
- 吉林省辉南县第一中学2018-2019高2021-07-068页
- 高中化学选修4电化学知识点总结2021-07-0616页
- 2019-2020学年安徽省蚌埠田家炳中2021-07-065页
- 2020届高考化学一轮复习认识有机化2021-07-0612页
- 2018届二轮复习化学与生产生活(青海2021-07-0610页
- 2020高中化学第一章认识有机化合物2021-07-065页
- 【化学】江西省宜春市上高二中20202021-07-0617页