- 681.21 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点
清单
考点一 物质的组成、性质和分类
一、物质的组成
1.宏观上:物质由①
元素
组成,元素在自然界有两种存在形式,以单质形
式存在的称为元素的②
游离
态,以化合物形式存在的称为元素的
③
化合
态。
2.微观上:质子、中子、④
电子
是构成原子的三种基本粒子,原子、分
子、⑤
离子
是构成物质的三种基本微粒。
二、分类的方法
1.树状分类法
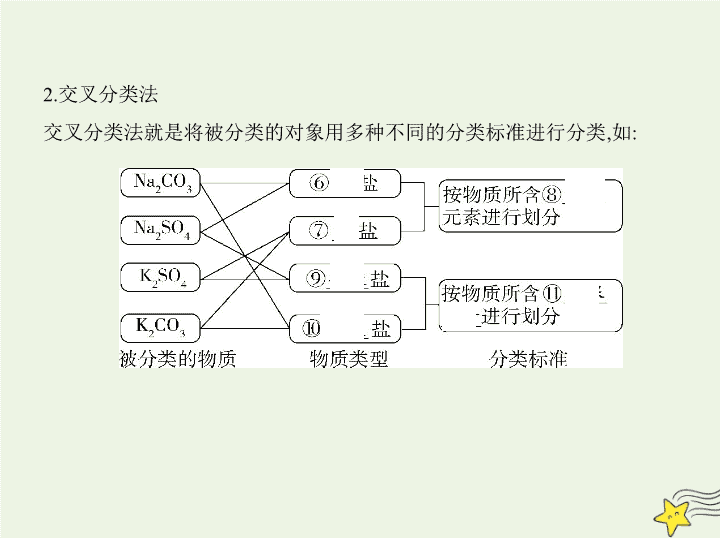
2.交叉分类法
交叉分类法就是将被分类的对象用多种不同的分类标准进行分类,如:
三、物质的变化
1.化学反应的分类
化学反应“5种”分类方法
化学反应
2.物理变化和化学变化的特征及判断方法
3.物质变化过程中的“三馏”“四色”“五解”和“十七化”
分散系
考点二 分散系
一、分散系
二、溶液
1.饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所
得到的溶液叫做这种溶质的饱和溶液。
2.溶解度
溶解度
:
在一定温度下
,
某物质在⑤
100
g
溶剂里达到⑥
饱和
状态时
所溶解的质量。溶解度的单位是克
,
符号为
S
。计算公式
:
溶解度
=
×
100 g,
即
S
=
×
100 g
溶解度随温度升高而增大的物质
,
当把其饱和溶液的温度降低时
,
溶质会析
出。
3.溶解度与溶质质量分数的区别
溶质质量分数没有单位,既可以用百分数表示,又可以用小数表示,且适用
于任何溶液。溶解度单位为g,仅适用于⑦
饱和
溶液。
4.溶解度的影响因素
(1)固体溶解度的影响因素
①内因:物质本身的性质(由结构决定)
②外因:a.溶剂 b.温度:升温,大多数固体物质的溶解度⑧
增大
;极少数
物质相反,如⑨ Ca(OH)2 ;温度对NaCl的溶解度影响不大。
(2)气体的溶解度随温度升高而减小,随压强的增大而增大。
5.有关溶质质量分数的计算
(1)
ω
=⑩
×
100%=
×
100%
(2)
ω
=
×
100%(饱和溶液,溶解度为
S
)
三、胶体
1.定义:分散质粒子直径介于1~100 nm之间的分散系。
2.特征
(1)
外观特征
:均一。
(2)
本质特征
:胶体粒子直径介于1~100 nm之间。
3.分类
按照存在状态的不同,将胶体分为三类:
(1)气溶胶,如烟、云、雾;
(2)液溶胶,如AgI水溶胶;
(3)固溶胶,如烟水晶、有色玻璃。
4.性质
(1)丁达尔效应
当光束通过胶体时,可以看到一条光亮的“通路”。这是胶体粒子对光线
散射
形成的,叫做丁达尔效应。
说明 a.丁达尔效应是
物理
现象;
b.利用丁达尔效应可区别
溶液和胶体
;
c.丁达尔效应能证明分散质粒子直径的大小范围;
d.当光束通过胶体时,看到的光亮“通路”是光被胶体粒子散射形成的现
象,并不是胶体粒子本身发光。
(2)介稳性
胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
(3)聚沉
胶体粒子聚集长大,形成颗粒较大的沉淀从分散系里析出的现象。
方法:加热、加电解质溶液、加带相反电荷胶粒的胶体。
应用:土壤的保肥作用、明矾净水、豆浆制豆腐、江河入海口形成的三角洲。
5.Fe(OH)
3
胶体的制备
写出制备Fe(OH)
3
胶体的离子方程式:
Fe
3+
+3H
2
O
Fe(OH)
3
(胶体)+3H
。
四、几种分散系的比较
知能拓展
物质分类中易混淆的概念关系
1.名称中有“酸”的物质不一定是酸,如石炭酸(C
6
H
5
OH)是酚,不是酸。
2.酸的元数不一定等于酸分子中的H原子数。如亚磷酸(H
3
PO
3
)是二元酸,
次磷酸(H
3
PO
2
)是一元酸,因为它们的结构分别是 、
。
3.无氧酸不一定是非金属元素的氢化物,如氢氰酸(HCN)等。
4.酸的氧化性与氧化性酸不同。酸的氧化性指H
+
的氧化性;氧化性酸指酸
根离子具有氧化性的酸,如HClO、HNO
3
、浓H
2
SO
4
。
5.非金属氧化物不一定是酸性氧化物,如CO、NO等。酸性氧化物不一定
是非金属氧化物,如Mn
2
O
7
、Cr
2
O
3
。金属氧化物不一定是碱性氧化物,如
Al
2
O
3
、ZnO(两性氧化物),Mn
2
O
7
、Cr
2
O
3
(酸性氧化物)。碱性氧化物一定是
金属氧化物。
6.酸酐不一定是酸性氧化物,如乙酸酐[(CH
3
CO)
2
O]等。
7.酸性氧化物不一定能与水反应生成相应的酸,如SiO
2
。
8.Na
2
O
2
与酸反应不仅生成盐和水,还生成O
2
,因而不是碱性氧化物。
例
(2018广东茂名高三9月联考,4)下列有关物质的分类正确的是
( )
A.H
2
SO
4
、HNO
3
、CH
3
COOH均属于酸
B.NO、CO、NO
2
均属于酸性氧化物
C.NaCl、CuSO
4
、NH
3
·H
2
O均属于盐
D.H
2
S、HCl、NH
3
均属于电解质
解题导引
要明确课本所给的定义,结合题目所给信息的细微之处进行分析,如在判断电解质和非电解质时,要明确电解质与非电解质都属于化合物及导电的原因是不是化合物本身电离,此类题目较易混淆概念,从而作出误的判断。
解析 H
2
SO
4
、HNO
3
、CH
3
COOH电离出的阳离子均为氢离子,均属于酸,
A项正确;NO、CO与碱不发生反应,属于不成盐氧化物,B项错误;NH
3
·H
2
O电离出的阴离子为氢氧根离子,属于碱,C项错误;NH
3
溶于水生成NH
3
·H
2
O,
NH
3
·H
2
O能够电离,溶液能够导电,NH
3
·H
2
O属于电解质,而NH
3
属于非电解质,D项错误。
答案
A
实践探究
1.化学与传统文化紧密联系。引导学生抓住关键词综合运用所学的化学
知识和技能,分析和解决问题。
例1 (2019济南外国语学校一模,7)下列对文中描述内容的相关解释正确
的是
( )
选项
描述
解释
A
丹砂烧之成水银,积变又还成丹砂
两个反应互为可逆反应
B
凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之
其中“瓦”的主要成分为硅酸盐
C
硝石(KNO
3
)如握盐雪不冰,强烧之,紫青烟起
产生“紫青烟”的原因为KNO
3
分解
D
其法用浓酒和糟入甑,蒸令气上,
用器承滴露
其中涉及的操作方法为蒸发浓缩
解析 “丹砂烧之成水银”的实质是:HgS
Hg+S,“积变又还成丹
砂”实质是Hg+S
HgS,两个化学反应条件不同,不是同时发生的,不互
为可逆反应,A项错误;“埏泥”即为黏土,其主要成分为硅酸盐,B项正确;
出现“紫青烟”的原因是钾的焰色反应,C项错误;由“蒸令气上,用器承滴
露”可知,该操作方法为蒸馏,收集到的是较高浓度的酒精,D项错误。
答案
B
题目价值
真实、具体的问题情境是学科核心素养形成和发展的重要平
台。因此
,
应重视构建真实且富有价值的问题情境
,
促进学科核心素养的形
成与发展。
2.物质分类方法多种多样,应注意从多角度对物质进行分类,提高迁移应用
的能力。
例2 (2018济南一模,7)2017年国家科技奖刚刚宣布。下列有关内容都涉
及这些奖项。下列说法中不正确的是
( )
A.太阳能光解水制氢气涉及物理过程和化学过程
B.碳纤维、石墨烯和富勒烯互为同素异形体
C.纳米材料、磁性材料、金属材料能体现新的功能及用途
D.高能量密度炸药、芳香化合物、卤代烃、植物油都是有机物,其中植物
油属于天然高分子
解析
太阳能光解水是化学变化,但化学变化过程中一定有物理变化,A项
正确;碳纤维、石墨烯和富勒烯都是碳的单质,三者互为同素异形体,B项正
确;纳米材料、磁性材料等是新型材料,具有独特的性质,因此能够体现新
的功能和用途,C项正确;植物油是高级脂肪酸甘油酯,不是高分子化合物,D
项错误。
答案
D
题目价值 能根据物质组成和性质对物质进行分类,理解物质是由元素组
成和化学变化中元素不变的观点。了解生活中常用材料的组成与性能,认
识化学在日用材料发展中的重要作用。
相关文档
- 2020届一轮复习人教版物质的组成与2021-07-068页
- 2020届一轮复习人教版物质的组成、2021-07-068页
- 2021届高考化学一轮复习物质的组成2021-07-069页
- 2020高考化学刷题冲刺含最新模拟题2021-07-067页
- 2021版高考化学一轮复习物质的组成2021-07-069页
- 2020高考化学二轮复习课时作业1物2021-07-067页
- 2019届高考化学二轮复习专题一物质2021-07-0643页
- 高考化学一轮复习教学案第21讲物质2021-07-0613页
- 2021届高考化学一轮复习物质的组成2021-07-069页
- 2020届一轮复习人教版物质的组成、2021-07-067页