- 2.37 MB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
3
讲 电解池 金属的电化学腐蚀与防护
-
2
-
考纲要求
:1.
理解电解池的构成、工作原理及应用
,
能写出电极反应和总反应方程式。
2.
了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
-
3
-
必备知识
•
自主预诊
关键能力
•
考向突破
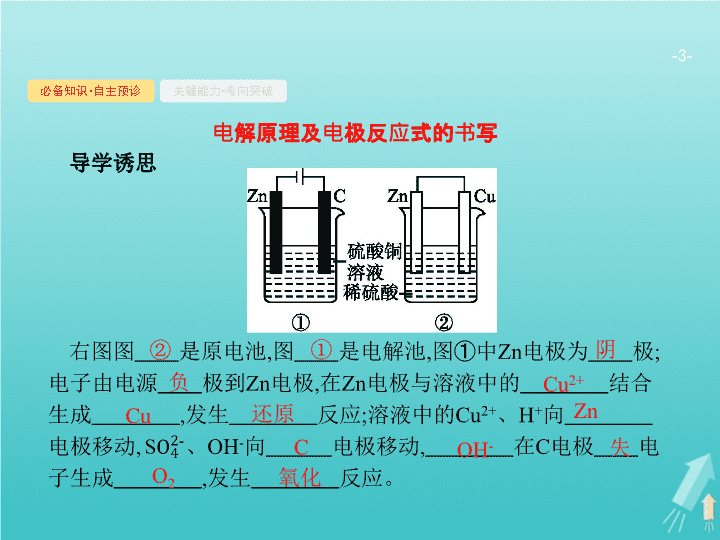
导学诱思
右图图
是原电池
,
图
是电解池
,
图
①
中
Zn
电极为
极
;
电子由电源
极到
Zn
电极
,
在
Zn
电极与溶液中的
结合生成
,
发生
反应
;
溶液中的
Cu
2+
、
H
+
向
电极移动
,
、
OH
-
向
电极移动
,
在
C
电极
电子生成
,
发生
反应。
②
①
阴
负
Cu
2+
Cu
还原
Zn
C
OH
-
失
O
2
氧化
电解原理及电极反应式的书写
-
4
-
必备知识
•
自主预诊
关键能力
•
考向突破
落实基础
1
.
电解池
将
能转化为
能的装置叫做电解池。电解池是由
电源、固体电极材料以及电解质溶液或熔融电解质组成的。
2
.
原理图示
电
化学
直流
正
氧化
负
还原
-
5
-
必备知识
•
自主预诊
关键能力
•
考向突破
易错辨析
判断正误
,
正确的画
“
√
”
,
错误的画
“
×”
。
(1)
电解质溶液导电的过程一定发生氧化还原反应
(
)
(2)
电解质电离就是电解质导电的过程
(
)
(3)
电离是物理变化
,
而电解是化学变化
,
且电离是电解的前提
(
)
(4)Zn+H
2
SO
4
ZnSO
4
+H
2
↑
只能设计成原电池
,
不能设计成电解池
(
)
√
×
√
×
-
6
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度一
电解池两极的判断
例
1
将下图所示实验装置的
K
闭合
,
下列判断正确的是
(
)
A.Cu
电极上发生还原反应
B.
电子沿
Zn→a→b→Cu
路径流动
C.
片刻后甲池中
c
( )
增大
D.
片刻后可观察到滤纸
b
点变红色
答案
解析
解析
关闭
答案
解析
关闭
-
7
-
必备知识
•
自主预诊
关键能力
•
考向突破
方法指导
(1)
判断电解池阴、阳极的常用方法
:
-
8
-
必备知识
•
自主预诊
关键能力
•
考向突破
(2)
原电池和电解池电极的判断是解题的关键
,
为了方便记忆
,
我们可采取口诀或谐音的方法记忆。
①
原电池
,
正负极
;
电解池
,
阴阳极
;
失去电子负
(
原电池
)
阳
(
电解池
)
极
;
发生氧化定无疑。
②
还可以用谐音帮助记忆
:
阴得阳失
;
阳氧阴还。
-
9
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度二
电极反应式的书写步骤及方法
例
2
Na
2
FeO
4
是一种既能杀菌、消毒
,
又能絮凝净水的水处理剂
,
其电解制法如图所示
,
请根据图示分析
:Fe
电极的电极反应式为
,
与铁电极相连的为电源的
极。
答案
解析
解析
关闭
答案
解析
关闭
-
10
-
必备知识
•
自主预诊
关键能力
•
考向突破
互动探究
(1)
上述装置如果把铁电极换成铝电极
,
即可在铝表面形成氧化膜
,
阳极电极反应式为
。
(2)
如果既把铁电极换成铝电极
,
又把
NaOH
溶液换成稀硫酸
,
也可在铝表面形成氧化膜
,
阳极电极反应式为
。
-
11
-
必备知识
•
自主预诊
关键能力
•
考向突破
方法指导
电解池电极反应式的书写可总结为五步
:
一判、二看、三分、四写、五平。
一判
:
判断阴、阳极。
二看
:
阳极要看清电极材料。对于铁、铝、铜、银等活泼电极
,
则阳极金属电极失电子变成阳离子进入溶液
(Fe
变成
Fe
2+
),
阴离子不失电子
;
如果是惰性电极
(Pt
、
Au
、石墨等
)
材料
,
应是溶液中的阴离子失电子。
三分
:
将离子分成阳离子组、阴离子组
(
注意
:
水溶液中一定不要漏掉
H
+
、
OH
-
),
阳离子向阴极移动
,
在阴极得电子
;
阴离子向阳极移动
,
在阳极失电子。根据得失电子能力对离子排序
,
得电子能力
:Ag
+
>Fe
3+
>Cu
2+
>H
+
;
失电子能力
:S
2-
>I
-
>Br
-
>Cl
-
>OH
-
>
含氧酸根。
-
12
-
必备知识
•
自主预诊
关键能力
•
考向突破
四写
:
由放电顺序及信息确定放电产物和电极反应。
五平
:
配平方法与原电池电极反应相同
:
①
找化合价变化的物质、
②
确定电极产物、
③
配平除氢、氧原子之外的其他原子、
④
依据电荷守恒配平电荷、
⑤
依据氢原子守恒配平氢原子、
⑥
用氧原子检查配平情况
;
如下图所示
:
-
13
-
必备知识
•
自主预诊
关键能力
•
考向突破
注意
:(1)
避免思维定式。
“
阴得阳失
”
的意义是阳离子在阴极发生得电子的反应
,
阴离子
(
或电极材料
)
在阳极发生失电子的反应
,
但也不要形成思维定式
,
有时依据题干信息
,
阴离子也可在阴极发生得电子的反应。
-
14
-
必备知识
•
自主预诊
关键能力
•
考向突破
(2)
书写电极反应式时
,
应看清电解的是水溶液还是熔融电解质
,
如果是水溶液应注意运用
H
+
、
OH
-
、
H
2
O
进行配平。电解池电极反应中
,
如果是
H
+
、
OH
-
放电
,
不知溶液酸碱性则写
H
+
、
OH
-
得、失电子
,
其他情况下酸性溶液中一定不能存在
OH
-
,
同理在碱性溶液中一定不能存在
H
+
。
(3)
书写电解池的电极反应式时
,
要以实际放电的离子表示
,
但书写电解总方程式时
,
弱电解质要写成分子式。
(4)
书写电解总方程式时必须在连接号上注明通电。
-
15
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度三
实验现象的分析
例
3
以石墨为电极
,
电解
KI
溶液
(
含有少量的酚酞和淀粉
)
。下列说法错误的是
(
)
A.
阴极附近溶液呈红色
B.
阴极逸出气体
C.
阳极附近溶液呈蓝色
D.
溶液的
pH
变小
答案
解析
解析
关闭
答案
解析
关闭
-
16
-
必备知识
•
自主预诊
关键能力
•
考向突破
-
17
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度四
电解后电解质溶液的复原
例
4
用铂电极电解一定浓度的下列物质的水溶液
,
在电解后的电解液中加适量水
,
能使溶液浓度恢复到电解前浓度的是
(
)
A.NaCl B.Na
2
CO
3
C.CuSO
4
D.K
2
S
答案
解析
解析
关闭
加适量水能使溶液恢复到电解前的浓度
,
则实际是电解水
,
故只有
B
项符合条件。
答案
解析
关闭
B
-
18
-
必备知识
•
自主预诊
关键能力
•
考向突破
方法指导
电解后要恢复原电解质溶液的浓度
,
需加适量的某物质
,
该物质可以是阴极与阳极产物的化合物。例如用惰性电极电解下列电解质溶液
:
-
19
-
必备知识
•
自主预诊
关键能力
•
考向突破
电解
CuSO
4
溶液
,
要恢复原溶液的浓度
,
可向电解后的溶液中加入
CuO,
也可以加入
CuCO
3
,
但不能加入
Cu(OH)
2
,
因为
Cu(OH)
2
与生成的
H
2
SO
4
反应后使水量增加。
-
20
-
必备知识
•
自主预诊
关键能力
•
考向突破
跟踪训练
1
.(2019
四川阆中中学高三模拟
)
用惰性电极电解稀硫酸、
Cu(NO
3
)
2
、
NaCl
的混合液
,
最初一段时间阴极和阳极上析出的物质分别是
(
)
。
A.H
2
和
Cl
2
B.Cu
和
Cl
2
C.H
2
和
O
2
D.Cu
和
O
2
答案
解析
解析
关闭
答案
解析
关闭
-
21
-
必备知识
•
自主预诊
关键能力
•
考向突破
2
.(2019
江苏泰州中学高三模拟
)
某同学为了使反应
2HCl+2Ag
═
2AgCl+H
2
↑
能进行
,
设计了下列四个实验
,
如图所示
,
你认为可行的方案是
(
)
。
答案
解析
解析
关闭
Ag
不能与
HCl
自发地进行氧化还原反应
,
所以要使反应
2HCl+2Ag
═
2AgCl +H
2
↑
能进行
,
应该设计成电解池
,Ag
失电子发生氧化反应
,
所以
Ag
作阳极
,
氢离子得电子发生还原反应
,
所以电解质溶液中氢离子放电
,
则符合条件的是
C
。
答案
解析
关闭
C
-
22
-
必备知识
•
自主预诊
关键能力
•
考向突破
3
.
工业上通过电化学原理在铝表面形成氧化膜来提高其抗腐蚀能力
,
工作原理如图所示。下列说法中不正确的是
(
)
。
A.
石墨棒可用铜棒代替
,
其作用是传递电流
B.
通电一段时间后
,
溶液的
pH
减小
C.
通电后电子被强制从石墨棒通过电解质溶液流向铝片使铝表面形成氧化膜
D.
可通过调节滑动变阻器来控制氧化膜的形成速率
答案
解析
解析
关闭
答案
解析
关闭
-
23
-
必备知识
•
自主预诊
关键能力
•
考向突破
4
.(1)H
3
PO
2
可用电渗析法制备
,“
四室电渗析法
”
工作原理如图所示
(
阳膜和阴膜分别只允许阳离子、阴离子通过
):
①
写出阳极的电极反应式
:
。
②
分析产品室可得到
H
3
PO
2
的原因
:
。
-
24
-
必备知识
•
自主预诊
关键能力
•
考向突破
③
早期采用
“
三室电渗析法
”
制备
H
3
PO
2
:
将
“
四室电渗析法
”
中阳极室的稀硫酸用
H
3
PO
2
稀溶液代替
,
并撤去阳极室与产品室之间的阳膜
,
从而合并了阳极室与产品室。其缺点是产品中混有
杂质
,
该杂质产生的原因是
。
(2)PbO
2
可由
PbO
与次氯酸钠溶液反应制得
,
反应的离子方程式为
;PbO
2
也可以通过石墨为电极
,Pb(NO
3
)
2
和
Cu(NO
3
)
2
的混合溶液为电解液电解制取。阳极发生的电极反应式为
,
阴极上观察到的现象是
;
若电解液中不加入
Cu(NO
3
)
2
,
阴极发生的电极反应式为
,
这样做的主要缺点是
。
-
25
-
必备知识
•
自主预诊
关键能力
•
考向突破
-
26
-
必备知识
•
自主预诊
关键能力
•
考向突破
-
27
-
必备知识
•
自主预诊
关键能力
•
考向突破
电解原理的应用
导学诱思
下列图示中关于铜电极的连接错误的是
(
)
答案
答案
关闭
C
-
28
-
必备知识
•
自主预诊
关键能力
•
考向突破
落实基础
1
.
电解饱和食盐水
(1)
电极反应。阳极
:
;
阴极
:
。
(2)
总反应
:
。
(3)
应用
:
工业制
、
、
。
2
.
电解精炼铜
(1)
阳极。材料
:
;
电极反应
:
。
(2)
阴极。材料
:
;
电极反应
:
。
(3)
电解液
:
。
烧碱
氯气
氢气
粗铜
精铜
CuSO
4
溶液
-
29
-
必备知识
•
自主预诊
关键能力
•
考向突破
3
.
电镀池
(
如铁上镀铜
)
(1)
阳极。材料
:
;
电极反应
:
。
(2)
阴极。材料
:
;
电极反应
:
。
(3)
电解液
:
。
铜
铁
CuSO
4
溶液
-
30
-
必备知识
•
自主预诊
关键能力
•
考向突破
4
.
电冶金
冶炼
Na
、
Mg
、
Al
等活泼金属必须用电解法
,
原理
:
(1)
电解熔融的
NaCl
冶炼金属钠
:
①
阳极反应
:
;
②
阴极反应
:
;
③
总反应
:
。
(2)
电解熔融的
Al
2
O
3
冶炼金属铝
:
①
阳极反应
:
;
②
阴极反应
:
;
③
总反应
:
。
-
31
-
必备知识
•
自主预诊
关键能力
•
考向突破
易错辨析
判断正误
,
正确的画
“
√
”
,
错误的画
“
×”
。
(1)
电解精炼铜时
,
两极得失电子数一定相同
(
)
(2)
电镀铜时
,
电解质溶液中的
Cu
2+
浓度不变
(
)
(3)
电解精炼铜时
,
电解质溶液中的
Cu
2+
浓度不变
(
)
(4)
电解精炼铜时
,
阳极泥中的金属没有得失电子
(
)
√
√
×
√
解析
:
(3)
电解精炼铜时
,
粗铜中的
Zn
、
Fe
、
Ni
等比
Cu
活泼的金属在阳极失去电子
,
阴极上只有
Cu
2+
得电子
,
所以
CuSO
4
溶液的浓度会降低。
-
32
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度一
电解精炼与电镀
例
1
下列关于各图的说法
,
正确的是
(
)
A.
①
中电解一段时间后溶液中
c
(Cu
2+
)
不变
B.
②
中待镀铁制品应与电源正极相连
C.
③
中钢闸门应与外接电源的正极相连
,
称为牺牲阳极的阴极保护法
D.
④
中的离子交换膜可以避免生成的
Cl
2
与
NaOH
溶液反应
答案
解析
解析
关闭
装置①是铜的电解精炼
,
由于阳极放电的不只是铜
,
故电解一段时间后
,
c
(Cu
2+
)
减小
,A
项错误
;
装置②中待镀铁制品上要有
Cu
2+
放电析出铜
,
故应和电源负极相连
,
作电解池的阴极
,
故
B
错误
;
装置③是电解池
,
在电解池中
,
阴极被保护
,
故钢闸门应与外接电源的负极相连
,
故
C
错误
;Cl
2
能和
NaOH
溶液反应
,
电解过程中
Cl
2
在阳极生成
, NaOH
在阴极生成
,
装置④中的离子交换膜允许离子通过
,Cl
2
不能通过
,
可以避免生成的
Cl
2
与
NaOH
溶液反应
,
故
D
正确。
答案
解析
关闭
D
-
33
-
必备知识
•
自主预诊
关键能力
•
考向突破
方法指导
电解池应用时电极的连接判断要抓住氧化还原反应
,
发生得电子的一极应该与电源负极相连
,
失电子的一极应该与电源正极相连。
-
34
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度二
污水除杂及净化
例
2
用铁和石墨作电极电解酸性废水
,
可将废水中的
以
FePO
4
(
不溶于水
)
的形式除去
,
其装置如图所示。
答案
解析
解析
关闭
答案
解析
关闭
-
35
-
必备知识
•
自主预诊
关键能力
•
考向突破
跟踪训练
1
.
某工厂采用电解法处理含铬废水
,
耐酸电解槽用铁板作阴、阳极
,
槽内盛放含铬废水
,
工作原理如右图所示
,
下列说法不正确的是
(
)
A.A
接电源正极
B.B
极区附近溶液
pH
降低
C.A
极区溶液中发生的氧化还原反应为
答案
解析
解析
关闭
答案
解析
关闭
-
36
-
必备知识
•
自主预诊
关键能力
•
考向突破
2
.
金属镍有广泛的用途。粗镍中含有少量
Fe
、
Cu
、
Pt
等杂质
,
可用电解法制备高纯度的镍
(
用
NiSO
4
溶液作电解质溶液
)
。已知
:
氧化性
Fe
2+
原电池的负极
>
化学腐蚀
>
原电池的正极
>
电解池的阴极。
(2)
对同一种金属来说
,
腐蚀的快慢
:
强电解质溶液
>
弱电解质溶液
>
非电解质溶液
(3)
活动性不同的两金属
,
活动性差别越大
,
腐蚀越快。
(4)
对同一种电解质溶液来说
,
电解质溶液浓度越大
,
腐蚀越快。
-
43
-
必备知识
•
自主预诊
关键能力
•
考向突破
5
.
金属的防护
一般有三条途径
:
(1)
改变金属内部组成结构
,
可以增强金属耐腐蚀的能力
,
如不锈钢
;
(2)
在金属表面覆盖一层保护层
,
如油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜
,
以断绝金属与外界物质接触
,
达到耐腐蚀的效果
;
(3)
电化学保护法
:
牺牲阳极的阴极保护法、外加电流的阴极保护法。
-
44
-
必备知识
•
自主预诊
关键能力
•
考向突破
易错辨析
判断正误
,
正确的画
“
√
”
,
错误的画
“
×”
。
(1)
原电池分为正负极、电解池才分为阴阳极
,
所以牺牲阳极的阴极保护法应用的是电解池原理
(
)
(2)
在铁板上镀锌是因为锌比铁活泼
,
形成原电池而保护铁不易被腐蚀
(
)
×
×
解析
:
在铁板上镀锌是因为在铁板表面形成一层锌保护膜
,
阻止了铁与空气的接触
,
与原电池无关
,
破损后才与原电池有关。
-
45
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度一
金属的腐蚀
例
1
将
NaCl
溶液滴在一块光亮清洁的铁板表面上
,
一段时间后发现液滴覆盖的圆圈中心区
(a)
已被腐蚀而变暗
,
在液滴外沿形成棕色铁锈环
(b),
如图所示。
导致该现象的主要原因是液滴之下氧气含
量比边缘处少。下列说法正确的是
(
)
答案
解析
解析
关闭
答案
解析
关闭
-
46
-
必备知识
•
自主预诊
关键能力
•
考向突破
方法指导
金属腐蚀大多数是吸氧腐蚀
,
所以我们不要忘记空气中的氧气参加反应。
-
47
-
必备知识
•
自主预诊
关键能力
•
考向突破
考查角度二
金属的防护
例
2
利用如图装置
,
可以模拟铁的电化学防护。
若
X
为石墨棒
,
为减缓铁的腐蚀
,
开关
K
应置于
处。
若
X
为锌
,
开关
K
置于
M
处
,
该电化学防护法称为
。
答案
解析
解析
关闭
铁被保护
,
可以是作原电池的正极
,
或电解池的阴极。故若
X
为石墨棒
,
开关
K
应置于
N
处
,Fe
作阴极受到保护
;
若
X
为锌
,
开关
K
置于
M
处
,
铁作正极
,
锌作负极
,
称为牺牲阳极的阴极保护法。
答案
解析
关闭
N
牺牲阳极的阴极保护法
-
48
-
必备知识
•
自主预诊
关键能力
•
考向突破
方法指导
只要金属作得电子的一极
(
正极或阴极
)
均被保护
,
如果作失电子的一极
(
负极或阳极
)
则加快腐蚀。
-
49
-
必备知识
•
自主预诊
关键能力
•
考向突破
跟踪训练
1
.
下列有关金属腐蚀与防护的说法正确的是
(
)
A.
在酸性环境下
,
钢铁只能发生析氢腐蚀
B.
金属腐蚀的实质是金属失去电子被还原的过程
C.
轮船的船壳水线以下常装有一些锌块
,
这是利用了牺牲阳极的阴极保护法
D.
铜铁接触处
,
在潮湿的空气中直接发生反应
:Fe-3e
-
Fe
3+
,
继而形成铁锈
答案
解析
解析
关闭
强酸性环境下
,
钢铁易发生析氢腐蚀
,
在弱酸性条件下
,
钢铁主要发生吸氧腐蚀
,
所以酸性条件下钢铁不一定发生析氢腐蚀
,A
项错误
;
金属腐蚀的实质是金属原子失去电子发生氧化反应
,
属于被氧化的过程
,B
项错误
;Zn
、
Fe
和海水构成了原电池
,Zn
失去电子作负极被腐蚀
,Fe
作正极被保护
,
所以轮船的船壳水线以下常装有一些锌块
,
这是利用了牺牲阳极的阴极保护法
,C
项正确
;Cu
、
Fe
和电解质溶液构成原电池
,
发生吸氧腐蚀
,Fe
作负极
, Cu
作正极
,
负极反应式为
Fe-2e
-
═
Fe
2+
,D
项错误。
答案
解析
关闭
C
-
50
-
必备知识
•
自主预诊
关键能力
•
考向突破
2
.
下列
有关金属的腐蚀与防护的叙述正确的是
(
)
A.
金属的化学腐蚀比电化学腐蚀普遍
B.
上图装置的原理是
“
牺牲阳极的阴极保护法
”
C.
金属腐蚀的本质是
M-
n
e
-
M
n
+
而被损耗
D.
用铝质铆钉来接铁板
,
铁板易被腐蚀
答案
解析
解析
关闭
电化学腐蚀普遍
,A
选项错误
;B
选项
,
此装置为电解池
,
是外加电流的阴极保护法
,
错误
;D
选项
,
铝比铁活泼
,
所以铁作正极
,
被保护
,
错误。
答案
解析
关闭
C
-
51
-
必备知识
•
自主预诊
关键能力
•
考向突破
3
.
下列与金属腐蚀有关的说法中正确的是
(
)
A.
图
a
中
,
插入海水中的铁棒
,
越靠近底端腐蚀越严重
B.
图
b
中
,
开关由
M
改置于
N
时
,Cu-Zn
合金的腐蚀速率减小
C.
图
c
中
,
接通开关时
Zn
腐蚀速率增大
,Zn
上放出气体的速率也增大
D.
图
d
中
,Zn-MnO
2
干电池自放电腐蚀主要是由
MnO
2
的氧化作用引起的
答案
解析
解析
关闭
图
a
中
,
烧杯底部的海水中含氧量比较少
,
故越靠近底端
,
铁棒发生吸氧腐蚀的速率应该越小
,A
项错误
;
图
b
中
,
当开关置于
N
时
,
左边的锌与合金形成了原电池
,
并且合金作正极
,
合金的腐蚀速率减小
,B
项正确
;
图
c
中
,
接通开关后
,
形成原电池
,
生成氢气的速率增大
,
但是氢气是在
Pt
电极上放出的
,C
项错误
;
图
d
中
,
在放电时应该是
MnO
2
发生还原反应
,D
项错误。
答案
解析
关闭
B
-
52
-
电化学的定量计算
原电池和电解池的计算包括两极产物的定量计算、溶液
pH
的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量与根据产物的量求电荷量的计算等。无论哪类计算
,
均可概括为下列三种方法
:
-
53
-
1
.
根据电子守恒法计算
用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算
,
其依据是阴、阳极得失电子数相等。
例
1
两个惰性电极插入
500 mL AgNO
3
溶液中
,
通电电解。当电解液的
pH
从
6.0
变为
3.0
时
(
设电解过程中阴极没有
H
2
放出
,
且电解液在电解前后体积变化可以忽略不计
),
电极上析出银的质量最大为
(
)
A.27 mg B.54 mg
C.106 mg D.216 mg
答案
解析
解析
关闭
答案
解析
关闭
-
54
-
2
.
根据总反应计算
先写出电极反应
,
再写出总反应式
,
最后根据总反应列比例式计算。
例
2
A
、
B
、
C
三种强电解质
,
它们在水中电离出的离子为
Na
+
、
Ag
+
、
Cl
-
,
在如图所示装置中
,
甲、乙、丙三个烧杯依次分别盛放足量的
A
、
B
、
C
三种溶液
,
电极均为石墨电极。接通电源
,
经过一段时间后
,
测得乙烧杯中
c
电极质量增加了
10.8 g
。常温下各烧杯中溶液的
pH
与电解时间
t
的关系如图所示。据此回答下列问题
:
-
55
-
(1)M
为电源的
(
填
“
正
”
或
“
负
”)
极
,
甲、乙两个烧杯中的电解质分别为
、
(
填写化学式
)
。
(2)
计算电极
f
上生成气体的物质的量为
mol
。
(3)
写出乙烧杯中的电解反应方程式
:
。
(4)
若电解后甲溶液的体积为
10 L,
则该溶液的
pH
为
。
答案
解析
解析
关闭
答案
解析
关闭
-
56
-
3
.
根据关系式计算
根据得失电子守恒关系建立已知量与未知量之间的桥梁
,
建立计算所需的关系式。
例
3
如图为某蓄电系统的示意图。反应原理为
Na
2
S
4
+3NaBr 2Na
2
S
2
+NaBr
3
。当蓄电池放电时
,Na
+
的移动方向是从
到
(
填
“a”
或
“b”)
。电极
b
的电极反应为
。用该电池作电源
,
用惰性电极电解一定浓度的硫酸铜溶液
,
通电一段时间后
,
向所得溶液中加入
0.1 mol Cu
2
(OH)
2
CO
3
后恰好恢复到电解前的状态
(
不考虑
CO
2
溶解
),
电解池的阳极反应为
,
整个过程中转移的电子数目
。
答案
解析
解析
关闭
答案
解析
关闭
-
57
-
对点训练
1
.
用惰性电极电解一定量的硫酸铜溶液
,
实验装置如图
1
所示。电解过程中的实验数据如图
2
所示
,
横坐标表示电解过程中转移电子的物质的量
,
纵坐标表示电解过程中产生气体的总体积
(
标准状况
)
。则下列说法中正确的是
(
)
图
1
图
2
-
58
-
A.
电解过程中
,b
电极表面先有红色物质析出
,
然后才有气泡产生
B.
从开始到
Q
点时收集到的混合气体的平均相对分子质量为
17
C.
曲线
PQ
段表示
O
2
的体积变化
答案
解析
解析
关闭
答案
解析
关闭
-
59
-
2
.500 mL KNO
3
和
Cu(NO
3
)
2
的混合溶液中
c
( )=0.6 mol·L
-1
,
用石墨作电极电解此溶液
,
当通电一段时间后
,
两极均收集到
2.24 L
气体
(
标准状况下
),
假定电解后溶液体积仍为
500 mL,
下列说法正确的是
(
)
A.
原混合溶液中
c
(K
+
)
为
0.2 mol·L
-1
B.
上述电解过程中共转移
0.2 mol
电子
C.
电解得到的
Cu
的物质的量为
0.05 mol
D.
电解后溶液中
c
(H
+
)
为
0.2 mol·L
-1
答案
解析
解析
关闭
答案
解析
关闭
相关文档
- 2020年高考化学一轮复习课件:模块3 2021-07-06122页
- 2020届天津高考化学一轮复习 物质2021-07-0638页
- 2021届高考化学一轮复习化学平衡常2021-07-0623页
- 2021届高考化学一轮复习化学实验方2021-07-0613页
- 2021高考化学一轮复习专题5第1讲原2021-07-0645页
- 2021版高考化学一轮复习专题9有机2021-07-0698页
- 2021版高考化学一轮复习课时提升作2021-07-069页
- 2020届高考化学一轮复习必修1模块2021-07-0614页
- 2020届高考化学一轮复习(苏教版) 从2021-07-067页
- 全国版2021高考化学一轮复习课时作2021-07-068页