- 3.11 MB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
4
节
氮及其化合物
考纲点击:
1.
了解氮元素
单质及其重要化合物的制备方法,
掌握其主要性质及其应用。
2.
了解氮元素单质及其重要化合物
对环境的影响。
回归教材
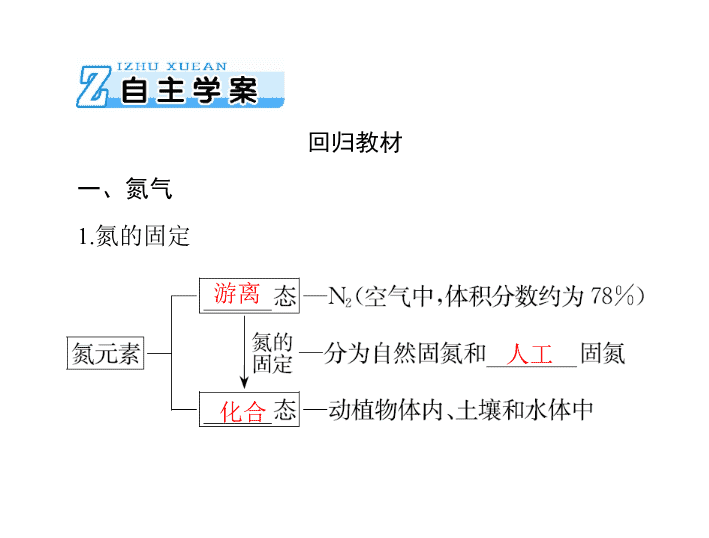
一、氮气
1.
氮的固定
游离
人工
化合
2.
氮的性质
小于
(1)
物理性质:无色无味气体,密度略
_______
空气,难溶
于水。
(2)
化学性质
①N
2
与
O
2
的反应:
N
2
+
O
2
②N
2
与
H
2
的反应:
N
2
+
3H
2
③N
2
与
Mg
的反应:
3Mg
+
N
2
2NO
;
2NH
3
;
Mg
3
N
2
。
二、氮的氧化物
酸性
1.
氮的氧化物有多种,氮元素从+
1
~+
5
价都有对应的氧
化物,+
4
价氧化物有
NO
2
、
N
2
O
4
,且只有
N
2
O
3
和
N
2
O
5
属于
________
氧化物。
2.
一氧化氮与二氧化氮
无
红棕
光化学烟雾
NO
NO
2
物理性质
通常为
____
色气体,不溶于水
通常为
________
色、有刺激性气味的气体
化学性质
与
O
2
反应
2NO
+
O
2
===2NO
2
—
与
H
2
O
反应
不反应
3NO
2
+
H
2
O===
2HNO
3
+
NO
与人体、环
境的关系
①
形成
__________
,污染空气。
②
形成酸雨。
③
破坏臭氧层。
④
与血红蛋白结合使人中毒
[
特别提醒
]
1.
氮的氧化物
氮的氧化物都有毒,主要包括
N
2
O
、
NO
、
N
2
O
3
、
NO
2
、
N
2
O
4
、
N
2
O
5
共六种,其中
NO
2
与
N
2
O
4
存在下列平衡:
2NO
2
N
2
O
4
。
2.
氮氧化物对环境的污染及防治
(1)
常见的污染类型
①
光化学烟雾:
NO
x
在紫外线作用下,与碳氢化合物发生
一系列光化学反应,产生的一种有毒的烟雾。
②
酸雨:
NO
x
排入大气中后,与水反应生成
HNO
3
和
HNO
2
,
随雨雪降到地面。
(2)
常见的
NO
x
尾气处理方法
①
碱液吸收法
2NO
2
+
2NaO
H===NaNO
3
+
NaNO
2
+
H
2
O
NO
2
+
NO
+
2NaOH===2NaN
O
2
+
H
2
O
NO
2
、
NO
的混合气
体能被足量烧碱溶液完全吸收的条件是
n
(NO
2
)≥
n
(NO)
。一般适合工业尾气中
NO
x
的处理。
②
催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气
体
(N
2
)
或
NO
x
与
CO
在一定温度下催化转化为无毒气体
(N
2
和
CO
2
)
。一般适用于汽车尾气的处理。
三、硝酸
1.
硝酸的物理性质
(1)
纯硝酸为
________
、有
__________
气味的液体。
(2)
硝酸沸点较低,
______
挥发,在空气中遇水蒸气形成
________
。
无色
刺激性
易
白雾
[
特别提醒
]
质量分数在
69%
以上的硝酸称为浓硝酸,质量
分数在
98%
以上的硝酸为发烟硝酸。
2.
化学性质
(1)
强酸性
变红
稀硝酸使紫色石蕊试液
________
。
(2)
不稳定性
_________________________________________________
。
(3)
强氧化性
氧化
氧化
变红
硝酸无论浓、稀都有强
________
性,而且浓度越大
______
性越强。
浓硝酸可使紫色石蕊试液先
________
后褪色。
①与金属反应
稀硝酸与铜反应:
_________________________________________________
。
浓硝酸与铜反应
_________________________________________________
。
3Cu
+
8HNO
3
(
稀
)===3Cu(NO
3
)
2
+
2NO↑
+
4H
2
O
Cu
+
4HNO
3
(
浓
)===Cu(NO
3
)
2
+
2NO
2
↑
+
2HO
②
与非金属
(C)
反应
_________________________________________________
。
③与还原性化合物反应
硝酸可氧化
H
2
S
、
Na
2
SO
3
、
FeSO
4
、
KI
、
NaBr
等还原性物
质。如稀硝酸与
FeSO
4
溶液反应的离子方程式:
_________________________________________________
。
CO
2
↑
+
4NO
2
↑
+
2H
2
O
C
+
4HNO
3
(
浓
)
(4)
与有机物反应
反应
)
①
硝化反应
(
与
②颜色反应
黄色
某些蛋白质遇浓硝酸时变
________
。
→NO
2
,
HNO
3
(
稀
)→NO
。极稀也可以还原为
NH
4
。
[
特别提醒
]
(1)
浓、稀硝酸均具有强氧化性,浓度越大,氧
化性越强,其还原产物的价态越高。还原产物一般为
HNO
3
(
浓
)
+
(2)
浓硝酸能使紫色石蕊溶液先变红后褪色,该反应过程中
浓硝酸表现出强酸性和强氧化性。
(3)
常温下,铁、铝遇浓硝酸能发生
“
钝化
”
并非不反应。
(4)
浓硝酸显黄色的是
HNO
3
见光或受热发生分解,生成的
NO
2
溶于其中所致;消除的方法是通入
O
2
(
或空气
)
,使其发生
反应
4NO
2
+
O
2
+
2H
2
O===4HNO
3
。浓硝酸应保存在棕色试剂瓶
中,并置于阴凉处。
四、氨
无色
刺激性气味
气体
小
1.
物理性质
颜色:
________
,气味:
____________
,状态:
________
,
密度比空气
____
,易
________
,
________
溶于水。在常温常压
下,
1
体积
H
2
O
能溶解
______
体积氨气。
2.
化学性质
液化
极易
700
NH
4
+
OH
-
,氨气溶
于水得氨
(1)
氨气与水的反应
NH
3
+
H
2
O
NH
3
·H
2
O
+
水,氨水中含有的粒子有
_________________________________
。
氨水为可溶性一
元弱碱,易挥发,不稳定,易分解:
NH
3
·H
2
O
____________
。
(2)
氨气与酸的反应:蘸有浓盐酸的玻璃棒与蘸有浓氨水的
玻璃棒靠近,其现象为
____________
,将浓盐酸改为
_________
,
也会出现相同的现象。
白烟生成
浓硝酸
NH
3
↑
+
H
2
O
[
特别提醒
]
氨气具有较
强的还原性,还可以发生下列反应:
3.
氨气的实验室制法
向下排空气法
蓝色
白烟
2NH
4
Cl
+
Ca(OH)
2
2NH
3
↑
+
CaCl
2
+
2H
2
O
[
特别提醒
]
氨气实验室
制法的注意事项
(1)
实验室用固体铵盐与碱共热制
NH
3
时 , 不能使用
NH
4
HCO
3
、
NH
4
NO
3
及
NaOH
固体,因为
NH
4
HCO
3
受热分解产
生
CO
2
,使制得的
NH
3
不纯;
NH
4
NO
3
受热时易发生爆炸;
NaOH
容易吸水结块,不利于
NH
3
的产生和逸出,且加热条件下
NaOH
容易腐蚀玻璃。
(2)
干燥氨气时不能选用酸性干燥剂,如浓硫酸、
P
2
O
5
等,
也不能选用无水
CaCl
2
,因为它们均能与
NH
3
发生反应,通常
选用碱石灰。
(3)
吸收氨气
(
或
HCl)
时要注意防止倒吸。
可用于吸收氨气
(
或
HCl)
并能防倒吸的常用装置
为:
4.
氨的用途
化工原料,用于制硝酸、铵盐、纯碱、尿素,用作制冷剂。
五、铵盐
1.
物理性质:都是
________
固体,都易溶于水。
2.
化学性质
(1)
不稳定性
白色
基础测评
1.
随着我国汽车
年销量的大幅增加,空气环境受到了很大
的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用
的过程如图所示,下列说法正确的是
(
)
。
A.
反应中
NO
为氧化剂,
N
2
为氧化产物
B.
汽车尾气的主要污染成分包括
CO
、
NO
和
N
2
C.NO
和
O
2
必须在催化剂表面才能反应
答案:
D
2.(2018
年山东滨州检测
)NH
3
是一种重要的化工原料,可以
制备一系列物质
(
如图
)
。下列说法正确的是
(
)
。
A.NH
4
Cl
和
NaHCO
3
都是常用的化肥
B.NH
4
Cl
、
HNO
3
和
Na
2
CO
3
受热时都易分解
C.NH
3
和
NO
2
在一定条件下可以发生氧化还原反应
D.
图中所涉及的盐类物质均可发生水解反应
答案:
C
3.
下列对于硝酸的认识,不正确的是
(
)
。
A.
浓硝酸的氧化性强于稀硝酸
B.
铜与
HNO
3
的反应属于置换反应
C.
金属与
HNO
3
反应不产生氢气
D.
可用铁和铝质容器盛装浓硝酸
解析:
硝酸是氧化性酸,且浓硝酸的氧化性强于稀硝酸;
铜与浓、稀硝酸反应的还原产物分别是
NO
2
和
NO
,没有单质
生成,故不属于置换反应;硝酸是氧化性酸,金属与
HNO
3
反
应均不产生
H
2
;铁与铝遇冷浓硝酸钝化,故可用铁或铝质容器
盛装浓
HNO
3
。
答案:
B
. . .
4.NH
3
及其盐都
是重要的化工原料。
(1)
用
NH
4
Cl
和
Ca(OH)
2
制备
NH
3
,反应发生、气体收集和
尾气处理装置依次为
____________
。
(2)
按下图装置进行
NH
3
的性质实验。
①
先打开旋塞
1
,
B
瓶中的现象是
________________
,原
因是
____________________________
。稳定后,关闭旋塞
1
。
②再打开旋塞
2
,
B
瓶中的现象是
____________________
________________________
。
解析:
(1)
氨气的实验室制取采用的是固固加热装置,氨气
密度比空气小且极易溶于水,所以选
A
、
C
、
G
。
(2)
由于
A
中
压强比
B
中大,所以当打开旋塞
1
,
A
中的
HCl
会进入
B
中与
NH
3
反应生成氯化铵,产生大量的白烟;再打开旋塞
2
,由于
氯化氢和氨气反应生成了固体氯化铵,所以会导致烧瓶内的压
强减小,烧杯中的石蕊溶液会倒流进入
B
瓶,且溶液变红。
答案:
(1)A
、
C
、
G
(2)
产生白烟
氯化氢与氨气反应生成了氯化铵小颗粒,氯
化铵小颗粒形成白烟
②烧杯中的石蕊溶液会进入
B
瓶,且溶液显红色
考点一
考向
1
氮气及其氧化物
氮气及其化合物的转化
[
典例
1
](2018
年河南周口模拟
)
关于氮的变化关系图如图:
则下列说法不正确的是
(
)
。
A.
路线①②③是工业生产硝酸的主要途径
B.
路线
Ⅰ
、
Ⅱ
、
Ⅲ
是雷电固氮生成硝酸的主要途
径
C.
上述所有反应都是氧化还原反应
D.
上述反应中只有③属于氮的固定
答案:
D
. . .
①N
2
+
O
2
=
=========2NO
;
[
方法技巧
]
(1)
俗话说“雷
雨发庄稼
”
,这说明雷雨中含有
能被植物吸收利用的化合态的氮。有关的化学方程式如下:
放电或高温
②2NO
+
O
2
==
=2NO
2
;
③
3NO
2
+
H
2
O==
=2HNO
3
+
NO
。
(2)
氮气的用途
①
作焊接金属的保护气;
②
制硝酸和化肥的原料;
③
食品袋中充氮气来防腐。
适合吸收
NO
2
气体的是
(
考向
2
NO
、
NO
2
的性质及对
环境的影响
[
典例
2
](2018
年宁夏银川质检
)
已知常温常压下在
1
L
水中
可溶解
40 L NO
2
,
NO
2
能与
NaOH
溶液发生反应:
2NaOH
+
2NO
2
===NaNO
3
+
NaNO
2
+
H
2
O
。以下各种尾气吸收装置中,不
)
。
A
B
C
D
. .
.
解析:
由于常温常压下在
1 L
水中可溶解
40 L NO
2
,即极
易溶于水,所以在吸收装置中需要防止倒吸,只有
B
中不能防
止倒吸。
答案:
B
考向
3
氮氧化物溶于水的计算
[
典例
3
](2018
年河北衡水检测
)
如图所示,相同条件下,两
个容积相同的试管分别装满
NO
2
和
NO
气体,分别倒置于水槽
中,然后通过导管缓慢通入氧气,边通边慢慢摇
动试管,直到
两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则
两个试管内溶液中溶质的物质的量浓度之比为
(
)
。
A.1∶1
B.5∶7
C.7∶5
D.4∶3
解析:
4NO
2
+
O
2
+
2H
2
O===4HNO
3
、
4NO
+
3O
2
+
2H
2
O===
4HNO
3
,
V
(NO
2
)
=
V
(NO)
,
n
(NO
2
)
=
n
(NO)
,则生成的
HNO
3
物
质的量相等,溶液的体积也相同,故两个试管内溶液中溶质的
物质的量浓度相等。
答案:
A
[
方法技巧
]
氮的氧化物与
O
2
、
H
2
O
反应的计算方法
1.
关系式法
(1)NO
和
O
2
的混合气体通入水中。
由
2NO
+
O
2
===2NO
2
和
3NO
2
+
H
2
O===2HNO
3
+
NO
得总
反应为
4NO
+
3O
2
+
2H
2
O===4HNO
3
(2)NO
2
和
O
2
的混合气体通入水中。
由
3NO
2
+
H
2
O===
2HNO
3
+
NO
和
2NO
+
O
2
===2NO
2
得总
反应为
4NO
2
+
O
2
+
2H
2
O===4HNO
3
(3)NO
、
NO
2
和
O
2
的混合气体通入水中。
先按
3NO
2
+
H
2
O===2
HNO
3
+
NO
计算出生成
NO
的体积,
再加上原来混合气体中
NO
的体积,再按
(1)
中关系计算。
2.
电子守恒法
当
NO
x
转化为硝酸时要失去电子,如果是
NO
x
与
O
2
混合,
则反应中
O
2
得到的电子数与
NO
x
失去的电子数相等。
3.
原子守恒法
4NO
2
+
O
2
和
4NO
+
3O
2
从组成上均相当于
2N
2
O
5
的组成,
都与
N
2
O
5
+
H
2
O===2HNO
3
等效。当
NO
、
NO
2
、
O
2
的混合气体
通入水中时利用混合气体中
N
、
O
原子个数比进行分析判断。
【
拓展演练
】
1.(2018
年辽宁抚顺期末
)
如图所示,将相同条件下的
m
体
积
NO
和
n
体积
O
2
同时通入倒立于水槽中且盛满水的试管内,
m
2
立即变为红棕色。则
m
与
n
的比值为
(
)
。
A.3∶2
B.2∶3
C.8∶3
D.3∶8
充分反应后,试管内残留
—
体积的气体,该气体与空气接触后
2.(2017
年北京卷
)SCR
和
N
SR
技术可有效降低柴油发动机
在空气过量条件下的
NO
x
排放。
(1)SCR(
选择性催化还原
)
工作原理:
①
尿素
[CO(NH
2
)
2
]
水溶液热分解为
NH
3
和
CO
2
,该反应的
化学方程式:
__________________________________________
。
②
反应器中
NH
3
还原
NO
2
的化学方程式:
_______________
____________________
。
③当燃油中含硫量较高时,尾气中
SO
2
在
O
2
作用下会形成
(NH
4
)
2
SO
4
,使催化剂中毒。用化学方程式表示
(NH
4
)
2
SO
4
的形
成:
______________________________
。
④尿素溶液浓度影响
NO
2
的转化,测定溶液中尿素
(
M
=
60
g·mol
-
1
)
含量的方法如下:取
a
g
尿素溶液,将所含氮完全转化
为
NH
3
,所得
NH
3
用过量的
V
1
mL
c
1
mol·L
-
1
H
2
SO
4
溶液吸收完
全,剩余
H
2
SO
4
用
V
2
mL
c
2
mol·L
-
1
NaOH
溶液恰好中和,则尿
素溶液中溶质的质量分数是
____________
。
(2)NSR(NO
x
储存还原
)
工作原理:
NO
x
的储存和还原在不同时段交替进行,如图
a
所示。
图
a
图
b
①
通过
BaO
和
Ba(NO
3
)
2
的相互转化实现
NO
x
的储存和还
原。储存
NO
x
的物质是
________
。
学方程式补充完整:
____________________=======
②
用
H
2
模拟尾气中还原性气体研究了
Ba(NO
3
)
2
的催化还
原过程,该过程分两步进行,图
b
表示该过程相关物质浓度随
时间的变化关系。第一步反应消耗的
H
2
与
Ba(NO
3
)
2
的物质的
量之比是
__________
。
③还原过程中,有时会产生笑气
(N
2
O)
。用同位素示踪法研
究发现笑气的产生与
NO
有关。在有氧条件下
15
NO
与
NH
3
以
一定比例反应时,得到的笑气几乎都是
15
NNO
。将该反应的化
催化剂
15
NNO
+
H
2
O
。
解析:
(1)①
尿素
[CO(NH
2
)
2
]
水溶液热分解为
NH
3
和
CO
2
,
结 合 原 子 守 恒 , 发 生 反 应 的 化 学 方 程 式 为
CO(NH
2
)
2
+
H
2
O
2NH
3
↑
+
CO
2
↑
。②从图中可以看出
NH
3
在催化剂作
用下还原
NO
2
生成氮气和水,根据电子守恒和原子守恒可得此
催化剂
在
O
2
作用下与
NH
3
、
H
2
O
反应形成
(NH
4
)
2
SO
4
,此反应中
SO
2
是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反
应的化学方程式为
2SO
2
+
O
2
+
4NH
3
+
2H
2
O===2(NH
4
)SO
4
。
反应的化学方程式为
8NH
3
+
6NO
2
======7N
2
+
12H
2
O
。③
SO
2
催化剂
是
BaO
。②由图示可知,第一步反应为
H
2
与
Ba(NO
3
)
2
作用生
成
NH
3
,每摩尔
Ba(NO
3
)
2
作用生成
NH
3
共转移
16 mol
电子,
根据电子守恒,参加反应的氢气的物质的量为
16 mol÷2
=
8 mol
,则消耗的
H
2
与
Ba(NO
3
)
2
的物质的量之比是
8∶1
。③反
应物有
15
NO
与
NH
3
,结合产物中有水,可知还有另一反应物
O
2
,反应中
NH
3
是还原剂,
15
NO
与
O
2
是氧化剂,因含氮产物
均为
15
NNO
,则
15
NO
与
NH
3
以
1∶1
参加反应,结合电子守恒
和原子守恒可得此反应的化学方程式为
4
15
NO
+
4NH
3
+
3O
2
=======4
15
NNO
+
6H
2
O
。
考点二
考向
1
氨和铵盐
氨气的主要性质及应用
[
典例
4
]
如图,利用培养皿探究氨气的性质。实验时向
NaOH
固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对
实验现象所做的解释正确的是
(
)
。
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH
3
与浓盐酸挥发的
HCl
气
体反应产生了
NH
4
Cl
固体
B
浓硫酸附近无明显现象
NH
3
与浓
硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是
AlCl
3
溶液
D
干燥红色石蕊试纸不变色,
湿润的红色石蕊试纸变蓝
NH
3
是一
种可溶性碱
解析:
B
中的浓硫酸易与
NH
3
发生反应;
C
中,该溶液也
可能是
MgCl
2
溶液等;
D
中
NH
3
·H
2
O
是碱,而
NH
3
不属于碱。
答案:
A
[
方法技巧
]
理解
NH
3
性质应注意问题
(1)NH
3
是中学化学
中唯一的碱性气体,可在推断题中作为
解题的突破口,确定
NH
3
的存在。
(3)NH
3
是非电解质,不是碱;而
NH
3
·H
2
O
是电解质,是碱。
(4)NH
3
催化氧化的产物是
NO
不是
NO
2
。
案,下列有关操作不可能引发喷泉现象的是
(
)
。
考向
2
喷泉实验
[
典例
5
]
如图是课外活动小组的同学设计的
4
个喷泉实验方
A.
挤压装置①的胶头滴管使
CCl
4
全部进入烧瓶,片刻后打
开弹簧
夹
. . .
B.
挤压装置②的胶头滴管使
NaOH
溶液全部进入烧瓶,片
刻后打开弹簧夹
C.
用鼓气装置从装置③的
a
处不断鼓入空气并打开弹簧夹
D.
向装置④的水槽中慢慢加入足量浓硫酸并打开弹簧夹
解析:
①
中的
Cl
2
易溶于
CCl
4
,使圆底烧瓶中压强减小,
使烧杯中的
NaOH
溶液进入烧瓶形成喷泉;②中的
NO
与
NaOH
溶液不反应,圆底烧瓶内的压强不改变,不会形成喷泉;③中
因鼓入空气使锥形瓶内气压增大,使水进入烧瓶而形成喷泉;
④中浓
H
2
SO
4
溶于水放热,促使锥形瓶内氨水分解产生
NH
3
,
NH
3
进入烧瓶与
HCl
反应而形成喷泉。
答案:
B
[
方法技巧
]
喷泉实验的原理及应用
(1)
喷泉实验的原理
由于容器内外产生压强差而形成喷泉。气体迅速溶于水或
某种溶液中,容器内压强小于容器外压强,从而产生喷泉,依
据这一原理,只要能够造成容器内气体大量溶于液体,就可以
形成喷泉。
(2)
引发喷泉的几种方法
①
使烧瓶内的气体迅速溶于水或某种液体中。
②
使烧瓶内气体温度降低,从而使气压减小。
③
使待喷液面上的气压增大。
(3)
喷泉实验的几种常见装置
说明:装置
②
中最好采用
顶部有孔的烧瓶。装置
③引发喷
泉的方法是打开止水夹,用热毛巾
或双手捂热烧瓶,松开后片
刻即形成喷泉现象。
(4)
形成喷泉的类型
下面是几种常见的能形成喷泉的气体和液体。
气体
HCl
NH
3
CO
2
、
Cl
2
、
SO
2
、
H
2
S
NO
2
NO
、
O
2
(4
∶
3)
NO
2
、
O
2
(4
∶
1)
吸收剂
水、
NaOH
溶液
水
NaOH
溶液
水
水
水
考向
3
氨气制备与性质综合探究
[
典例
6
](2018
届河南濮阳二模
)
为探究氨气的还原性,某同
学设计了
下列实验装置
(
其中夹持装置略去
)
,在实验室中进行
实验探究。回答下列问题:
(1)
仪器
b
的名称是
____________
,试解释该装置中产生
NH
3
的原理:
___________________________________
。
2H
+
===Cu
2+
+
Cu
+
H
2
O
。某同学取上述反应后玻璃管内
的物质
(2)
装置乙中盛有的试剂名称是
__________________
。
(3)
装置戊中浓硫酸的作用是
________________________
。
(4)
+
1
价
Cu
在酸性环境中不稳定,可发生反应:
Cu
2
O
+
于试管中,加入稀硫酸,振荡后发现溶液为蓝色,且试管底部
有红色
Cu
,他得出结论:
NH
3
还原
CuO
生成
Cu
2
O
。该同学的
判断是否正确?
________(
填
“
正确
”
或
“
不正确
”
)
,理由是
__________________________________________________
。
(5)
已知装置丙的玻璃管内
CuO
粉末为
m
g
,实验结束后测
得玻璃管内固体粉末为
n
g
,若
CuO
完全被还原为
Cu
,则
m
∶
n
=
______
; 写 出 玻 璃 管 内 发 生 反 应 的 化 学 方 程 式 :
______________________________
。装置丁中的干燥管增重为
______g(
用含
m
或
n
的代数式表示
)
。
NH
3
·H
2
O===NH
4
+
OH
-
,
NaOH
在氨水中电离产生
OH
-
,使平
解析:
根据实验目的“探究氨气的还原性”,结合流程图
可知,甲中浓氨水与氢氧化钠固体作用放出氨气,经过乙的干
燥得到干燥的氨气,在丙中与氧化铜反应生成铜和氮气,以及
水蒸气。丁可以吸收生成的水蒸气,戊中浓硫酸可以吸收未反
应的氨气,防止污染,同时可以防止空气中的水蒸气进入装置丁。
(1)
根据装置图,仪器
b
为锥形瓶,该装置中
NH
3
+
H
2
O
+
衡逆向移动,且
NaOH
溶解放热,使氨水
分解,放出氨气。
(2)
装置乙的作用是干燥氨气,可以选用碱石灰。
(3)
装置戊中浓
硫酸可以吸收
NH
3
尾气,防止空气中的水蒸气进入装置丁。
[
方法技巧
]
1.
氨气的快速制法。
(1)
加热浓氨水
(
如图甲
)
:
NH
3
·H
2
O
甲
NH
3
↑
+
H
2
O
。
乙
(2)
浓氨水中加入固体
NaO
H(
如图乙
)
:
NaOH
溶于水放热,
促使氨水分解,且
OH
-
浓度的增大有利于
NH
3
的生成。
(3)
浓氨水中加入固体
CaO(
如图乙
)
:
CaO
与水反应,使溶
剂
(
水
)
减少;反应放热,促使氨水分解。反应的化学方程式为
NH
3
·H
2
O
+
CaO===NH
3
↑
+
Ca(OH)
2
。
2.NH
3
吸收装置
的创新
中,下列根据实验现象得出的结论不正确的是
(
)
。
考向
4
铵盐的性质
[
典例
7
](2018
年辽宁大连期末
)
探究氨气及铵盐性质的过程
A.
将集有氨气的试管倒扣于水槽中,液体迅速充满试管,
说明氨气极易溶于水
. . .
石蕊试纸变蓝的气体,说明氨水中含有
NH
4
B.
向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色
+
C.
加热
NH
4
HCO
3
固体,观察到固体逐渐减
少,试管口有液
滴产生,说明
NH
4
HCO
3
具有热不稳定性
D.
将红热的
Pt
丝伸入上图所示
的锥形瓶中,瓶口出现少量
的红棕色气体,说明氨气催化氧化的产物中有
NO
答案:
B
NH
4
的检
验方法
[
方法技巧
]
+
【
拓展演练
】
3.(2017
年山东泰安模拟
)
某化学兴趣小组利用图
1
装置制
取氨气并探究氨气的有关性质。
图
1
备选装置
(
其中水中含酚酞溶液
)
Ⅰ
Ⅱ
Ⅲ
图
2
(1)
装置
A
中烧瓶内试剂可选用
________(
填字母
)
。
a.
碱石灰
b.
浓硫酸
c.
生石灰
d.
五氧化二磷
e.
烧碱
(2)
若探究氨气的溶解性,需在
K
2
的导管末端连接图
2
装置
中的
__________
装置
(
填序号
)
,当装置
D
中集满氨气后,关闭
K
1
、
K
2
,打开
K
3
,引发喷泉的实验操作是
__________________
。
(3)
若探究氨气的还原性,需打开
K
1
、
K
3
,
K
2
处导管连接
制取纯净、干燥氯气装置。
①
用二氧化锰与浓盐酸制取氯气,生成气体必须通过分别
盛有
________
、
____________
试剂的洗气瓶;
②D
中
氨气与氯气反应产生白烟,同时生成一种无色无味
的气体,该反应的化学方程式为
__________________________
。
③
从
K
3
处导管逸出的气体中含有少量
Cl
2
,则
C
装置中应
盛放
__________
溶液
(
填化学式
)
,反应的离子方程式为
______
______________________________
。
===Ca(OH)
2
生成
Ca(OH)
2
]
或烧碱,都会使平衡左移,同时
放出大量的热促进氨气的挥发。碱石灰的成分是烧碱和生
石灰,
原理同上述,都可快速制备氨气。
(2)
氨气极易溶于水,不溶于
CCl
4
,需选择防倒吸装置进行实验探究,因此需选择图
2
中的
Ⅱ
或
Ⅲ
。根据喷泉实验的原理,要使装置
D
发生喷泉现象,
可用热毛巾将烧瓶捂热,
D
中氨气受热膨胀通过导管
与水接触,
即产生
“
喷泉
”
。
(3)①
用二氧化锰与浓盐酸制取的氯气中,混
有氯化氢气体和水蒸气,要得到纯净、干燥的氯气需通过饱和
食盐水除去氯化氢,通过浓硫酸除去水蒸气。②探究氨气具有
还原性,氯气与氨气反应产生白烟,联系
NH
3
+
HCl===NH
4
Cl
可知,“白烟”的成分为氯化铵,氯元素化合价降低,则生成
的“无色无味的气体”必为氨气的氧化产物,可推知为氮气。
③氯气是有毒气体,可与强碱溶液反应,因此可用氢氧化钠溶
液进行尾气吸收。
答案:
(1)ace
(2)Ⅱ
或
Ⅲ
用热毛巾将烧瓶捂热
(
其他合理答案均可
)
(3)①
饱和食盐水
浓硫酸
②3Cl
2
+
8NH
3
===6NH
4
Cl
+
N
2
③NaOH
Cl
2
+
2OH
-
===Cl
-
+
ClO
-
+
H
2
O
4.(2016
年新课标
Ⅰ
卷
)
氮的氧化物
(NO
x
)
是大气污染物之
一,工业上在一定温度和催化剂条件下用
NH
3
将
NO
x
还原生成
N
2
。某同学在实验室中对
NH
3
与
NO
2
反应进行了探究。回答下
列问题:
(1)
氨气的制备。
A
B
C
D
E
F
①
氨气的发生装置可以选择上图中的
________
,反应的化
学方程式为
____________________________________
。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺
序为:发生装置→
______________(
按气流方向,用小写字母表
示
)
。
(2)
氨气与二氧化氮的反应。
将上述收集到的
NH
3
充入注射器
X
中,硬质玻璃管
Y
中加
入少量催化剂,充入
NO
2
(
两端用夹子
K
1
、
K
2
夹好
)
。在一定温
度下按图示装置进行实验。
操作步骤
实验现象
解释原因
打开
K
1
,推动注射
器活塞,使
X
中的气
体缓慢通入
Y
管中
①Y
管中
______
_______________
②
反应的化学方程
式:
_____________
_________________
将注射器活塞退回
原处并固定,待装置
恢复到室温
Y
管中有少量水珠
生成的气态水凝聚
打开
K
2
③_______________
_________________
④_______________
_________________
_________________
解析:
(1)①
在实验室中,利用氢氧化钙与
NH
4
Cl
混合加热
发生分解反应制取氨气,氢氧化钙与
NH
4
Cl
都是固体,固体混
合物加热制取气体,故应选用
A
装置进行,制取氨气,发生反
应的化学方程式为
2NH
4
Cl
+
Ca(OH)
2
CaCl
2
+
2NH
3
↑
+
2H
2
O
;也可以利用
NH
3
·H
2
O
的不稳定性,该物质受热分解产生
氨气和水制取氨气,这时应该选择的装置是装置
B
,反应的化
学方程式是
NH
3
·H
2
O
NH
3
↑
+
H
2
O
;②利用
A(
或
B)
装置制
得的氨气,由于氨气是碱性气体,所以需要利用碱性干燥剂碱
石灰进行干燥,然后再根据氨气的密度比空气小的性质,用向
下排空气法收集,氨气是大气污染物,要进行尾气处理,可利
用其在水中极易溶解的性质,用水作吸收剂进行尾气处理,故
装置的连接顺序为
d→c→f→e→i
。
(2)①NO
2
具有强氧化性,
NH
3
有强还原性,两者相遇,会发生氧化还原反应产生氮气和水,
根据
电子守恒、原子守恒,可得反应的化学方程式:
8NH
3
+
6NO
2
7N
2
+
12H
2
O
,根据反应方程式可知反应现象是
Y
管
内看到红棕色气体慢慢变浅,同时在注射器的内壁有水珠产生;
②根据①分析可知发生该反应的化学方程式是
8NH
3
+
6NO
2
7N
2
+
12H
2
O
;③反应后由于容器内气体的物质的量减少,
所以会使容器内气体压强减小。当打开
K
2
后,烧杯内
NaOH
溶
液在大气压强的作用下会倒吸进入
Y
管内;④溶液进入
Y
管内
的原因是由于该反应是气体体积减小的反应,反应发生导致
装
置内压强降低,在外界大气压的作用下而发生倒吸现象。
答案:
(1)①A
2NH
4
Cl
+
Ca(OH)
2
2NH
3
↑
+
CaCl
2
+
2H
2
O(
或
B
NH
3
·H
2
O
NH
3
↑
+
H
2
O)
②d c f e i
(2)①
红棕色气体慢慢变浅
②8NH
3
+
6NO
2
7N
2
+
12H
2
O
③Z
中
NaOH
溶液产生倒
吸现象
④反应后气体分子数减少,
Y
管中压强小于外压
考点三 硝酸
考向
1
硝酸的性质及应用
[
典例
8](2018
年山东淄博检测
)
下列有关实验操作、现象和
解释或结论都正确的是
(
)
。
A.①②
B.③④
C.②③④
D.②④
序号
实验操作
现象
解释或结论
①
过量的
Fe
粉中加入稀硝酸,充分反应后,滴入
KSCN
溶液
溶液呈红色
稀硝酸将
Fe
氧化为
Fe
3
+
②
浓硝酸久置或光照
变黄色
HNO
3
不稳定易分解
③
Al
箔插入稀硝酸中
无现象
Al
箔表面被
HNO
3
氧化,形成致密的氧化膜
④
用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上
试纸先变红
色后褪色
浓硝酸具有酸性和强氧化性
解析:
过量的铁粉中加入稀
HNO
3
,生成
Fe
2
+
,加入
KSCN
溶液时,颜色不变,故①错误;浓
HNO
3
久置变黄是因为
HNO
3
分解产生的
NO
2
溶于其中,故②正确;
Al
箔遇浓
HNO
3
钝化,
稀
HNO
3
会使
Al
箔溶解,故③错误;浓硝酸具有强酸性和强氧
化性,可使蓝色石蕊试纸先变红后褪色,故④正确。选
D
。
答案:
D
[
方法技巧
]
氧化为
Fe
3
+
。
(3)
向
Ba(
NO
3
)
2
溶液中通入还原性气体
SO
2
可得到
BaSO
4
沉淀。
(4)
向
Fe(
NO
3
)
2
溶液中加入非氧化性酸,如盐酸,
Fe
2
+
能被
(5)
向过量铜与一定量硝酸反应后的混合物中加入非氧化
性酸,铜能继续溶解。
(6)
向含还原性离子的酸性溶液中加入硝酸盐,还原性离子
可被氧化。
考向
2
NO
的制备和验证
[
典例
9
](2017
年江西临川二中测试
)
某校课外活动小组为了
探究铜与稀硝酸反应产生的气体主要是
NO
而设计了下列实
验,装置如图所示
(
加热装置和固定装置均已略去
)
。图中
K
为
止水夹
(
处于关闭状态
)
,
F
是一半空的注射器。请回答有关问题:
(1)
设计装置
A
的目的是
_____________________________
_________________________
。
(2)
在完成
(1)
中的“操作”后,将装置
B
中铜丝插入稀硝酸
并微热之,观察到装置
B
中的现象是
______________
;
B
中反
应的离子方程式为
_____________________________________
。
(3)
装置
E
和
F
的作用是
__________________________
;为
实现此作用,其操作方法是
_____________________________
。
(4)
装置
D
的作用是吸收多余的氮氧
化物,防止污染空气,
兼有
____________
的功
能。
答案:
(1)
产生
CO
2
,赶走装置中的空气,防止因
NO
与
O
2
反应生成
NO
2
而产生干扰
(2)Cu
丝表面产生气泡,稀
硝酸液面上方仍为无色,溶液变
蓝
3Cu
+
8H
+
+
2NO
3
===3Cu
2
+
+
2NO↑
+
4H
2
O
(3)
验证
NO
的生成
将注射器中的空气推入
E
中,若气体
变为红棕色则说明生成了
NO
(4)
防止倒吸
-
考向
3
硝酸浓度对氧化性的影响
[
典例
1
0]
某学习小
组探究浓、稀硝酸氧化性的相对强弱,
按下图装置进行实验
(
夹持仪器已略去
)
。实验表明浓硝酸能将
NO
氧化成
NO
2
,而稀硝酸不能氧化
NO
。由此得出的结论是浓
酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知氢氧化
钠溶液不与
NO
反应,能与
NO
2
反应:
2NO
2
+
2NaOH===NaNO
3
+
NaNO
2
+
H
2
O)
硝酸的氧化性强于稀硝酸。
(
可选药品:浓硝酸、
3 mol·L
-
1
稀硝
(1)
实验应避免有害气体排放到空气中。装置③④⑥中盛放
的药品依次是
______________________________
。
(2)
滴加浓硝酸之前的操作是检验装置的气密性,加入药
品,打开弹簧夹后,
________________________________
。
(3)
装置①中发生反应的化学方程式是
________________
__________________
。
(4)
装置②的作用是
____________________
,发生反应的化
学方程式是
__________________________
。
(5)
该小组得出的结论依据的实验现象是
_______________
__________________
。
(6)
实验结束后,同学们发现装置①中溶液呈绿色,而不显
蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而
乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了
以下
4
个实验来判断两种看法是否正确。这些方案中可行的是
__________(
填字母序号
)
。
a.
加热该绿色溶液,观察颜色变化
b.
加水稀释该绿色溶液,观察颜色变化
c.
向该绿色溶液中通入氮气,观察颜色变化
d.
向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,
观察颜色变化
解析:
本题要证明浓硝酸能将
NO
氧化成
NO
2
,而稀硝酸
不能氧化
NO
。①产生
NO
2
,而非
NO
,所以②中盛水与
NO
2
反应生成
NO
。而
NO
极易与
O
2
反应产生
NO
2
,故反应前应用
CO
2
将装置中的空气排尽。
(6)
的思路是从溶液中赶出
NO
2
,或
在
Cu(NO
3
)
2
溶液中通入
NO
2
,不能采用稀释绿色溶液的方案,
是因为
Cu(NO
3
)
2
溶液稀释后,颜色也会发生相应的变化,而不
能得出正确的
结论。
(2)
通入
CO
2
一段时间,关闭弹簧夹,将装置⑤中导管末端
伸入倒置的烧瓶内
(3)Cu
+
4HNO
3
(
浓
)===Cu(NO
3
)
2
+
2NO
2
↑
+
2H
2
O
(4)
将
NO
2
转化为
NO
3NO
2
+
H
2
O===2HNO
3
+
NO
(5)
装置③中液面上方气体仍为无色,装置④中液面上方气
体由无色变为红棕色
(6)acd
答案:
(1)3 mol·L
-
1
稀硝酸、浓硝酸、氢氧化钠溶液
[
方法技巧
]
硝酸在氧化还原反应中,其还原产物可能有
验证明,硝酸浓度越大,得电子的能力越强,因而其氧化能力
越强。由铜与硝酸反应的化学方程式知,浓硝酸被还原为
NO
2
,
氮元素的化合价变化为+
5→
+
4
;稀硝酸被还原为
NO
,氮元
素的化合价变化为+
5→
+
2
。一般情况下,硝酸的浓度越小,
金属活动性越强,其还原产物的价态越低。
考向
4
硝酸与金属反应的计算
[
典例
1
1]
将
32.64 g
铜与
140 mL
一定浓度的硝酸反应,铜
完全溶解,产生的
NO
和
NO
2
混合气体在标准状况下的体积为
11.2 L
。请回答下列问题:
(1)NO
的体积为
________ L
,
NO
2
的体积为
________L
。
(2)
参加反应的
HNO
3
的物质的量是
__________
。
(3)
待产生的气体全部释放后,向溶液中加入
V
mL
a
mol·
L
-
1
的
NaOH
溶液,恰好使溶液中的
Cu
2
+
全部转化成沉淀,则
(4)
欲使铜与硝酸反应生成的气体在
NaOH
溶液中全部转化
为
NaNO
3
,至少需要
30%
的双氧水
________g
。
原硝酸溶液的浓度为
____ mol·L
-
1
。
-
1
=
0.51 mol
,设混合气体中
NO
解析:
(1)
n
(Cu)
=
32.64 g
64 g·mol
的物质的量为
x
,
NO
2
的物质的量为
y
。
根据气体的总体积为
11.2 L
,有
x
+
y
=
0.5 mol
。
根据得失电子守恒,有
3
x
+
y
=
(0.51×2) mol
。
解得
x
=
0.26 mol
,
y
=
0.24 mol
。
V
(NO
2
)
=
11.2 L
-
5.824 L
=
5.376 L
。
(2)
参加反应的
HNO
3
分两部分:一部分没有被还原,显酸
性,生成
Cu(NO
3
)
2
;另一部分被还原成
NO
2
和
NO
,所以参加
反应的
HNO
3
的物质的量为
0.51 mol×2
+
0.5 mol
=
1.52 mol
。
则
V
(NO)
=
0.26 mol
×
22.4 L·mol
-
1
=
5.824 L
[
方法技巧
]
硝酸与金属
反应的计算
(1)
思维流程
分析所得结论不正确的是
(
【
拓展演练
】
5.(2017
年北京卷
)
下述实验中均有红棕色气体产生,对比
)
。
①
②
③
. . .
A.
由①中的红棕色气体,推断产生的气体一定是混合气体
B.
红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.
由③说明浓硝酸具有挥发性,生成的红棕色气体为还原
产物
D.③
的气体产物中检测出
CO
2
,由此说明木炭一定与浓硝
酸发生了反应
解析:
浓
HNO
3
具有不稳定性,①中浓
HNO
3
受热发生分
解反应:
4HNO
3
4NO
2
↑
+
O
2
↑
+
2H
2
O
,故①中所得红棕色
气体是
NO
2
和
O
2
的混合气体,
A
正确。②中红热木炭加入浓
HNO
3
中,有红棕色气体产生,该气体为
NO
2
,但不能说明浓
HNO
3
与木炭发生了反应,可能是浓
HNO
3
在红热木炭作用下发
生分解产生了
NO
2
,
B
正确。③中红热木炭未插入浓
HNO
3
中,
有红棕色气体产生,说明浓
HNO
3
具有挥发性,且挥发产生的
HNO
3
被还原生成
NO
2
,故红棕色气体为还原产物,
C
正确。
③的气体产物中检测出
CO
2
,不能说明木炭一定与浓
HNO
3
发
生了反应,可能是浓
HNO
3
分解产生
NO
2
、
O
2
和
H
2
O
,红热木
炭与分解产生的
O
2
反应生成
CO
2
,
D
错误。
答案:
D
分析或结果错误的是
(
6.(2018
年山东潍坊质检
)
某稀硫酸和稀硝酸的混合溶液
200 mL
,平均分成两份。向其中一份中逐渐加入铜粉,最多能
溶解
9.6 g
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质
量增加的
变化如下图所示
(
已知硝酸只被还原为
NO
气体
)
。下列
)
。
. .
A.
原混合酸中
NO
3
物质的量为
0.1 mol
-
B.
OA
段产生的是
NO
,
AB
段的反应为
Fe
+
2Fe
3
+
===3Fe
2
+
,
BC
段产生氢气
C.
第二份溶液中最终溶质为
FeSO
4
D.H
2
SO
4
浓度为
2.5 mol·L
-
1
亚硝酸及亚硝酸钠的性质
1.
亚硝酸
(HNO
2
)
亚硝酸是弱酸。向亚硝酸钠溶液中加酸,生成亚硝酸
(HNO
2
)
。亚硝酸不稳定,仅存在于冷的稀溶液中,微热甚至常
温下也会
分解,产生红棕色的二氧化氮气体。
NaNO
2
+
H
2
SO
4
(
稀
)===NaHSO
4
+
HNO
2
2HNO
2
===NO↑
+
NO
2
↑
+
H
2
O
2.
亚硝酸钠
(NaNO
2
)
(1)
亚硝酸钠的物理性质及用途
亚硝酸钠的化学式为
NaNO
2
,是可溶性盐。其熔点为
271 ℃
,分解温度为
320 ℃
。
亚硝酸钠在建筑业中常用作混凝土掺加剂,以促进混凝土
凝固,提高其强度,防止在冬天低温施工时混凝土发生冻结。
亚硝酸钠还是一种食品添加剂,用作食品防腐剂和肉类食
品的发色剂。
(2)
亚硝酸钠的氧化性
在亚硝酸钠中,氮的化合价为+
3
,处于中间价态。因此,
亚硝酸钠与强还原性物质反应时,表现出氧化性。如亚硝酸钠
与碘化钾反应可生成单质碘。
毒事故发生,它的部分性质如图,下列说法错误的是
(
[
典例
]
亚硝酸钠
(NaNO
2
)
是一种具有咸味、有毒,且价格
比
食盐
(NaCl)
便宜的工业用盐,常被误作食盐使用,导致多
起中
)
。
. .
A.
可用淀粉碘化钾试纸和食醋鉴别食盐
(NaCl)
与亚硝酸钠
(NaNO
2
)
B.
亚硝酸钠可以加到食品中,但添加量要符合规定
C.NaNO
2
与
N
2
H
4
反应生成
NaN
3
的化学方程式为
NaNO
2
+
N
2
H
4
===NaN
3
+
2H
2
O
D.
上图所涉及的化学反应都是氧化还原反应
价变为-
—
价,
C
正确;有电子
转移的化学反应为氧化还原反应,
解析:
亚硝酸钠能和
KI
反应生成碘单质,淀粉
溶液遇碘变
蓝色,
A
正确;
NaNO
2
具有防腐性,但有毒,所以亚硝酸钠可
以加到食品中,但添加
量要符合规定,
B
正确;亚硝酸钠和肼
反应生成叠氮化钠和水,该反应中
N
元素化合价由+
3
价、-
2
1
3
其特征是有元素化合价升降,
NaNO
2
与
NH
4
Cl
反应生成
NH
4
NO
2
没有化合价的变化,
D
错误。
答案:
D
[
演练
]
(2018
年湖北咸宁模拟
)NaNO
2
在漂白、电镀和金属
处理等方面有重要应用。
(1)
将等物质的量的一氧化氮和二氧化氮通入氢氧化钠溶
液中便可制得
NaNO
2
,写出离子方程式:
__________________
_____________________________________________________
。
(2)
在酸性条件下,当
NaNO
2
与
KI
按物质的量
1∶1
恰好完
全反应,且
I
-
被氧化为
I
2
时,产物中含氮的物质为
___________
(
填化学式
)
。
(3)
亚硝酸
(HNO
2
)
是与醋酸酸性相当的弱酸,很不稳定,通
常在室温下立即分解。要得到稳定的
HNO
2
溶液可以往冷冻的
浓
NaNO
2
溶液中加入或通入某种物质,下列物质不适合使用
的
是
________(
填字母
)
。
a.
稀硫酸
c.
二氧化硫
b.
二氧化碳
d.
磷酸
含
Al
、
NaAlO
2
、
NaNO
2
、
NaOH
、
NH
3
、
H
2
O
六种物质,将此
反应中氧化剂和还原剂的化学式及其配平后的系数分别
填入下
2NO
2
+
H
2
O
。
(2)
碘离子被氧化为碘单
质时,所有的碘元素化合
解析:
(1)
根据信息:等物质的量的一氧化氮和二氧化氮通
入氢氧化钠溶液中便可制得
NaNO
2
,即
NO
+
NO
2
+
2OH
-
===
-
价升高了
2
价,消耗碘离子
2 mol
,亚硝酸钠中氮元素化合价是
+
3
价,
2 mol
的亚硝酸钠得到
2 mol
电子时,则需氮元素的化
合价降为+
2
价,所以产物中含氮的物质为
NO
。
(3)
浓
NaNO
2
溶液中通入二氧化碳,由于
H
2
CO
3
比
HNO
2
酸性弱,不能制取
HNO
2
;如果通入二氧化硫,会被亚硝
酸氧化为硫酸,即二氧化
硫具有还原性,亚硝酸具有氧化性。
(4)
亚硝酸钠具有氧化性,
法将废水中
NO
2
转换为
N
2
除去,根据电解池的阴极上
发生得
金属铝具有还原性,碱性条件下,二者发生氧化还原反应生成
偏铝酸盐和一水合氨,反应方程式为
2Al
+
NaNO
2
+
NaOH
+
2H
2
O===2NaAlO
2
+
NH
3
·H
2
O
;该反应中氢氧根离子参加反应,
导致溶液中氢氧根离子浓度减小,则溶液的
pH
减小;用电解
-
电子的还原反应,所以
N
2
将在阴极产生。
相关文档
- 【化学】河北省2020届高三全国Ⅰ卷2021-07-0614页
- 湖北省黄陂六中2018-2019学年高二2021-07-067页
- 2018-2019学年内蒙古鄂尔多斯市高2021-07-069页
- 黑龙江省安达市第七中学2019-20202021-07-069页
- 陕西省渭南市临渭区尚德中学2020届2021-07-067页
- 2021届湖南长郡中学新高考模拟试卷2021-07-0616页
- 2021届河北衡中同卷新高考模拟试卷2021-07-0616页
- 新疆疏勒八一中2018-2019高二下学2021-07-064页
- 化学卷·2018届黑龙江省大庆实验中2021-07-0629页
- 吉林省扶余市第一中学2018-2019高2021-07-0610页