- 98.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
硫及其化合物
知识结构
1.硫的氢化物、氧化物及其水化物的结构、性质
类别
氢化物
氧 化 物
氧化物水化物
结
构
分子式
H2S
SO2
SO2
H2SO3
H2SO4
化学键
极性键
极性键
极性键
极性键配位
极性键配位
晶体类型
分子晶体
分子晶体
分子晶体
分子晶体
分子晶体
物理性质
色、味、态
无色有臭鸡蛋气味的气体
无色有刺激性气味的气体
无色固体
无色有刺激性气味的液体
无色油状液体
毒性
有毒气体是空气污染物
有毒气体,是空气污染物
无毒腐蚀性强
有毒不稳定
无毒,强腐蚀性
化学
性
质
与水反应
溶于水,不与水反应
SO2+H2O
H2SO3
H2O+SO3
H2SO4
溶于水,不与水反应
溶于水
与金属反应
2Na+H2S
Na2S+H2↑
不反应
不反应
与较活泼金属反应
反应
稳定性
不稳定H2S
H2+S
稳定
较稳定
不稳定
稳定
酸性强弱
弱酸性
弱酸性
强酸性
弱酸性
强酸性
检验
使含Pb2+的湿润试纸变黑或与Cu2+反应生成CuS沉淀
使品红溶液褪色加热又重新出现红色
与BaCl2 稀现象:生成不溶于稀HNO3的白色沉淀
同SO2
同SO2
2.SO2与Cl2的漂白性比较
两种气体虽都有漂白性,但原理及现象又不同。Cl2是由于溶于水生成的HClO有强氧化性 ,将有色物质氧化成无色物质,褪色后不能恢复到原来颜色——永久漂白,而SO2是由于溶于水生成的H2SO3与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定的条件下又能恢复原来的颜色——暂时漂白。
3.可逆反应
在同一条件下,同时向正、逆反应方向进行的反应。
如:2H2+O22H2O,2H2O2H2↑+O2↑
这两个反应条件不同,故不能视为可逆反应。
而2SO2+O22SO3,SO2+H2OH2SO 3发生在同一条件下,它们均为可逆反应。
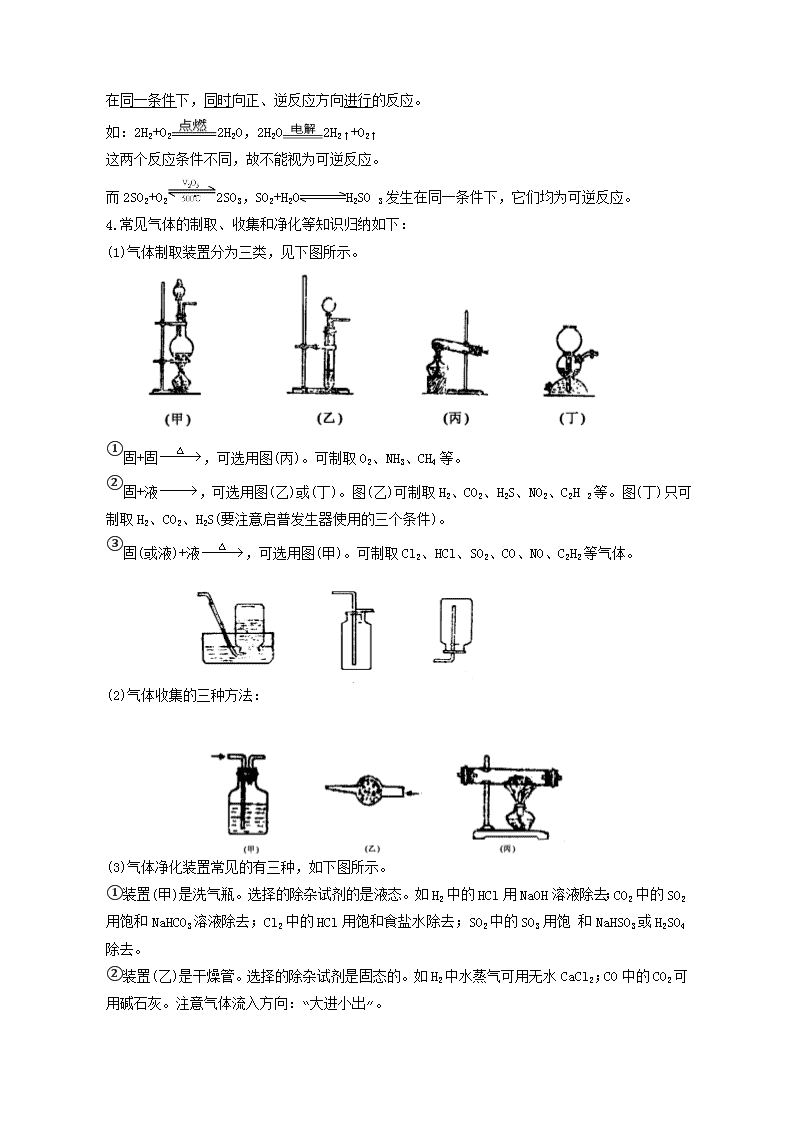
4.常见气体的制取、收集和净化等知识归纳如下:
(1)气体制取装置分为三类,见下图所示。
①固+固,可选用图(丙)。可制取O2、NH3、CH4等。
②固+液,可选用图(乙)或(丁)。图(乙)可制取H2、CO2、H2S、NO2、C2H 2等。图(丁)只可制取H2、CO2、H2S(要注意启普发生器使用的三个条件)。
③固(或液)+液,可选用图(甲)。可制取Cl2、HCl、SO2、CO、NO、C2H2等气体。
(2)气体收集的三种方法:
(3)气体净化装置常见的有三种,如下图所示。
①装置(甲)是洗气瓶。选择的除杂试剂的是液态。如H2中的HCl用NaOH溶液除去;CO2中的SO2用饱和NaHCO3溶液除去;Cl2中的HCl用饱和食盐水除去;SO2中的SO3用饱 和NaHSO3或H2SO4除去。
②装置(乙)是干燥管。选择的除杂试剂是固态的。如H2中水蒸气可用无水CaCl2;CO中的CO2可用碱石灰。注意气体流入方向:“大进小出”。
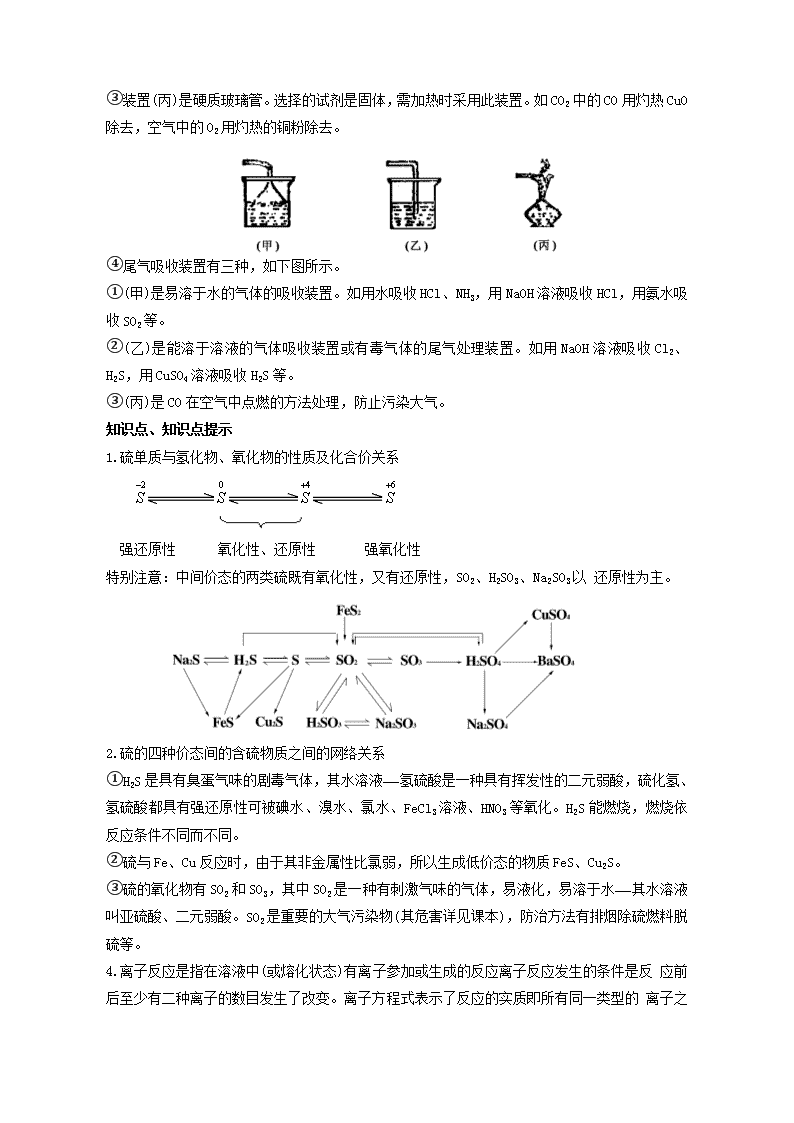
③装置(丙)是硬质玻璃管。选择的试剂是固体,需加热时采用此装置。如CO2中的CO用灼热CuO除去,空气中的O2用灼热的铜粉除去。
④尾气吸收装置有三种,如下图所示。
①(甲)是易溶于水的气体的吸收装置。如用水吸收HCl、NH3,用NaOH溶液吸收HCl,用氨水吸收SO2等。
②(乙)是能溶于溶液的气体吸收装置或有毒气体的尾气处理装置。如用NaOH溶液吸收Cl2、H2S,用CuSO4溶液吸收H2S等。
③(丙)是CO在空气中点燃的方法处理,防止污染大气。
知识点、知识点提示
1.硫单质与氢化物、氧化物的性质及化合价关系
强还原性 氧化性、还原性 强氧化性
特别注意:中间价态的两类硫既有氧化性,又有还原性,SO2、H2SO3、Na2SO3以 还原性为主。
2.硫的四种价态间的含硫物质之间的网络关系
①H2S是具有臭蛋气味的剧毒气体,其水溶液——氢硫酸是一种具有挥发性的二元弱酸,硫化氢、氢硫酸都具有强还原性可被碘水、溴水、氯水、FeCl3溶液、HNO3等氧化。H2S能燃烧,燃烧依反应条件不同而不同。
②硫与Fe、Cu反应时,由于其非金属性比氯弱,所以生成低价态的物质FeS、Cu2S。
③硫的氧化物有SO2和SO3,其中SO2是一种有刺激气味的气体,易液化,易溶于水——其水溶液叫亚硫酸、二元弱酸。SO2是重要的大气污染物(其危害详见课本),防治方法有排烟除硫燃料脱硫等。
4.离子反应是指在溶液中(或熔化状态)有离子参加或生成的反应离子反应发生的条件是反 应前后至少有二种离子的数目发生了改变。离子方程式表示了反应的实质即所有同一类型的
离子之间的反应。其书写原则是:可溶性或微溶性的强电解质写离子形式,多元弱酸的酸式盐写成酸式根形式,其它物质写分子式或化学式。检查离子方程式是否正确的三个规则①质量守恒——微粒种类与数目相等,②电荷守恒——方程式两边电荷总数相等,③得失电子相等——属于氧化还原反应的离子反应中得失电子数相等。离子共存问题应转化为离子之间能否反应来考虑。
5.硫酸的化学性质①不挥发性强酸,如制取HF、HCl、HNO3等②浓硫酸特性(ⅰ)脱水性指将有机物中的H、O元素按水的组成(2∶1)比脱去(ⅱ)吸水性;但不能用浓硫酸干燥NH3、H 2S、HBr、HI等。(ⅲ)强氧化性,但常温下不与Fe、Al等金属反应。
6.H2S燃烧的两个反应:不完全燃烧
2H2S+O22S+2H2O…………a
2H2S+3O22SO2+2H2O………b
①当H2S为定值时,a式表示O2不足,b式表示O2充足;
②当O2为定值时,b式表示H2S不足,a式表示H2S充足;
③当,按a 式反应,产物全是S;
当,按b式反应,产 物全是SO2;
当,按a式和b式反应,产物是S和SO2;
相关文档
- 2020届高考化学一轮复习化学与自然2021-07-0613页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0614页
- 2020年高考化学一轮复习化学反应速2021-07-064页
- 2020届高考化学一轮复习化学平衡常2021-07-0626页
- 2020届高考化学一轮复习化学键作业2021-07-0610页
- 2021届高考化学一轮复习化学平衡常2021-07-0610页
- 2020届高考化学一轮复习化学反应进2021-07-068页
- 2020届高考化学一轮复习化学能与热2021-07-065页
- 2021届高考化学一轮复习化学反应与2021-07-066页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-066页