- 652.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
本章知识整合
[本章知识体系]
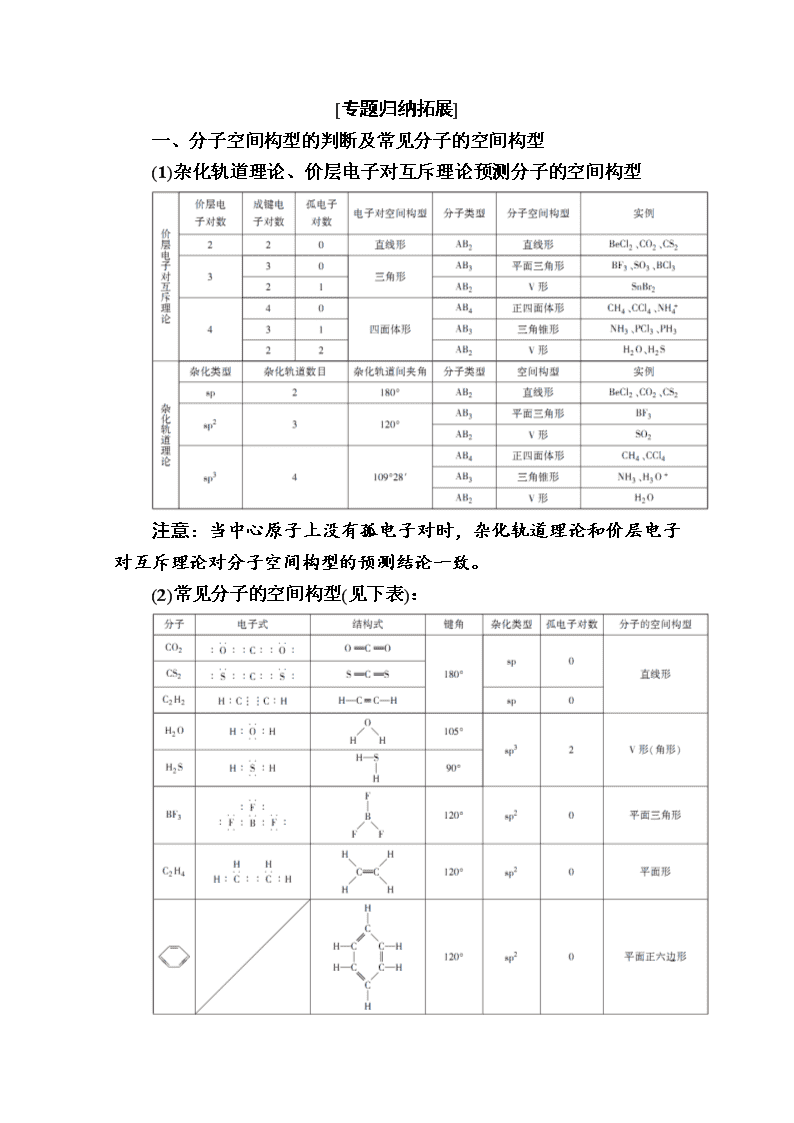
[专题归纳拓展]
一、分子空间构型的判断及常见分子的空间构型
(1)杂化轨道理论、价层电子对互斥理论预测分子的空间构型
注意:当中心原子上没有孤电子对时,杂化轨道理论和价层电子对互斥理论对分子空间构型的预测结论一致。
(2)常见分子的空间构型(见下表):
【例1】 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为________。氧元素与氟元素能形成OF2分子,该分子的空间构型为________。
(2)根据等电子体原理,在NO中氮原子轨道杂化类型是________;1 mol O中含有的π键数目为________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为________。
(4)下列物质的分子与O3分子的结构最相似的是________。
A.H2O B.CO2
C.SO2 D.BeCl2
(5)O3分子是否为极性分子?________。
【解析】 (1)由洪特规则的特例可知,氮元素的第一电离能大于氧元素(大于氮元素的“左邻右舍”),小于氟元素;由价层电子对互斥理论可知,OF2分子的空间构型是V形。(2)根据等电子体原理,NO与CO2互为等电子体,两者的结构相似,NO中氮原子的杂化方式与CO2中碳原子的杂化方式相同,都是sp杂化;O与N2(其中有一个σ键和两个π键)互为等电子体,因此O中有2个π键。(4)(5)可根据价层电子对互斥理论分析,SO2与O3分子的结构最相似,且都是极性分子。
【答案】 (1)F>N>O V形 (2)sp 2NA
(3)1s22s22p63s23p63d3 (4)C (5)是
二、电子式的书写方法
可以用电子式表示原子、分子、离子及离子化合物的组成和结构。
(1)用电子式表示各种粒子的方法
①原子的电子式:
书写原子的电子式时,一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上。例如:
H· Ca · · · · ·
氢原子 钙原子 氮原子 氧原子 氯原子
②离子的电子式:
书写离子的电子式时,简单阳离子因为是原子失去最外层电子后形成的,故只写其元素符号,并在右上角注明所带电荷数,如Na+、Mg2+等;简单阴离子因为得到电子后最外层一般为8电子结构,书写时要在元素符号周围标出电子,用“[ ]”括起来,并在右上角注明所带电荷数,如[]-、[]2-等;较复杂的阴、阳离子一般也要用“[ ]”括起来,如[H]-、[]2-、。
④离子化合物的电子式:
书写组成较复杂的离子化合物的电子
式时,应注意使阴、阳离子直接相邻。如[]-Mg2+[]-(MgCl2)(易错写为Mg2+[]或Mg2+[]-[]-);又如Mg3N2的电子式为Mg2+[]3-Mg2+[]3-Mg2+。
(2)用电子式表示化学键(共价键或离子键)或化合物的形成过程
Cl2: ·+·―→
HBr:H·+·―→H
H2S:H·+· ·+·H―→HH
注意:“―→”左边不能写成分子的电子式。
(3)结构式:用短线“—”表示物质中一对共用电子对的表达式,如N2的电子式为N⋮⋮N,结构式为N≡N;NH的结构式为;CO2的结构式为O===C===O。
(4)典型、易错的物质的电子式、结构式
【例2】 氰(CN)2、硫氰(SCN)2、氧氰(OCN)2的性质相似,在化学上称为拟卤素。CN-、SCN-、OCN-的性质与卤素离子的性质相似。已知:不同卤素原子能形成卤素互化物,如IBr、HSCN为强酸,HClO、HCN为弱酸。试回答下列问题:
(1)下列物质的电子式错误的是( )
A.IBr:
B.HClO:H
C.CN-:[C⋮⋮N]-
D.(CN)2:N⋮⋮CC⋮⋮N
(2)已知(OCN)2的电子式为N⋮⋮CC⋮⋮N,则SCN-的电子式为( )
A.[CN]-
B.[N⋮]-
C.[C⋮⋮N]-
D.C⋮⋮N
【解析】 (1)卤素原子最外层电子数为7,在化合物中一般以一个共用电子对成键。A项中的IBr为卤素互化物,两原子间以一个共用电子对成键,电子式为,A项正确。C项中的CN-,碳原子最外层有四个单电子,N原子最外层有三个单电子,C与N之间可形成三个共用电子对,再得一个电子,使C、N均满足8电子稳定结构,电子式为[C⋮⋮N]-,C项正确。D项中的(CN)2,两个C原子之间以非极性共价键相连,电子式为N⋮⋮CC⋮⋮N,D项正确。B项中的HClO,O原子最外层有两个单电子,分别与Cl原子、H原子形成两个共用电子对,电子式为H,B项错误。
(2)由题给信息(OCN)2的电子式可知,OCN-的电子式应为[C⋮⋮N]-,故SCN-的电子式只需将OCN-中的O换成S即可,为[C⋮⋮N]-。
【答案】 (1)B (2)C
【点评】 共价键中,往往是一个原子最外层有几个单电子,就形成几个共用电子对达到该原子的稳定结构,再结合化学式就可以写出电子式。
三、共价分子中原子最外层8电子结构的判断方法
1.由分子的电子式判断
如CS2的电子式(与CO2相似)为C,表明CS2分子中所有原子最外层达8电子稳定结构。
2.化合价法
(1)含H原子的分子:分子中的氢原子一定不满足原子最外层8电子结构。
(2)不含H原子的分子:分子中不含有氢原子,则看某元素化合价绝对值与其原子最外层电子数之和是否等于8。即“|元素化合价|+最外层电子数”之和是否等于8。如CO2分子中的碳原子:|+4|+4=8;氧原子:|-2|+6=8,都满足最外层8电子结构;再如BF3分子中的硼原子:|+3|+3=6≠8,未达到8电子结构。
(3)非金属单质:若为同种元素构成的双原子分子,则看该元素原子的最外层电子数与其在分子中形成的共价键数之和是否为8即可。若为8,则其原子最外层满足8电子结构;反之,则不能满足。如N2、Cl2等均满足8电子结构。
【例3】 (双选题)下列各分子中所有原子都满足最外层为8电子结构的是( )
A.BeCl2 B.PCl3
C.PCl5 D.N2
【解析】 BeCl2分子中的Be原子最外层只有4个电子,PCl5中的P原子最外层超过8个电子。故选BD。
【答案】 BD
相关文档
- 2020届高考化学一轮复习选修3-2分2021-07-0615页
- 2019届一轮复习人教版分子结构与性2021-07-066页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0618页
- 2020届一轮复习人教全国版第38讲分2021-07-0628页
- 2021新高考化学鲁科版一轮复习突破2021-07-066页
- 2020届高考化学一轮复习苏教版微粒2021-07-069页
- 2019-2020学年高二人教版化学选修2021-07-066页
- 2021版化学名师讲练大一轮复习鲁科2021-07-062页
- 2020版高考化学一轮复习分子结构与2021-07-069页
- 2020届高考化学一轮复习(山东专用) 2021-07-0616页