- 869.00 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
3.(溯源题)(1) Co基态原子核外电子排布式为
____________________
(2017·课标全国Ⅲ,35节选)
(2)Zn2+基态核外电子排布式为________________[ 2016·
江苏化学,21A(1) ]
(3)Cr3+基态核外电子排布式为________________ [2015·
江苏,21A(1)节选]
(4)N的基态原子核外电子排布式为________________ ;
Cu的 基态原子最外
层有________个电子。[2015·安徽理综,25(2)]
(5)Si元素基态原子的电子排布式是
_______________[2015·四川理综,8(1)]
1s22s22p63s23p63d9
1s22s22p63s23p63d3
1s22s22p3
1
1s22s22p63s23p2
1s22s22p63s23p63d74s2
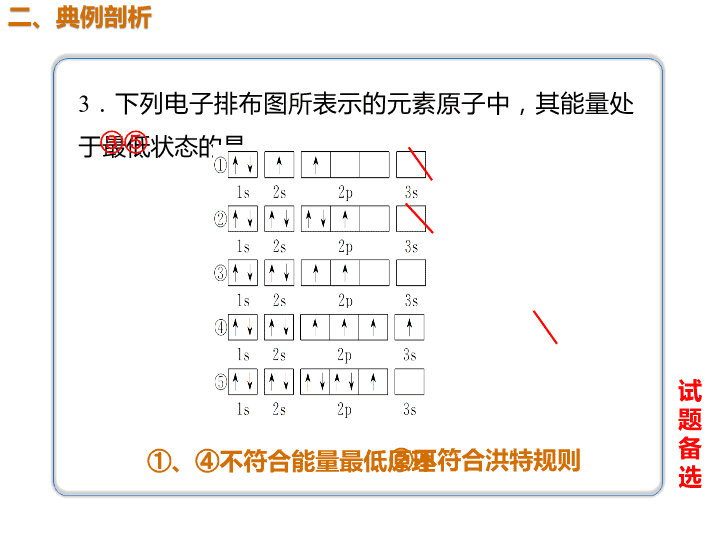
3.下列电子排布图所表示的元素原子中,其能量处
于最低状态的是________。③⑤
①、④不符合能量最低原理
试
题
备
选②不符合洪特规则
2.(2016·昆明模拟)下列各组表述中,两个原子不属
于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的
排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态
原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布
式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数 的原子和最外层
电子排布式为4s24p5的原子
C
洪特规则可得其3p轨道上只能有两个电子
2p能级上只能是5个电子
35号元素,该元素原子的外围电子排布式为4s24p5
【试题备选】
“两原理,一规则”的正确理解
(1)原子核外电子排布符合能量最低原理、洪特规则、泡
利原理,若违背其一,则电子能量不处于最低状态。
易误警示 在写基态原子的电子排布图时,常出现以下
错误:
(2)半充满、全充满状态的原子结构稳定
如ns2、np3、np6;nd5、nd10
Cr:3d54s1 Mn:3d54s2 Cu:3d104s1 Zn:3d104s2
(3)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序
填充,但在书写时,仍把(n-1)d放在ns前。
为了书写和学术交流的方便,采用国际统一的符号来表示各个元
素。
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及
各层上的电子数。
(2)核组成式:如 O,侧重于表示原子核的结构,它能告诉我们
该原子核内的质子数和核外电子数以及质量数,但不能反映核外
电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上
的电子数,但不能表示原子核的情况,也不能表示各个电子的运
动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分
布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,
价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数
和参与成键的电子数以及最外层电子数。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页