- 1.48 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
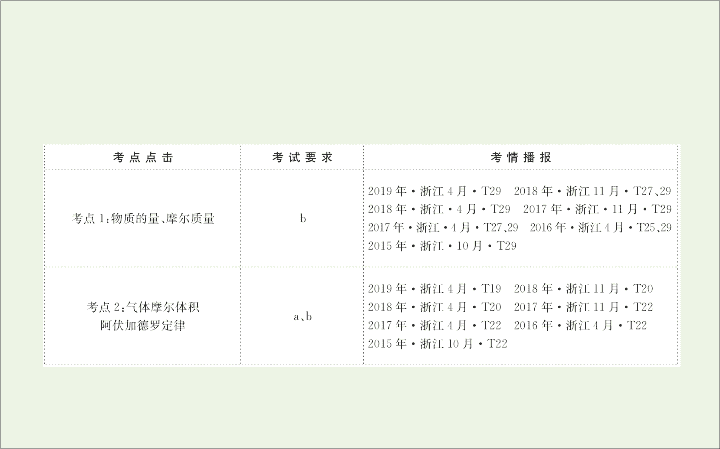
第二单元
物质的量 物质的聚集状态
考点
1:
物质的量、摩尔质量
1.
物质的量、阿伏加德罗常数
(b)
(1)
基本概念间的关系。
(2)
物质的量的规范表示方法。
如
0.2 mol H
2
中含有的氢原子个数为
___________;
6.02×10
22
个
Na
+
的物质的量为
________
。
2.408×10
23
0.1 mol
(3)
物质的量与粒子数、阿伏加德罗常数之间的关系为
______
。
n
=N/N
A
2.
摩尔质量
(b)
(1)
摩尔质量是指
_______________________________,
其符号为
M
,
单位为
________
。
(2)
数值
:
以
________
为单位时
,
任何粒子的摩尔质量在
数值上等于该微粒的
_________________
。
单位物质的量的物质所具有的质量
g·mol
-1
g·mol
-1
相对分
(
原
)
子质量
(3)
摩尔质量与物质的量、物质的质量之间的关系为
________
。该计算式同样适用于混合物的情况。
【
强化训练
】
1.
判断正误
(
正确的打“√”
,
错误的打“
×”)
(1)0.012 kg C-12
中含有约
6.02×10
23
个碳原子。
(
)
提示
:
√
。国际上规定
,1 mol
粒子集合体所含的粒子数与
0.012 kg C-12
中所含的碳原子数相同
,
约为
6.02×10
23
。
(2)1 mol
任何物质都含有
6.02×10
23
个分子。
(
)
提示
:
×
。物质的构成粒子有分子、原子或离子
,
如水由分子构成
,1 mol H
2
O
含有
6.02×10
23
个分子
,
而
NaCl
由离子构成
,
不存在分子
,1 mol NaCl
含有
1 mol Na
+
和
1 mol Cl
-
。
(3)
一个钠原子的质量为
。
(
)
提示
:
×
。钠的摩尔质量为
23 g·mol
-1
,
一个钠原子的
质量为
g,
约为
(4)1 mol OH
-
的质量是
17 g·mol
-1
。
(
)
提示
:
×
。
OH
-
的摩尔质量是
17 g·mol
-1
,1 mol OH
-
的质量是
17 g
。
(5)
摩尔既能用来计量纯净物
,
又能用来计量混合物。
(
)
提示
:
√
。有固定组成的混合物也可以用摩尔计量。
(6)
摩尔质量是
1
摩尔特定化学物质的质量
,
等同于化学式的式量。
(
)
提示
:
×
。摩尔质量是指单位物质的量的物质所具有的质量
,
在以“
g·mol
-1
”
为单位时
,
其数值等于相对分子质量、相对原子质量或化学式的式量。
(7)1 mol H,1 mol H
+
,1 mol H
2
的含义一样。
(
)
提示
:
×
。含义不同
,
尽管都是
1 mol
微粒
,
但微粒种类不同
,
它们分别表示
1 mol
氢原子
,1 mol
氢离子
,1 mol
氢分子。
2.(1)6.02×10
23
个
O
2
的质量是
________
。
(2)1.5 mol H
2
SO
4
中氧原子的物质的量为
________,
氧原子的质量为
________
。
(3)0.01 mol
某物质
A,
其质量为
1.06 g,
则
A
的相对分子质量为
________,
摩尔质量为
________
。
【
解析
】
(1)6.02
×
10
23
个
O
2
为
1 mol,
质量是
32 g
。
(2)1.5 mol H
2
SO
4
中含有氧原子
6 mol,
质量为
96 g
。
(3)A
物质摩尔质量为
106 g·mol
-1
,
相对分子质量为
106
。
答案
:
(1)32 g
(2)6 mol
96 g
(3)106
106 g·mol
-1
3.
有以下四种物质
:
①22 g
二氧化碳 ②
8 g
氢气
③
1.204×10
24
个氮气分子 ④
4 ℃
时
18 mL
水
它们所含分子数最多的是
________(
填序号
,
下同
),
所含原子数最多的是
________,
质量最大的是
________,
所含电子数最多的是
________
。
【
解析
】
四种物质分别为①
0.5 mol CO
2
②
4 mol H
2
③
2 mol N
2
④
1 mol H
2
O
。分子数分别为
0.5
N
A
、
4
N
A
、
2
N
A
、
N
A
,
最多的是②
;
原子数分别为
1.5
N
A
、
8
N
A
、
4
N
A
、
3
N
A
,
最多的是②
;
质量分别为
22 g
、
8 g
、
56 g
、
18 g,
最多的是③
;
所含电子数分别为
11
N
A
、
8
N
A
、
28
N
A
、
10
N
A
,
最多的是③。
答案
:
②
② ③ ③
4.
下列叙述正确的是
(
)
A.24 g
镁与
27 g
铝中含有相同的质子数
B.
同等质量的氧气和臭氧中
,
电子数相同
C.1 mol
重水与
1 mol
水中
,
中子数比为
2∶1
D.1 mol
乙烷和
1 mol
乙烯中
,
化学键数相同
【
解析
】
选
B
。
24 g
镁与
27 g
铝的物质的量均为
1 mol,
但
Mg
、
Al
的质子数分别为
12
、
13,A
项错误
;1 mol O
2
含
有
16 mol
电子
,1 mol O
3
含有
24 mol
电子
,
质量相同
(
设
为
m
g)
的
O
2
、
O
3
含有的电子的物质的量分别为
×
16 mol= mol
、
×24 mol= mol,B
项正确
;1 mol
D
2
O
含有
10 mol
中子
,1 mol H
2
O
含有
8 mol
中子
,C
项错
误
;1 mol CH
3
—CH
3
含有
7 mol
共价键
,1 mol CH
2
CH
2
含有
6 mol
共价键
,D
项错误。
【
归纳总结
】
1.
阿伏加德罗常数有单位
,
应写为
6.02×10
23
mol
-1
,
不能仅写数值
6.02×10
23
。
2.
摩尔质量的单位是
g
·
mol
-1
或
kg
·
mol
-1
,
相对原子
(
或分子
)
质量的单位为
1,
不是同一个物理量。摩尔质量只有当以
g
·
mol
-1
作单位时
,
在数值上才等于其相对原子
(
或分子
)
质量。
考点
2:
气体摩尔体积 阿伏加德罗定律
1.
物质的聚集状态
(a)
(1)
晶体与非晶态物质的区别。
晶体和非晶态物质的区别
:
晶体具有规则的几何外形和
___________;
非晶态物质没有
___________,
不具有规则
的几何外形。
固定的熔点
固定的熔点
(2)
不同聚集状态物质的微观结构与性质。
物质的
聚集状态
微观结构
微粒的
运动方式
宏观性质
固态
微粒排列
_____,
微
粒间的空
隙
_____
在固定
位置上
振动
有固定的
形状
,___
_______
被压缩
紧密
很小
几
乎不能
物质的
聚集状态
微观结构
微粒的
运动方式
宏观性质
液态
微粒排列较
紧密
,
微粒
间的空隙
_____
可以自
由移动
没有固定的
形状
,
但
___
___
被压缩
气态
微粒之间的
距离
_____
可以自
由移动
没有固定的
形状
,
且
___
___
被压缩
较小
不
易
较大
容
易
2.
气体摩尔体积
(b)
(1)
影响物质体积大小的因素
: ___________
、
_______
_________
、
___________
。一定物质的量的气体
,
其体
积的大小取决于气体所处的
___________
。
微粒的大小
微粒间
距的大小
微粒的数目
温度和压强
(2)
气体摩尔体积
:
气体摩尔体积是指在一定温度和压强下
,
单位物质的量
的气体所占有的体积
,
符号为
V
m
,
单位为
________
。
标准状况是指
_________________________,
此情况下
,
气体摩尔体积为
_____________
。
L·mol
-1
温度为
0 ℃,
压强为
101 kPa
22.4 L·mol
-1
3.
阿伏加德罗定律
(b)
可总结为“三同”定“一同”
,
即同温、同压、同体积的气体
,
具有相同的分子数。
4.
物质的量在化学方程式计算中的应用
(b)
化学方程式计量数的不同解读方式对解决涉及化学方程式的计算问题至关重要
【
典例精析
】
【
典例
】
(2019·
浙江
4
月选考
)
设
N
A
为阿伏加德罗常数的值
,
下列
说法不正确的是
(
)
A.1 mol CH
2
=
CH
2
分子中含有的共价键数为
6
N
A
B.500 mL 0.5 mol·L
-1
的
NaCl
溶液中微粒数大于
0.5
N
A
C.30 g HCHO
与
CH
3
COOH
混合物中含碳原子数为
N
A
D.2.3 g Na
与
O
2
完全反应
,
反应中转移的电子数介于
0.1
N
A
和
0.2
N
A
之间
﹒
﹒
﹒
【
解题思路
】
本题的解题关键有
:
(1)
明确阿伏加德罗常数的考查点及所涉及知识。
(2)
注意物质结构中的各微粒数目和共价键数目。
【
解析
】
选
D
。
A.1
个乙烯分子中碳碳双键含两个共价
键
,4
个碳氢键合计为
4
个共价键
,
总计
6
个共价键
,
因而
1 mol CH
2
=
CH
2
分子中含有的共价键数为
6
N
A
,A
项正确
;
B.
n
(Na
+
)=
n
(Cl
-
)=0.5 L×0.5 mol·L
-1
=0.25 mol,
n
(Na
+
)+
n
(Cl
-
)=0.5 mol,
因而钠离子和氯离子总计
0.5
N
A
个
,
但水会电离出极少量的
H
+
和
OH
-
,
因而
NaCl
溶液中微粒
数大于
0.5
N
A
,B
项正确
;C.HCHO
与
CH
3
COOH
的最简式为
CH
2
O,
原混合物相当于
30 g CH
2
O,
n
(CH
2
O)=1 mol,
因而碳原子数为
N
A
,C
项正确
;D.
不管钠和氧气生成氧化钠还是过氧化钠
,
钠元素的化合价由
0
变为
+1,
因而
2.3 g Na(2.3 g Na
为
0.1 mol)
转移电子数为
0.1 mol
×1×
N
A
=0.1
N
A
,D
项错误。
【
强化训练
】
1.
判断正误
(
正确的打“√”
,
错误的打“
×”)
(1)0 ℃
、
101 kPa,1 mol
任何物质的体积都是
22.4 L
。
(
)
提示
:
×
。气体摩尔体积的描述对象为气体
,
标准状况下
1 mol
任何气体的体积为
22.4 L
。
(2)
同温同压下
,
等质量的
12
C
18
O
和
NO
体积相同。
(
)
提示
:
√
。
12
C
18
O
和
NO
的摩尔质量均为
30 g·mol
-1
,
等质量的两种气体物质的量相等
,
相同温度和压强下
,
二者体积相同。
(3)
某混合气体摩尔体积为
22.4 L·mol
-1
,
则该气体一定处于标准状况。
(
)
提示
:
×
。标准状况下气体摩尔体积是
22.4 L·mol
-1
,
但升高温度增大压强或降低温度减小压强
,
气体摩尔体积也可能是
22.4 L·mol
-1
。
(4)
标准状况下
,1 mol N
2
和
O
2
混合气体的体积约为
22.4 L
。
(
)
提示
:
√
。气体摩尔体积适用于单一气体和混合气体
,
标准状况下
1 mol
气体的体积约为
22.4 L
。
(5)
在标准状况下
,1 mol
甲烷与
1 mol
甲苯的体积相同。
(
)
提示
:
×
。
0 ℃
时
,
甲烷是气体
,
甲苯是液体
,
相同物质的量时体积不相同。
(6)
同温同压下
,
两种单质气体体积相同
,
原子数一定相同。
(
)
提示
:
×
。同温同压同体积
,
气体分子数相同
,
但单质分子有双原子分子
(
如
O
2
、
H
2
等
),
三原子分子
(
如
O
3
)
和单原子分子
(
稀有气体
)
。
(7)
标准状况下
,22.4 L
的
H
2
和
22.4 L
的
NH
3
所含原子数目之比为
1∶2
。
(
)
提示
:
√
。标准状况下
,
体积相同的气体分子数相同
,
故
22.4 L
的
H
2
和
22.4 L
的
NH
3
所含原子数目之比为
1∶2
。
(8)
标准状况下
,22.4 L
己烷中含有的共价键数目为
19
N
A
。
(
)
提示
:
×
。标准状况下己烷为液体。
2.
三个密闭容器中分别充入
N
2
、
H
2
、
O
2
三种气体
,
以下各种情况下排序正确的是
(
)
A.
当它们的体积、温度、压强均相同时
,
三种气体的密度
:
ρ
(H
2
)>
ρ
(N
2
)>
ρ
(O
2
)
B.
当它们的温度和密度都相同时
,
三种气体的压强
:
p
(H
2
)>
p
(N
2
)>
p
(O
2
)
C.
当它们的质量和温度、压强均相同时
,
三种气体的体积
:
V
(O
2
)>
V
(N
2
)>
V
(H
2
)
D.
当它们的压强和体积、温度均相同时
,
三种气体的质量
:
m
(H
2
)>
m
(N
2
)>
m
(O
2
)
【
解析
】
选
B
。由
pV
=
nRT
得
p
RT
(
T
、
V
、
p
、
R
相
等
),
ρ
与
M
成正比
,
故
ρ
(O
2
)>
ρ
(N
2
)>
ρ
(H
2
),A
项错误
;
同理
,
p
(H
2
)>
p
(N
2
)>
p
(O
2
),B
项正确
;
pV
=
nRT
⇒
pV
=
RT
,
V
与
M
成反比
,
故
V
(H
2
)>
V
(N
2
)>
V
(O
2
),C
项错误
;
pV
=
nRT
⇒
pV
=
RT
,
m
与
M
成正比
,
故
m
(O
2
)>
m
(N
2
)>
m
(H
2
),D
项错误。
3.
常温常压下
,
两个容积相同的烧瓶中分别盛满
X
和
Y
两种气体
,
打开开关
a,
使两烧瓶内的气体相通
,
最后容器内的压强按由大到小的顺序排列正确的是
(
)
编号
①
②
③
④
气体
X
HI
NH
3
H
2
NO
气体
Y
Cl
2
HCl
Cl
2
O
2
A.②>③>①>④
B.③>①=④>②
C.③>①>④>② D.④>①>②>③
【
解析
】
选
C
。设起始状态下
,
每个烧瓶中气体的物质的量为
a
mol
。①中
Cl
2
+2HI====2HCl+I
2
,
常温下
,
碘呈固态
,
充分反应后
,
气体的物质的量为
1.5
a
mol;②
中
NH
3
+HCl====NH
4
Cl,
反应后无气体
;③
中不反应
(
光照或点燃条件下才反应
);④
中发生反应
2NO+O
2
====2NO
2
、
2NO
2
====N
2
O
4
,
反应后气体的物质的量介于
a
mol
与
1.5
a
mol
之间
,
故
C
正确。
4.(2017·
浙江
11
月选考真题
)
设
N
A
为阿伏加德罗常数的值
,
下列说法不正确的是
(
)
A.
含
0.2 mol H
2
SO
4
的浓硫酸和足量的镁反应
,
转移电子数大于
0.2
N
A
B.25 ℃
时
,pH=3
的醋酸溶液
1 L,
溶液中含
H
+
的数目小于
0.001
N
A
C.
任意条件下
,1 mol
苯中含有
C—H
键的数目一定为
6
N
A
D.
a
mol
的
R
2+
(R
的核内中子数为
N
,
质量数为
A
)
的核外电子数为
a
(
A
-
N
-2)
N
A
【
解析
】
选
B
。当浓硫酸反应变稀后与镁反应生成氢气
,
转移电子数在
0.2
N
A
~
0.4
N
A
,
所以转移电子数大于
0.2
N
A
,
故
A
正确
;pH=3
的醋酸溶液
,
氢离子浓度为
10
-3
mol·L
-1
,1 L
溶液中
,
氢离子数目为
0.001
N
A
,B
错误
;
苯中含
C—H
键
,1 mol
苯中含
C—H
键的数目一定为
6
N
A
,C
正确
;R
2+
核外电子数为
A
-
N
-2,
a
mol
的
R
2+
的核外电子数为
a
(
A
-
N
-2)
N
A
,
故
D
正确。
5.(2018·
浙江
4
月学考真题
)
设
N
A
为阿伏加德罗常数的
值
,
下列说法不正确的是
(
)
A.10 g
的
中含有的质子数与中子数均为
5
N
A
B.32 g
硫在足量的氧气中充分燃烧
,
转移电子数为
6
N
A
C.26 g C
2
H
2
与
C
6
H
6
混合气体中含
C—H
键的数目为
2
N
A
D.120 g NaHSO
4
和
KHSO
3
的固体混合物中含有的阳离子
数为
N
A
【
解析
】
选
B
。
10 g
的
为
0.5 mol,
所含质子数与中
子数均为
5
N
A
,A
正确
;S+O
2
SO
2
,32 g
硫能与
1 mol
氧气
完全燃烧
,
转移电子数为
:4
N
A
,B
错误
;C
2
H
2
与
C
6
H
6
的最简
式都是
CH,26 g
含
2 mol C—H
键
,
所含
C—H
键为
2
N
A
,C
正
确
;NaHSO
4
和
KHSO
3
的摩尔质量都为
120 g·mol
-1
,120 g
的固体混合物所含物质的量为
1 mol,
故其中含有的阳
离子数为
N
A
,D
正确。
6.
设
N
A
为阿伏加德罗常数的值
,
下列说法的是
(
)
A.
常温常压下
,1.7 g
羟基含有电子数为
N
A
B.
标准状况下
,11.2 L
氟化氢所含分子数为
0.5
N
A
C.0.2 mol
庚烷含有的共用电子对数为
4.4
N
A
D.
某碳酸氢钠溶液中含有
0.4 mol,
则
Na
+
数为
0.4
N
A
【
解析
】
选
C
。每个
—OH
中含有
9
个电子
,1.7 g
即
0.1 mol—OH
中含有电子数为
0.9
N
A
,A
错误
;
标准状况
下
,HF
为液态
,HF
的物质的量不能确定
,B
错误
;
每个庚
烷分子中含有共用电子对数为
22,0.2 mol
庚烷含有
4.4
N
A
个共用电子对
,C
正确
;
碳酸氢钠溶液中存在
的电离和水解
,
若含有
0.4 mol ,
则
Na
+
数大于
0.4
N
A
,D
错误。
7.(2019·
台州模拟
)
设
N
A
为阿伏加德罗常数值。下列有关叙述不正确的是 世纪金榜导学号
(
)
A.14 g
乙烯和丁烯混合气体中的氢原子数为
2
N
A
B.2 mol SO
2
与
1 mol O
2
反应生成的
SO
3
分子数为
2
N
A
C.1 mol Fe
放入过量的浓硫酸中
,
电子转移数小于
3
N
A
D.
标准状况下
,2.24 L C
3
H
8
含有的共价键数为
N
A
【
解析
】
选
B
。乙烯和丁烯的最简式均为
CH
2
,
故
14 g
乙
烯和丁烯混合气体中含有
CH
2
的物质的量为
14 g÷
14 g·mol
-1
=1 mol,
氢原子物质的量为
2 mol,
氢原子个
数为
2
N
A
,
故
A
正确
;
因
SO
2
和
O
2
反应生成
SO
3
为可逆反应
,
则
2 mol SO
2
与
1 mol O
2
不能完全反应生成
SO
3
,
反应生成的
SO
3
分子数小于
2
N
A
,
故
B
错误
; Fe
遇到浓硫酸发生钝化
,Fe
不能完全反应
,
则电子转移数小于
3
N
A
,
故
C
正确
;
标准状
况下
,C
3
H
8
为气体
,
则
2.24 L C
3
H
8
的物质的量为
2.24 L÷22.4 L·mol
-1
=0.1 mol,
因
1
个
C
3
H
8
分子中含有
10
个共价键
,
所以
0.1 mol C
3
H
8
分子中含有的共价键数为
1.0
N
A
,
故
D
正确。
8.
设
N
A
为阿伏加德罗常数的值
,
下列说法正确的是
(
)
A.2.8 g
铁粉与
50 mL 4 mol·L
-1
盐酸反应转移电子的数目为
0.15
N
A
B.
常温下
1 L pH=13
的氢氧化钠溶液中由水电离出的
H
+
的数目为
0.1
N
A
C.
标准状况下
,8.96 L
氢气、一氧化碳的混合气体完全燃烧
,
消耗氧分子的数目为
0.2
N
A
D.1.2 g
金刚石与石墨的混合物中含有碳碳单键的数目为
0.4
N
A
【
解析
】
选
C
。
2.8 g
铁粉的物质的量为
n
(Fe)=
=0.05 mol,50 mL 4 mol·L
-1
盐酸中
HCl
的物质的量为
n
(HCl)=4 mol·L
-1
×0.05 L=0.2 mol,
根据方程式
Fe
+2HCl====FeCl
2
+H
2
↑,
则可以判断盐酸过量
,
应该根据
铁粉的物质的量计算转移的电子数
,
n
(e
-
)=2
n
(Fe)=2×
0.05 mol=0.1 mol,
即
0.1
N
A
,A
项错误
;pH=13
的氢氧化钠
溶液中由水电离出的
H
+
即溶液中的
H
+
,
c
(H
+
)=1×
10
-13
mol·L
-1
,
n
(H
+
)=1×10
-13
mol·L
-1
×1 L=1×
10
-13
mol,
即
1×10
-13
N
A
,B
项错误
;
标准状况下
,8.96 L
氢
气、一氧化碳的混合气体的物质的量为
n
(
混
)=
=0.4 mol,
根据
2CO+O
2
2CO
2
和
2H
2
+O
2
2H
2
O
可知
,
每
1 mol
混合气体完全燃烧就要消耗
0.5 mol
氧气
,
则
0.4 mol
混合气体完全燃烧就要消耗
0.2 mol
氧气
,
即
0.2
N
A
,C
项正确
;1.2 g
金刚石与石墨的
混合物中含碳的物质的量为
n
(C)= =0.1 mol,
在金刚石中
1
个碳原子能够形成
2
个共价单键
,
在石墨中
1
个碳原子能够形成
1.5
个共价单键
,
所以
0.1 mol C
形
成的共价单键的物质的量应该处于
0.15 mol
和
0.2 mol
之间
,D
项错误。
【
加固训练
】
同温、同压下
,
某容器充满
O
2
,
重
116 g,
若充满
CO
2
重
122 g,
现充满某气体重
114 g,
则该气体的相对分子质量为
________
。
【
解析
】
方法一
:
按常规思路
:
设瓶重
m
g
。某气体的相
对分子质量为
M
1
,
由
,
因为容器体积不变
,
所以有
,
得
m
=100,
然后由
,
得
M
1
=28 g·mol
-1
,
即相对分子质量为
28
。
方法二
:
差量法
:
因为同温同压下
,
气体质量之差和相对
分子质量之差存在着正比关系
,
因此可以不计算容器的
质量
,
直接由气体质量差和相对分子质量差的正比关系
求得。
M
某
=
28 g·mol
-1
,
即相对分子质量为
28
。
答案
:
28
【
归纳总结
】
1.
阿伏加德罗定律
:
在相同的温度和压强下
,
相同体积的任何气体都含有相同数目的粒子。
即
:
T
1
=
T
2
,
p
1
=
p
2
,
V
1
=
V
2
⇒
N
1
=
N
2
2.
阿伏加德罗定律的推论
条 件
结 论
推论一
同温同压
条 件
结 论
推论二
同温同容
注
:
以上用到的符号
:
ρ
为密度、
p
为压强、
n
为物质的量、
M
为摩尔质量、
V
为气体体积
3.
阿伏加德罗常数的综合应用“五”陷阱
陷阱一、 “标准状况”“常温常压”等外界条件的应用方面
(1)22.4 L
·
mol
-1
指在标准状况下
(0 ℃ 101 kPa)
的气体摩尔体积。在标准状况下非气态物质
(
如
H
2
O
、
SO
3
、戊烷、
CHCl
3
、
CCl
4
、苯、乙醇等
),
体积为
22.4 L
时
,
其分子数不等于
N
A
。
(2)
物质的质量、摩尔质量、微粒个数不受外界条件的影响。
陷阱二、 物质的组成方面
(1)
特殊物质中所含微粒
(
分子、原子、电子、质子、中子等
)
的数目。
如
Ne
、
D
2
O
、
18
O
2
、
H
37
Cl
、
—OH
、
OH
-
等。
(2)
物质中所含化学键的数目。
如
H
2
O
2
、
C
n
H
2
n
+2
中化学键的数目分别为
3
、
3
n
+1
。
(3)
最简式相同的物质中的微粒数目。
如
NO
2
和
N
2
O
4
、乙烯和丙烯等。
(4)
摩尔质量相同的物质中的微粒数目。
如
N
2
、
CO
、
C
2
H
4
等。
陷阱三、典型的氧化还原反应的电子转移数目方面
电子转移
(
得失
)
数目问题的分析
,
如
Na
2
O
2
、
NO
2
与
H
2
O
反应
;
电解
AgNO
3
溶液、
CuSO
4
溶液的反应
;Cl
2
与
H
2
O
、
NaOH
、
Fe
反应等
,
分析该类题目时还要注意反应产物以及过量计算问题。
陷阱四、弱电解质的电离、盐类的水解方面
弱电解质在水溶液中部分电离
,
可水解的盐溶液中
,
离子发生微弱水解。如
1 L 0.1 mol
·
L
-1
的乙酸溶液和
1 L 0.1 mol
·
L
-1
的乙酸钠溶液中
CH
3
COO
-
的数目不相等且都小于
0.1
N
A
。
陷阱五、 特殊的反应方面
如一氧化氮和氧气常温常压下即可反应
,
二氧化氮和四氧化二氮之间存在相互转化
,
氯气与水反应、合成氨反应等属于可逆反应。
相关文档
- 2020_2021学年高中化学专题1化学家2021-07-068页
- 2020_2021学年高中化学专题1化学家2021-07-055页
- 高中化学专题化学家眼中的物质世界2021-07-0540页
- 2021版江苏新高考选考化学(苏教版)一2021-07-0510页
- 2020_2021学年高中化学专题1化学家2021-07-057页
- 2020_2021学年高中化学专题1化学家2021-07-057页
- 专题 化学家眼中的物质世界知识点2021-07-035页
- 2021版高考化学一轮复习专题1化学2021-07-0355页
- 2020_2021学年高中化学专题1化学家2021-07-028页
- 2021版新高考化学一轮复习专题1化2021-07-0229页