- 1.16 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二节 富集在海水中的元素——氯
一、氯气
氯气的物理性质:________色有________性气味的气体,______,
密度比空气____,25℃时,1体积水可溶解________氯气,其水溶
液俗称________,为________色。
【想一想】
(1)常见易液化的气体有哪些? (2)实验室中,怎样闻气体的气味?
黄绿 强烈刺激 有毒 大 2体积 氯水 浅黄绿
(1)Cl2、NH3、SO2等。
(2)将集气瓶放在鼻子的前下方,用手轻轻在瓶口扇动,使极少
量气体进入鼻孔。
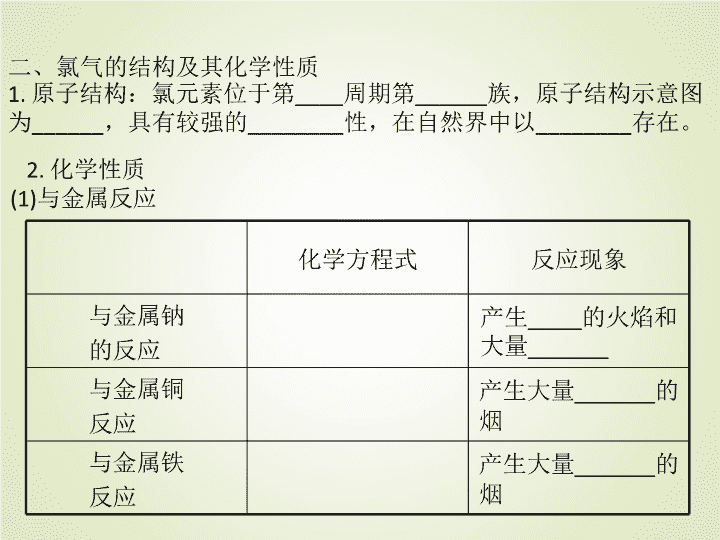
二、氯气的结构及其化学性质
1. 原子结构:氯元素位于第____周期第______族,原子结构示意图
为______,具有较强的________性,在自然界中以________存在。
2. 化学性质
(1)与金属反应
化学方程式 反应现象
与金属钠
的反应
产生____的火焰和
大量______
与金属铜
反应
产生大量______的
烟
与金属铁
反应
产生大量______的
烟
1. 三 ⅦA 氧化 化合态
2. (1)2Na+Cl2===2NaCl 黄色 白烟
Cu+Cl2===CuCl2 棕黄色
2Fe+3Cl2===2FeCl3 棕褐色
答案:
【想一想】
常温下铁与干燥的氯气反应吗?
(2)与非金属反应
工业制HCl原理:______________(______色火焰)。
(3)与水反应
①氯气与水的反应
______________ (氯气既是氧化剂又是还原剂)。
②次氯酸的性质
a. 弱酸性:一元弱酸,酸性______碳酸。
b. 不稳定性:______________(氯水要现用现制,保存在
________中)。
c. 强氧化性:HClO能氧化许多物质,用作______________。
铁在常温下,与干燥的Cl2不反应,与潮湿的Cl2反应,因此液氯可
保存在钢瓶中。
(4)与强碱反应
①工业制取漂白液原理:______________(实验室利用此原理吸收多余的Cl2)。
②工业制取漂白粉原理:__________(有效成分为______)。
③漂白粉漂白原理:________________(也说明酸性HClO____H2CO3),漂白粉必
须______保存。
(5)与某些还原性物质反应
Cl2能氧化I-、S2-、Fe2+、SO32-、NH3等。(用化学方程式表示)
①与FeCl2溶液:
_____________________________________________________________________
___。
②与KI溶液:
_____________________________________________________________________
___。
③向氯水中通入SO2:
_____________________________________________________________________
___。
④与足量NH3:
_____________________________________________________________________
___。
(2)H2+Cl2===2HCl 苍白 (3)①Cl2+H2O===HCl+HClO ②a. 小
于 b. 2HClO===2HCl+O2↑ 棕色瓶 c. 消毒剂、漂白剂
(4)①Cl2+2NaOH===NaCl+NaClO+H2O ②2Cl2+
2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O Ca(ClO)2 ③Ca(ClO)2+CO2+
H2O===CaCO3+2HClO < 密封 (5)①Cl2+2FeCl2=== 2FeCl3
②Cl2+2KI===2KCl+I2 ③Cl2+SO2+2H2O===2HCl+H2SO4
④3Cl2+8NH3===N2+6NH4Cl
答案:
三、卤素离子的检验
检验溶液中的Cl-(Br-、I-)时,应先加________酸化,再加入
________溶液
稀硝酸 AgNO3 答案:
氯水的成分及性质
【例1】 (2011·东北师大附中高三摸底)将氯水分别滴入下列各选项
所述的溶液中,由实验现象得出的结论完全正确的是( )
选项 氯水滴入下列溶液
中 实验现象 结论
A 含有KSCN的FeCl2
溶液 变红 Cl2具有还原性
B 含有酚酞的NaOH溶
液 褪色 Cl2具有酸性
C 紫色石蕊溶液 先变红后褪色 Cl2具有漂白性
D KI淀粉溶液 变蓝色 Cl2具有氧化性
【自主解答】
D 解析:A中反应为: 2Fe2++Cl2===2Fe3++2Cl-, Cl2表现氧
化性;B和C中氯水表现酸性和漂白性;D中Cl2表现氧化性。
1. 氯水的成分
Cl2溶于水:Cl2+H2O==H++Cl-+HClO
2. 氯水的性质
新制氯水呈浅黄绿色、有刺激性气味,属混合物,其所含的多种
微粒使氯水的化学性质表现出多重性,如Cl2的强氧化性,HCl的
强酸性,HClO的强氧化性、弱酸性,Cl-的性质,等等。在不同
的反应中,氯水起作用的成分不同。
参与反应的粒子 所加试剂 实验现象 离子方程式或解释
Cl- AgNO3溶液 白色沉淀 Cl-+Ag+
===AgCl↓
H+ Na2CO3固体 有气泡产生 2H++CO 3 2-
===CO2↑+H2O
HClO 有色布条 布条颜色褪去 发生氧化还原反应
Cl2 FeCl2溶液 溶液变棕黄色 2Fe2++
Cl2===2Fe3++2Cl-
Cl2、H2O SO2 黄绿色褪去
SO2+Cl2+2H2O
===4H++2Cl-+
SO 4 2-
HClO、H+ 石蕊试液 先变红后褪色 酸性和漂白性
Cl2、H+ 镁粉 氯水的颜色褪去并
有气泡产生
Mg+2H+===Mg2+
+H2↑
3. 新制氯水、久置氯水、液氯的区别
名称 新制氯水 久置氯水 液氯
物质类别 混合物 混合物 纯净物
粒子种类
Cl2、HClO、
H2O、H+、Cl
-、ClO-、OH-
H2O、H+、Cl
-、OH- Cl2
主要性质
浅黄绿色溶液,
能导电,有酸
性、漂白性
即为稀盐酸,
无色溶液,只
有强酸性
黄绿色液体,
不导电,有氧
化性
4. Cl2+H2O==H++Cl-+HClO平衡移动的应用
向氯水中加入的物
质 浓度变化 平衡移动的方向 应用
可溶性氯化物 c(Cl-)增大 左移 ①用饱和食盐水除
Cl2中的HCl
盐酸 c(Cl-)增大 左移 次氯酸与浓盐酸反
应制Cl2
NaOH c(H+)减小 右移 用NaOH吸收多余的
Cl2
Ca(OH)2 c(H+)减小 右移 制取漂白粉
CaCO3 c(H+)减小 右移 制高浓度次氯酸溶
液
光照 c(HClO)减小 右移 氯水应避光保存或
现用现配
1. 自来水常用氯气进行消毒。如果在实验室用自来水配制下列物
质的溶液,不会产生明显药品变质问题的是( )
A. AgNO3 B. Na2SO3 C. NaOH D. AlCl3
解析:氯水中的HCl与AgNO3反应生成AgCl ,Cl2能氧化Na2SO3,
Cl2与NaOH反应生成NaCl、NaClO、H2O。
答案: D
氯气的制法
【例2】 (2010·江西师大附中高三期中)为了证明在实验室制备Cl2
的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实
验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接________,________接______,________接a。
(2)U形管中所盛的试剂为__________________。
(3)装置③中CCl4的作用是______________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中
的气体只有一种。为了确保实验结论的可靠性,证明最终通入
AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加装
置⑤。你认为装置⑤应加在______之间(填装置序号)。瓶中可以放
入__________________。
【自主解答】
(1)b接e(或f),f(或e)接d,c接a (2)无水CuSO4 (3)吸收Cl2 (4)①③
湿润的KI淀粉试纸(或润湿的有色布条)
【自主解答】
解析:根据实验目的和各装置的作用确定装置的连接顺序:②氯气
发生→④干燥→ ③除氯气→ ⑤检验氯气已除尽[用湿润的KI淀粉试纸
(或润湿的有色布条)]→ ①HCl通入AgNO3溶液中。U形管中所盛试剂
只能除去水蒸气,不能与Cl2和HCl反应,故选用无水CuSO4。
1. 一套完整的制取气体的实验装置包括四个部分:发生装置→净化
装置→收集或性质验证装置→尾气处理装置(制取有毒气体)。在制
取气体时,可按此顺序选择需要的仪器和相应的药品组合装置。
2. 氯气的实验室制法
反应原理 MnO2+4HCl(浓)==MnCl2+2H2O+Cl2↑
制气类型 固+液气
收集装置 向上排空气法或排饱和食盐水法(Cl2在饱和食盐
水中的溶解度很小)
净化装置 用饱和食盐水除去HCl,再用浓H2SO4干燥
尾气吸收装置 用强碱溶液吸收多余的Cl2,防止污染大气
验满方法
①将湿润的淀粉-碘化钾试纸靠近收集Cl2的瓶
口,观察到试纸立即变蓝,则证明已集满;②
将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察
到试纸立即发生先变红后褪色的变化,则证明
已集满;③实验室制取Cl2时,常常根据氯气的
颜色判断是否收集满
【温馨提示】(1)稀盐酸与MnO2不反应,当足量MnO2与含有4 mol
HCl的浓盐酸充分反应生成的Cl2小于1 mol。原因是:盐酸的消耗和
盐酸的挥发,盐酸的浓度变稀。
(2)实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,
避免污染空气。
(3)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中含
Ca(OH)2量少,吸收不完全。
3. 工业制法
(1)电解饱和食盐水法:2NaCl+2H2O==2NaOH+Cl2↑+H2↑
(2)电解熔融的NaCl:2NaCl(熔融)==2Na+Cl2↑
2. 化学小组用如图所示的装置制取氯气,下列说法不正确的是( )
A. 该装置图中至少存在两处明显错误
B. 该实验中收集氯气的方法不正确
C. 为了防止氯气污染空气,必须进行尾气处理
D. 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明
是否有氯气逸出
B 解析:应使用酒精灯加热,尾气应处理,A项正确;用向上排空
气法收集Cl2,B项错误;在集气瓶的导管口处放一片湿润的淀粉碘
化钾试纸可以证明是否有氯气逸出,若有则变蓝,反之则不变色,
D项正确。
答案:
1. 下列说法正确的是( )
A. 漂白粉的成分为次氯酸钙
B. 氯气能使湿润的有色布条褪色,说明氯气具有漂白性
C. 氯水与液氯的成分完全一样
D. 氯气能跟铁反应,但可用铁罐存放液氯
2. (2010·山东泰安模拟)氯化溴是由两种卤素互相结合而成的卤
素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成
卤化物,能与水反应:BrCl+H2O===HBrO+HCl。下列有关BrCl
的性质的叙述中不正确的是( )
A. 是较强的氧化剂
B. 是一种共价化合物
C. 能使湿润的淀粉碘化钾试纸变蓝
D. BrCl与水反应中,BrCl既是氧化剂又是还原剂
3. 某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替
代相关的教材上的实验。实验操作:先给钠预热,当钠熔成圆球时,
撤火、通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述
错误的是( )
A. 钠着火燃烧产生苍白色火焰
B. 反应生成的大量白烟是氯化钠晶体
C. 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,
以免其污染空气
D. 管右端棉球的颜色变化可判断氯气是否被碱液完全吸收
4. “84”消毒液在日常生活中被广泛使用。该消毒液无色,pH大于
7,对某些有色物质有漂白作用。也可进行环境消毒,预防H1N1
流感。你认为它可能的有效成分是( )
A. SO2 B. KMnO4
C. Na2CO3 D. NaClO
5. 某同学用下列装置制备并检验Cl2的性质。
下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B. Ⅱ图中:生成蓝色的烟
C. Ⅲ图中:量筒中发生了加成反应
D. Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,
至溶液显酸性,结果有Cl2生成
1. D
2. D 解析:BrCl的化学性质与Cl2相似,应是较强的氧化剂,可
氧化KI生成I2,I2遇淀粉变蓝。BrCl由两种元素组成,显然属于化
合物。BrCl分子中,Cl原子吸引电子的能力强,故电子对偏向Cl,
使Cl显-1价,Br显+1价,根据反应BrCl+H2O===HBrO+HCl,
BrCl中各元素化合价未变,故此反应不是氧化还原反应。
答案:
3. A 解析:钠燃烧的火焰呈黄色,A项错误;氯气与钠反应生成
大量的白烟,产物为氯化钠,B项正确;氯气是一种有毒的气体,
实验中要考虑其污染,用碱液可吸收多余的氯气,C项正确;氯气
与淀粉KI溶液反应生成的I2会使溶液变蓝,可用此现象检验氯气是
否吸收完全,D项正确。
4. D
5. D 解析:A项随盐酸浓度变小,不再与MnO2反应,B项产生棕
色的烟,C项发生取代反应,D项发生反应:Cl-+ClO-+2H+
===Cl2↑+H2O。
答案:
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页