- 701.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电解质溶液中离子浓度的关系涉及到<<溶液中的
离子平衡>>一章几乎所有的知识点,如强弱电解质、
电离平衡、水的电离、溶液的pH、离子反应、盐类的
水解等,在高中化学中占有非常重要的地位,是历年
高考命题的热点之一,是每年高考都必定要涉及的内
容。
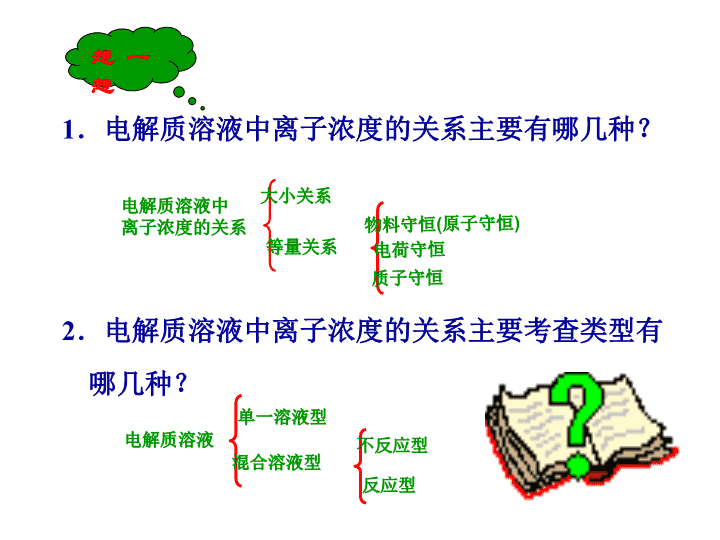
1.电解质溶液中离子浓度的关系主要有哪几种?
2.电解质溶液中离子浓度的关系主要考查类型有
哪几种?
想 一
想
电解质溶液中
离子浓度的关系
大小关系
等量关系
物料守恒(原子守恒)
电荷守恒
质子守恒
电解质溶液
单一溶液型
混合溶液型
不反应型
反应型
单
一
溶
液
【例1】在0.1mol/LNa2CO3溶液中,下列各种
微粒之间的关系不正确的是( )
A.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.c(Na+)> c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
一、写出分析离子浓
度关系时所用到的
全部方程式
二、推导出溶液中存
在的全部粒子
三、推断出溶液中离
子浓度的全部关系
Na2CO3 ==
2Na++CO32-CO32- +H2O HCO3-+OH-
HCO3- +H2O H2CO3+OH-
H2O H++OH-
全部方程式
0.1mol/L的Na2CO3溶液中
全部粒子
离子
阳离子:
阴离子:
分子:
Na+、H+
CO32- 、 HCO3- 、 OH-
H2CO3 、 H2O(不参与比较,可不写出)
全部关系式
物料守恒:
电荷守恒:
质子守恒:
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
大小关系: c(Na+)> c(CO32-) >c(OH- ) >c(HCO3-)>c(H+)
电解质电离产生
的离子为主
其它反应产生的
离子为次
减 加
抓主次
抓加减
抓住同一离子在
不同反应中的补
充或消耗
溶液中的离子
以电解质电离
产生的离子为
主,其它反应
产生的离子为
次(含义1)
变式1:下列表示0.1mol/l NaHCO3溶液中有关粒
子浓度的关系式正确的是( )
A.c(Na+)﹥c(HCO3-)﹥c(CO32)﹥cC(H+)﹥c(OH-)
B.c(Na+)+ c (H+)= c(CO32-)+c(HCO3-)+c(OH-)
C.c(Na+)+ c(H+) =2c(CO32-)+c(HCO3-)+c(OH-)
D.c (Na+)= c (CO32-)+ c (HCO3-)+ c (H2CO3)
将NaHCO3中
的C换为S,则变
为NaHSO3,离子
浓度关系是否可以
只做这样的交换?
为什么?
NaHCO3 == Na++HCO3-
HCO3- CO32- + H+
HCO3- +H2O H2CO3+OH-
H2O H++OH-
全部方程式
0.1mol/L的NaHCO3溶液中
阴离子:
全部粒子
离子
阳离子:
分子:
Na+、H+
HCO3- 、 CO3 2- 、 OH-
H2CO3
全部关系式
物料守恒:
电荷守恒:
质子守恒:
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(OH-)=c(H+)+c(HCO3-)-c(CO32-)
大小关系: c(Na+)> c(HCO3-) >c(OH- ) > c(H+) > c(CO32-)
水解
为主
电离
为次
抓主次
抓住水解与
电离的主次
关系(含义
2)
0.1mol/L的
NaHSO3溶液
物料守恒:
电荷守恒:
质子守恒:
c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c(OH-)=c(H+)+c(HSO3-)-c(SO32-)
大小关系: c(Na+)> c(HSO3-) > c(H+) > c(SO32-) > c(OH- )
0.1mol/L的
NaHCO3溶液
物料守恒:
电荷守恒:
质子守恒:
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(OH-)=c(H+)+c(HCO3-)-c(CO32-)
大小关系: c(Na+)> c(HCO3-) >c(OH- ) > c(H+) > c(CO32-)
将NaHCO3中的C换为S,则变为
NaHSO3,离子浓度关系是否可以只
做这样的交换?为什么?
H2CO3--弱酸 H2SO3 --中强
酸
混
合
溶
液
不
反
应
型
【例2】用物质的量都是0.1mol的CH3COOH和
CH3COONa配制成1L混合溶液,已知其中
C(CH3COO-)>C(Na+),对该混合溶液的下列判断
正确的是( )
A. c(H+)>c(OH-)
B.c(CH3COOH)+c(CH3COO-)=0.2 mol/L
C. c (CH3COOH)>c(CH3COO-)
D. c (CH3COO-)+c(OH-)=0.2 mol/L
思考:将互不
反应的两种物质混
合,所得溶液中离
子浓度关系的分析
思路和技巧。
反
应
型
【例3】在10ml0.1mol/LNaOH溶液中,加入等体
积、等浓度的CH3COOH溶液,反应后溶液中各粒
子的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
思考: 1、
将CH3COOH溶液
变为20ml,浓度不
变,如何分析离子
浓度关系?
2、将能发生
反应的两种物质混
合,如何分析所得
溶液中离子浓度关
系?
H2O H++OH-
0.1mol CH3COOH和0.1mol CH3COONa配制成1L混合溶液
c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
2c(Na+)=c(CH3COO-)+c(CH3COOH) =0.2mol/L
全部关系式
物料守恒:
电荷守恒:
大小关系:c(CH3COO-) > c(Na+)
CH3COONa == Na++ CH3COO-
CH3COOH H++ CH3COO-全部方程式
全部粒子
离子
阳离子:
阴离子:
分子:
Na+、H+
CH3COO- 、 OH-
CH3COOH
CH3COO- + H2O
CH3COOH+OH-
质子守恒:(混合溶液一般不考查,不用写出)
c(H+) > c(OH-)
c(CH3COO-) > c(CH3COOH)
0.1mol
<0.1mol
>0.1mol
变式2:用物质的量都是0.01mol的HCN和NaCN
配成1L溶液,已知其中c(CN-)<c(Na+),则对该溶液
中的下列判断不正确的是:( )
A.c(H+)>c(OH-)
B.c(HCN)>c(CN-)
C.c(OH-)>c(H+)
D.c(Na+)+ c(CN-)=0.02 mol/L
对比分析
例2与变式2的
有关内容,你
发现有何不同
之处?解题思
路和方法呢?
c(CN-)+ c(OH-)= c(Na+)
+c(H+)c(CN-)< c(Na+) c(OH-)>c(H+)
特例水解 > 电离
一般情况下,弱电解质及其盐的混合
物中,弱电解质的电离大于盐的水解.如
CH3COONa和CH3COOH/NH3·H2O和
NH4Cl
变式3:物质的量浓度相同(0.1 mol·L-1)的弱酸
HX与NaX溶液等体积混合后,溶液中粒子浓度关系
错误的是( )
A.c(Na+)+c(H+)=c(X-
)+c(OH-
)
B.c(HX) +c(X-
)=2c(Na+)
C.若混合液呈酸性则
c(X-
)>c(Na+)>c(HX)>c(H+)>c(OH-
)
D.若混合液呈碱性则
c (Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
分析变式3时
应该注意什么?
注意讨论弱酸
HX的电离与
其盐NaX的
水解的主次关系
D
NaOH+CH3COOH =CH3COONa+H2O
10ml
0.1mol/L
10ml
0.1mol/L 恰好完全反应
得到CH3COONa溶液
单一溶液型
10ml0.1mol/LNaOH 和等体积、等浓度CH3COOH混合
反应型
计算
NaOH+CH3COOH =CH3COONa+H2O
20ml
0.1mol/L
10ml
0.1mol/L CH3COOH过量
得到n(CH3COONa): n(CH3COOH)=1:1的混合溶液
不反应型反应型
20ml0.1mol/LCH3COOH和10ml0.1mol/LNaOH混合
计算
电解质
溶液
单一溶液
混合溶液
不反应
反应
计算 单一溶液
不反应
三
步
走、
抓
全
部
参考答案:
1、A 2、B 3、C 4、D
5、2c(S2-) + c(HS-)
2c(H2S) + 2c(HS-)
已知某溶液中只存在OH—、H+、NH4+、Cl—四种离子,某同学推测其离子浓度
大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>
c(H+)③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH
-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大
小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是
正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中
性,则混合前c(HCl) c(NH3·H2O)(填“大于”、“小于”或“等于”,下
同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+) c(OH -)。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页