- 653.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题讲座(十) 化学探究实验题考题类型
解答探究性实验题的基本程序可用以下流程图表示:
1.提出问题
首先要发现问题,对题给信息进行对比、质疑,通过思考提出值得探究的问题。此外,实验中出现的特殊现象也是发现问题、提出问题的重要契机。
2.提出猜想
所谓猜想就是根据已有知识对问题的解决提出的几种可能的情况。有一些问题,结论有多种可能(这就是猜想),只能通过实验进行验证。
3.设计验证方案
提出猜想后,就要结合题给条件,设计出科学、合理、安全的实验方案,对可能的情况进行探究。实验设计中,关键点是对试剂的选择和实验条件的调控。
4.观察实验现象,得出结论
根据设计的实验方案,根据实验现象进行推理分析或计算分析得出结论。
1.对未知产物的探究
通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。虽然探究性实验主要考查学生的探究能力,但在问题中常常包含了对实验基础知识的考查。
2.对物质性质的探究
在探究过程中往往可以利用对比实验,即设置几组平行实验来进行对照和比较,从而研究和揭示某种规律,解释某种现象形成的原因或证明某种反应机理。
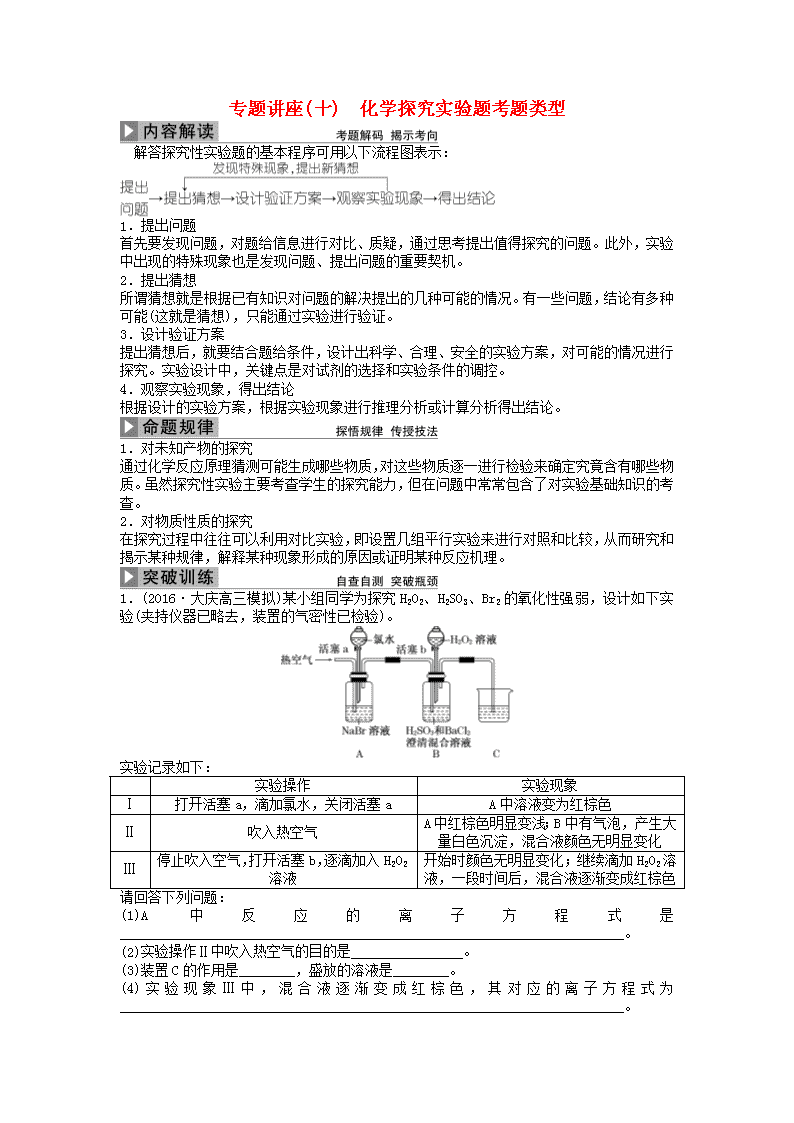
1.(2016·大庆高三模拟)某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
实验操作
实验现象
Ⅰ
打开活塞a,滴加氯水,关闭活塞a
A中溶液变为红棕色
Ⅱ
吹入热空气
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化
Ⅲ
停止吹入空气,打开活塞b,逐滴加入H2O2溶液
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色
请回答下列问题:
(1)A中反应的离子方程式是________________________________________________________________________。
(2)实验操作Ⅱ中吹入热空气的目的是________________。
(3)装置C的作用是________,盛放的溶液是________。
(4)实验现象Ⅲ中,混合液逐渐变成红棕色,其对应的离子方程式为________________________________________________________________________。
(5)由上述实验得出的结论是________________________________________________________________________。
(6)实验反思
①有同学认为实验操作Ⅱ吹入的热空气会干扰(5)中结论的得出,你认为是否干扰,理由是________________________________________________________________________
________________________________________________________________________。
②实验现象Ⅲ中,开始时颜色无明显变化的原因是(写出一条即可):________________________________________________________________________
________________________________________________________________________。
解析:(2)吹入热空气的目的是吹出Br2。
(6)解题时注意审题,实验现象Ⅱ是A中红棕色明显变浅,B中混合液颜色无明显变化,说明Br2被吹出,在B中与H2SO3发生了反应。
答案:(1)2Br-+Cl2===Br2+2Cl-
(2)吹出单质Br2
(3)吸收尾气 NaOH溶液
(4)H2O2+2Br-+2H+===Br2+2H2O
(5)氧化性:H2O2>Br2>H2SO3
(6)①不干扰,无论热空气是否参与氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3
②H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等原因都可)
2.已知火柴头上的物质一般是KClO3、MnO2等氧化剂和易燃物如硫等。请设计合理实验探究氯酸钾中各元素的存在,完成以下实验探究过程:
(1)提出假设
假设1:氯酸钾中只含有________和钾两种元素。
假设2:氯酸钾中除含有氯和钾元素外还含有________元素。
(2)设计实验方案:基于假设2,设计出实验方案。
(3)实验过程
根据设计出的实验方案填写实验操作、预期现象与结论。
实验操作
预期现象与结论
步骤1:
续 表
实验操作
预期现象与结论
步骤2:
步骤3:
……
解析:本题基于O2的制取但高于O2的制取,考查思维的条理性,每一步实验都是需要掌握的:O2的检验、Cl-的检验、K元素的检验等。解决本题的关键是将ClO转化为Cl-。
答案:(1)氯 氧
(3)
实验操作
预期现象与结论
步骤1:混入少量MnO2后加热并用带火星的木条检验生成的气体
带火星的木条复燃,证明氯酸钾中含有O元素
步骤2:将加热后的固体溶于水并过滤以除去MnO2,得澄清滤液备用
步骤3:用一根洁净的铂丝蘸取滤液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色
火焰呈紫色,证明氯酸钾中含有K元素
步骤4:取滤液少许,向其中加入用稀HNO3酸化的AgNO3溶液
有白色沉淀,证明氯酸钾中含有Cl元素
(注:氯元素的检验也可用下述方法:取氯酸钾固体少许置于试管中,加入蒸馏水溶解后,滴加AgNO3溶液、稀HNO3和NaNO2溶液,若出现白色沉淀,证明氯酸钾中含有Cl元素)
排查落实练八 实验装置、操作规范必记[学生用书单独成册]
一、实验装置·正误判断
1.称量NaOH固体( )
答案:×
2.配制150 mL 0.1 mol·L-1盐酸( )
答案:×
3.分离两种互溶但沸点相差较大的液体混合物( )
答案:×
4.实验室制氨气( )
答案:√
5.测定盐酸浓度( )
答案:×
6.测定黄铜(Cu、Zn合金)中Zn的含量( )
答案:×
7.干燥Cl2( )
答案:×
8.吸收HCl( )
答案:×
9.吸收NH3( )
答案:√
10.石油的分馏( )
答案:×
11.将海带灼烧成灰( )
答案:×
12.过滤( )
答案:×
13.萃取后下面放出碘的苯溶液( )
答案:×
14.测定中和热( )
答案:×
15.用于测量气体体积的装置( )
答案:×
16.铜与稀HNO3制取NO气体( )
答案:×
17.铁制品上镀锌( )
答案:×
18.比较Na2CO3与NaHCO3的热稳定性( )
答案:√
19.蒸干NH4Cl饱和溶液制备NH4Cl晶体( )
答案:×
20.读取液体体积( )
答案:×
21.点燃酒精灯( )
答案:×
22.收集一瓶纯净的SO2( )
答案:×
23.制取Fe(OH)2沉淀( )
答案:√
24.测定化学反应速率( )
答案:×
25.检验K2CO3溶液中的K+( )
答案:√
26.证明氨气极易溶于水( )
答案:√
27.制备Fe(OH)2并能长时间观察其颜色( )
答案:√
28.制取并收集干燥纯净的NH3( )
答案:×
29.配制硫酸溶液( )
答案:×
30.制备氢气并检验H2的可燃性( )
答案:×
二、常见装置的气密性检查
1.如何检查图1装置的气密性?
答案:①把导管的一端插入到水中,②用手紧握(必要时可双手同时用)试管(烧瓶)的外壁。如果水中的导管口处有气泡冒出,松开手后,水在导管里形成了一段稳定的水柱,则装置的气密性良好。
2.如何检查图2装置的气密性?
答案:①打开止水夹,往长颈漏斗中加水使下端液封,②关闭止水夹继续向长颈漏斗中加水至长颈漏斗与试管中形成一定的液面差,静置一段时间液面差不变化说明装置气密性良好。
3.如何检查图3装置的气密性?
答案:关闭分液漏斗的活塞,把注射器的活栓向外拉一段距离,然后松手,如果注射器的活塞能恢复原状,则表明该装置气密性良好。
4.如何检查图4装置的气密性?
答案:打开止水夹,往长颈漏斗中加水使下端液封,然后从量气管处加水,使两端形成液面差,一段时间液面差不变,说明装置气密性良好。
5.如何检查图5装置的气密性?
答案:关闭活塞m、止水夹n,把装置中右侧的量气管下移一段距离,使装置左右两管形成一定的液面差,如果一段时间后液面差保持不变,则说明装置气密性良好。
6.图6所示为制取氯气的实验装置。盛放药品前,怎样检查此装置的气密性?
答案:向B、D中加水使导管口浸没在水面下,关闭分液漏斗活塞,打开止水夹K,微热A中的圆底烧瓶,D中导管有气泡冒出,停止加热,关闭止水夹K片刻后,D中导管倒吸入一段水柱,B中没入液面的导管口会产生气泡。有这些现象产生说明气密性良好。
三、操作语言·规范必记
1.分离操作
(1)怎样除去NaCl中的Na2SO4?
①取少量样品于试管中,加水溶解。首先加入过量的______溶液。判断是否沉淀完全的方法:________________________________________________________________________
________________________________________________________________________。
②然后应采取________操作。
③洗涤沉淀的方法是________________________________________________________________________
________________________________________________________________________。
④判断沉淀是否洗净的方法:________________________________________________________________________
________________________________________________________________________。
(2)怎样从NaCl溶液中制取NaCl固体?
①制取方法:________________;
②操作步骤:________________________________________________________________________
________________________________________________________________________。
(3)怎样从Na2CO3溶液中制取Na2CO3·10H2O晶体?
①制取方法:________________;
②操作步骤:________________________________________________________________________
________________________________________________________________________。
(4)怎样分离乙醇和乙酸?
①应先加入________________,采取________方法(填分离方法)。
②在实验时,应加入________防________,温度计水银球在____________________,冷凝水进出方向____________。
答案:(1)①BaCl2 取少许上层清液于试管中,再滴入BaCl2溶液,若不再产生沉淀,则说明已沉淀完全(注:若未沉淀完全,须将取出的溶液倒回原容器,继续滴加沉淀剂)
②过滤
③在漏斗中注入蒸馏水至浸没沉淀,使之自然滤出,重复2~3次
④取最后一次洗涤液,加入AgNO3溶液,若无白色沉淀,则证明沉淀已洗净,反之未洗净
(2)①蒸发结晶
②蒸发皿中注入溶液,蒸发(玻璃棒不停搅拌)至大量晶体析出时,即停止加热,利用余热继续蒸干
(3)①浓缩结晶
②蒸发皿中注入溶液,蒸发(玻璃棒不停搅拌)至刚析出晶体时,即停止加热,将溶液迅速转移至烧杯,使之冷却结晶并过滤
(4)①NaOH溶液 蒸馏
②碎瓷片 暴沸 蒸馏烧瓶支管口处 下进上出
2.怎样洗涤玻璃仪器?洗净的标准是什么?
答案:洗涤的基本方法:先注入少量水,振荡倒掉,冲洗外壁,若仍有污迹,用试管刷刷洗或用洗涤液处理,最后用蒸馏水冲洗。洗净的标准是内壁均匀附着一层水膜,既不聚成水滴,也不成股流下。
3.pH试纸的用途是什么?怎样使用pH试纸?使用时应注意什么?
答案:pH试纸的用途:用来测试溶液的酸碱性,或测试气体的性质。
pH试纸的使用方法:(1)检验溶液:取试纸放在表面皿上,用玻璃棒蘸取待测液,点在pH试纸中部,待变色之后,与标准比色卡相对比,读出pH。(2)检验气体:润湿后用镊子夹取或粘在玻璃棒的一端,靠近集气瓶口,通过观察试纸的颜色变化判断气体的性质。
使用pH试纸时的注意事项:在使用pH试纸测定溶液的pH时,不能润湿。
相关文档
- 2020版高考一轮复习化学通用版学案2021-07-088页
- 2020版高考化学一轮复习化学能与热2021-07-0813页
- 2020届高考化学一轮复习化学反应速2021-07-0728页
- 2020届高考化学一轮复习化学平衡状2021-07-078页
- 2021届高考化学一轮复习化学反应速2021-07-0738页
- 2020届高考化学一轮复习化学平衡常2021-07-077页
- 2021届高考化学一轮复习化学实验方2021-07-077页
- 2021届高考化学一轮复习化学实验方2021-07-075页
- 2021届高考化学一轮复习化学平衡状2021-07-0726页
- 2020届高考化学一轮复习化学键作业2021-07-0717页