- 1017.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考总复习
第2讲 镁、铝及其化合物
[考纲要求]
1.了解镁、铝及其重要化合物的制备方法。2.掌握镁、铝的主要性质及应用。3.掌握镁、铝的重要化合物的主要性质及应用。
镁、铝的性质及应用
知识梳理
1.镁、铝的结构与物理性质
镁和铝分别位于第____周期的____族和____族。它们的原子核外均有____个电子层,其原子结构示意图分别为________、________;铝的熔沸点比镁的____、硬度比镁的____。
2.金属铝的化学性质
(1)
(2)2Al+3Cl22AlCl3
(3)
(4)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(5)铝热反应
①实验原理:____________________________________。
铝粉还原氧化铁的实验装置如图所示。
②反应方程式:____________________________。
③实验现象:________________________________________________________________________。
④镁条、氯酸钾的作用:________。
24
高考总复习
⑤应用:________________________________________________________________________。
________________________。
3.铝的用途
纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
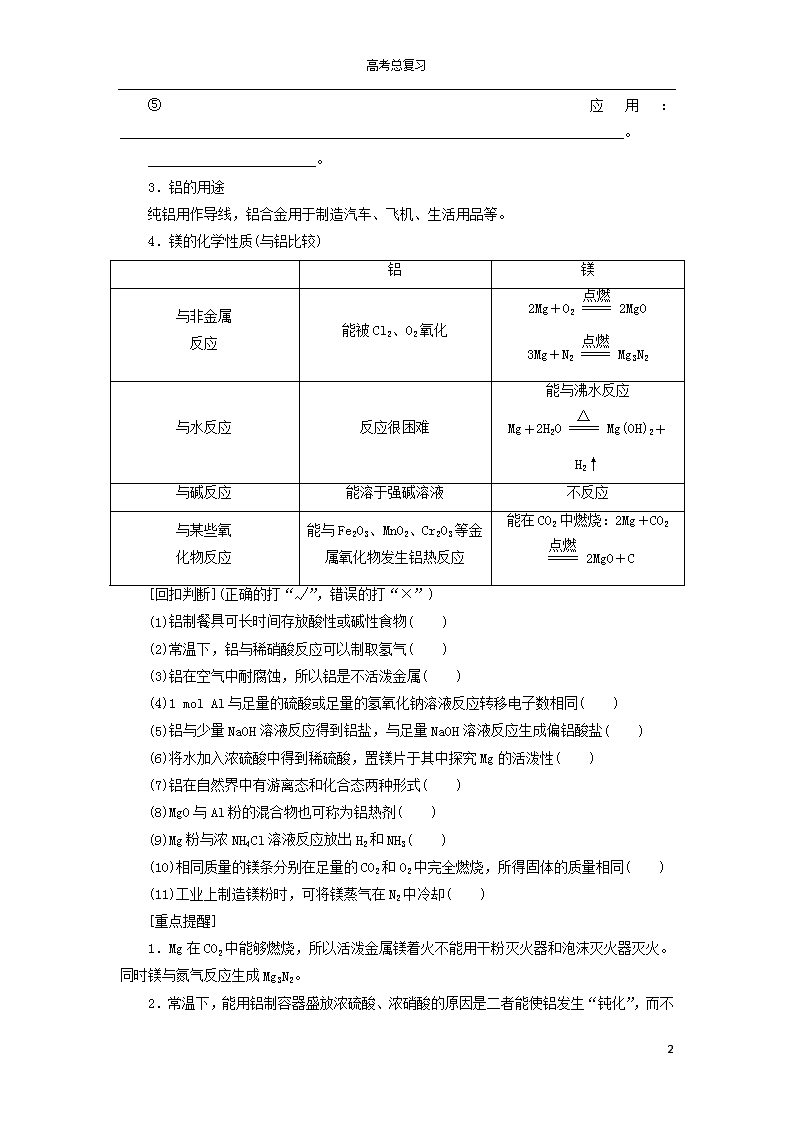
4.镁的化学性质(与铝比较)
铝
镁
与非金属
反应
能被Cl2、O2氧化
2Mg+O22MgO
3Mg+N2Mg3N2
与水反应
反应很困难
能与沸水反应
Mg+2H2OMg(OH)2+H2↑
与碱反应
能溶于强碱溶液
不反应
与某些氧
化物反应
能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应
能在CO2中燃烧:2Mg+CO22MgO+C
[回扣判断](正确的打“√”,错误的打“×”)
(1)铝制餐具可长时间存放酸性或碱性食物( )
(2)常温下,铝与稀硝酸反应可以制取氢气( )
(3)铝在空气中耐腐蚀,所以铝是不活泼金属( )
(4)1 mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同( )
(5)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐( )
(6)将水加入浓硫酸中得到稀硫酸,置镁片于其中探究Mg的活泼性( )
(7)铝在自然界中有游离态和化合态两种形式( )
(8)MgO与Al粉的混合物也可称为铝热剂( )
(9)Mg粉与浓NH4Cl溶液反应放出H2和NH3( )
(10)相同质量的镁条分别在足量的CO2和O2中完全燃烧,所得固体的质量相同( )
(11)工业上制造镁粉时,可将镁蒸气在N2中冷却( )
[重点提醒]
1.Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。同时镁与氮气反应生成Mg3N2。
24
高考总复习
2.常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
3.能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
4.铝与强碱溶液的反应中,水作氧化剂(NaOH不是氧化剂):
5.铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。铝不能与MgO反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
对点速练
练点一 镁、铝的性质判断
1.镁、铝单质的化学性质以相似为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是( )
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④ B.②③
C.①③ D.②③④
2.现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计①:铝镁合金测定生成的气体在标准状况下的体积
实验设计②:铝镁合金测定生成的气体在标准状况下的体积
实验设计③:铝镁合金过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是( )
A.都能 B.都不能
C.①不能,其他都能 D.②③不能,①能
练点二 镁、铝的有关计算
3.把铝粉和氧化铁粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸起反应;另一份放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是( )
A.1:1 B.2:3
C.3:2 D.28:9
4.Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48
24
高考总复习
L,下列推断中不正确的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共提供0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol H2
方法技巧
铝与酸、碱反应生成H2的量的关系
铝与酸、碱反应的化学方程式分别为2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑。从化学方程式可以看出Al与酸、碱反应时生成H2的实质都是Al,所以无论与酸还是与碱反应,Al与H2的关系都是2Al~3H2。
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比=。
(2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比=。
(3)一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体积比<<,则必定是a.铝与盐酸反应时,铝过量而盐酸不足;b.铝与氢氧化钠反应时,铝不足而氢氧化钠过量。解题时应充分利用上述过量关系。
铝的重要化合物
1.氧化铝(Al2O3)
(1)物理性质:白色固体,____溶于水,有很高的熔点。
(2)化学性质(两性氧化物)
①与HCl反应 ________________________。
②与NaOH反应 ____________________。
2.氢氧化铝[Al(OH)3]
(1)物理性质
白色胶状不溶于水的固体,有较强的____性。
(2)化学性质(两性氢氧化物)
Al(OH)3的电离方程式为
24
高考总复习
①
②受热分解:______________________。
3.制备
(1)向铝盐中加入氨水,离子方程式为______________________。
(2)NaAlO2溶液中通入足量CO2,离子方程式为________________________。
(3)NaAlO2溶液与AlCl3溶液混合:________________________________。
4.常见的铝盐及其应用
(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的____盐。
(2)明矾的化学式为______________,它是无色晶体,可溶于水,水溶液pH____7(选填“<”“>”或“=”)。明矾可以净水,其净水的原理是________________________。
[回扣判断](正确的打“√”,错误的打“×”)
(1)明矾用作净水剂不涉及化学变化( )
(2)氢氧化铝具有弱碱性,可用于制胃酸中和剂( )
(3)向1 mol·L-1 AlCl3溶液中加过量的6 mol·L-1 NaOH溶液制备Al(OH)3悬浊液( )
(4)向NaAlO2溶液中通入过量CO2制Al(OH)3的离子方程式:CO2+AlO+2H2O===Al(OH)3↓+HCO( )
(5)Al(OH)3既能与稀硫酸反应又能与NaOH溶液反应( )
(6)明矾的化学式为Al2(SO4)3·12H2O( )
(7)下列物质的转化在给定条件下能够实现:
Al2O3NaAlO2(aq)Al(OH)3( )
[重点提醒]
既能与酸反应,又能与碱反应的物质
(1)Al、Al2O3、Al(OH)3
(2)弱酸的铵盐,如:NH4HCO3、CH3COONH4等
(3)弱酸的酸式盐:如NaHCO3、KHS、NaHSO3等
24
高考总复习
(4)氨基酸
(5)蛋白质
两性物质是指既能与酸反应又能与碱反应生成盐和水的化合物,上述物质中只有Al2O3、Al(OH)3、氨基酸、蛋白质是两性物质。
对点速练
练点一 Al2O3、Al(OH)3的两性
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①Ca(OH)2 ②Al2O3 ③Ca(HCO3)2
④Al(OH)3 ⑤NaHSO4 ⑥Al ⑦(NH4)2S
A.②④⑥ B.②③⑤⑥
C.①③④⑥ D.②③④⑥⑦
2.探究氢氧化铝的两性,最适宜的试剂是( )
A.Al、NaOH溶液、稀盐酸
B.Al2O3、氨水、稀盐酸
C.Al2(SO4)3溶液、NaOH溶液、稀盐酸
D.AlCl3溶液、氨水、稀盐酸
练点二 Al(OH)3的制备方案
3.用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③
C.②③⑤③ D.①③⑤③
4.实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种实验方案:
方案①
Al→Al3+→Al(OH)3
方案②
Al→AlO→Al(OH)3
方案③
→Al(OH)3
(1)用方案①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是________________________________________________________________________
________________________________________________________________________;
写出该方案中有关的离子方程式:________________________________________________________________________
________________________________________________________________________。
24
高考总复习
(2)用方案②来制备Al(OH)3时,必须注意______的用量,以防止生成的Al(OH)3溶解。
(3)三种方案中,你认为最好的是________(填序号),原因是________________________________________________________________________。
方法总结
Al(OH)3的三种制备方法
方法一:可溶性铝盐溶液与过量氨水反应
反应原理:Al3++3NH3·H2O===Al(OH)3↓+3NH
方法二:向可溶性偏铝酸盐溶液中通入过量CO2
反应原理:AlO+2H2O+CO2===Al(OH)3↓+HCO
方法三:相互促进水解法
练点三 化工流程中的“铝”
5.工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
对上述流程中的判断正确的是( )
A.试剂X可以为氨水,沉淀中含有铁的化合物
B.CO2可以用H2SO4溶液或稀盐酸代替
C.反应Ⅱ中的离子方程式为CO2+AlO+2H2O===Al(OH)3↓+HCO
D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低
6.铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
24
高考总复习
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为______________________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是________________________________________________________________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为______________________________,阴极产生的物质A的化学式为________。
(5)铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________________________________________________。
方法总结
从铝土矿中提取氧化铝的两种方法
铝土矿的主要成分是Al2O3,含有的杂质是Fe2O3和SiO2,由于Al2O3具有两性,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物。因而可设计出两种提纯氧化铝的方案。
方法一 酸溶法
24
高考总复习
方法二 碱溶法
1.[高考选项组合]下列说法或性质对应用途正确的是( )
A.氢氧化铝可用于中和过多胃酸[2018·全国卷Ⅱ,7]
B.KAl(SO4)2·12H2O溶于水可形成Al(OH)3胶体[2018·江苏卷,6B]
C.Al2O3是两性氧化物,可用作耐高温材料[2018·江苏卷,3C]
D.给定条件转化:
Al(s)NaAlO2(aq)Al(OH)3(s)[2018·江苏卷,9B]
2.[2019·全国卷Ⅰ,26]硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95
24
高考总复习
℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为____________________________。
(2)“滤渣1”的主要成分有____________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是____________。
(3)根据H3BO3的解离反应:H3BO3+H2OH++B(OH),Ka=5.81×10-10,可判断H3BO3是________________酸;在“过滤2”前,将溶液pH调节至3.5,目的是________________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为________________,母液经加热后可返回________________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是____________。
3.[2018·江苏卷]以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为__________________。
(2)添加1% CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如下图所示。
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1-)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700 ℃焙烧时,添加1% CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是____________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由________(填化学式)转化为________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2
24
高考总复习
混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=________。
4.[2016·浙江卷,27Ⅰ]化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)427H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据________________________________________________________________________
________________________________________________________________________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________________________________________________________________________
________________________________________________________________________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________________________________________________________________
________________________________________________________________________。
5.[2016·海南卷,14]KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
(1)为尽量少引入杂质,试剂①应选用________(填标号)。
a.HCl溶液 b.H2SO4溶液
c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)沉淀B的化学式为________________________________________________________________________;
将少量明矾溶于水,溶液呈弱酸性,其原因是________________________________________________________________________
________________________________________________________________________。
(4)已知:Kw=1.0×10-14,Al(OH)3AlO+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于________。
24
高考总复习
“铝三角”中的图像题
【知识基础】
一、Al3+、Al(OH)3、AlO之间的转化关系——“铝三角”
1.写出上述转化的离子方程式:
(1)①______________________。
②________________________。
③________________________。
(2)________________________。
(3)________________________。
(4)________________________。
(5)①________________________。
②________________________。
(6)________________________。
2.掌握Al3+、Al(OH)3、AlO三者之间的转化比例:
二、四个基本图像
1.可溶性铝盐溶液与NaOH溶液反应的图像:
操作
向可溶性铝盐溶液中逐滴加入NaOH溶液至过量
向NaOH溶液中逐滴加入可溶性铝盐溶液至过量
现象
立即产生白色沉淀→渐多→最多→渐少→消失
无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失
24
高考总复习
图像
离子
方程
式
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO+2H2O
Al3++4OH-===AlO+2H2O
3AlO+Al3++6H2O===4Al(OH)3↓
2.偏铝酸盐溶液与盐酸反应的图像:
操作
向偏铝酸盐溶液中逐滴加入稀盐酸至过量
向稀盐酸中逐滴加入偏铝酸盐溶液至过量
现象
立即产生白色沉淀→渐多→最多→渐少→消失
无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失
图像
离子
方程
式
AlO+H++H2O===Al(OH)3↓
Al(OH)3+3H+===Al3++3H2O
AlO+4H+===Al3++2H2O
Al3++3AlO+6H2O===
4Al(OH)3↓
三、三个拓展图像
1.向AlCl3溶液中逐滴加入氨水或NaAlO2溶液至过量,图像如图1所示。
2.向NaAlO2溶液中逐滴加入AlCl3溶液或通入CO2至过量,图像如图2所示。
3.向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量,沉淀图像如图3所示,反应的先后顺序与图像关系为
24
高考总复习
(1)H+H2O
(2)Mg2+、Al3+Mg(OH)2、Al(OH)3
(3)NHNH3·H2O
(4)Al(OH)3AlO
【素养专练】
一、单一图像的判断计算
1.向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,下图[n表示Al(OH)3的物质的量,V表示NaOH溶液的体积]能正确表示这个反应过程的是( )
二、复合图像的判断计算
2.[Al3+、AlO形成Al(OH)3图像的综合分析]如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是( )
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO的物质的量的变化
3.某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的HCO、CO、AlO、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
24
高考总复习
A.原混合溶液中的CO与AlO的物质的量之比为1:2
B.V1:V2=1:5
C.M点时生成的CO2为0.05 mol
D.e曲线表示的离子方程式为Al(OH)3+3H+===Al3++3H2O
4.向盛有10 mL 1 mol·L-1 NH4Al(SO4)2溶液的烧杯中滴加 1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如图:
(1)写出m点反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(2)若在NH4Al(SO4)2溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol。
三、不规则图像的分析
5.室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
6.某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
【实验】 在0.1 mol·L-1 MgSO4、0.05 mol·L-1Al2(SO4)3的混合溶液中滴加0.5 mol·L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。
24
高考总复习
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于________(填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是________________________________________________________________________
________________________________________________________________________。
(3)对第二阶段(b点~c点)溶液pH变化缓慢的本质,小组同学作出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:________________________________________________________________________;
推测3:________________________________________________________________________。
若推测1符合实际情况,则a点之前反应的离子方程式为______________________________,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异________________________________________________________________________。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
较大量存在的含金属元素的离子
检验方法
24
高考总复习
第2讲 镁、铝及其化合物
基础精讲练
考点一
1知识梳理
1.三 ⅡA ⅢA 3 Mg Al 高 大
2.(1)4Al+3O22Al2O3 (3)钝化 2Al+6HCl===2AlCl3+3H2↑ (5)高温下铝将较不活泼的金属从其氧化物中还原出来 2Al+Fe2O3Al2O3+2Fe 剧烈燃烧,发出耀眼的白光,有液珠滴落到盛有细沙的蒸发皿中 引燃剂 a.在冶金工业上常用这一原理制取熔点较高的金属,如铬、锰等,3MnO2+4Al2Al2O3+3Mn b.该反应原理可以应用在生产上,如焊接钢轨等
回扣判断 答案:(1)× (2)× (3)× (4)√ (5)× (6)× (7)× (8)× (9)√ (10)× (11)×
2对点速练
1.解析:Al能与NaOH溶液反应而Mg不能;Mg能在CO2中燃烧而Al不能。
答案:C
2.解析:已知质量的铝镁合金,实验设计①、②中,利用金属的质量、氢气的量可计算出镁的质量,进而求得其质量分数;实验设计③中,沉淀的质量为氢氧化镁的质量,由元素守恒可知镁的质量,进而求得其质量分数,即三个实验方案中均可测定镁的质量分数。
答案:A
3.解析:铝粉和氧化铁粉末在高温下恰好完全反应生成铁与氧化铝,由得失电子守恒可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子得失守恒可知,n(H2)=n(Fe),所以n(H2)=n(Al);直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子得失守恒可知2n′(H2)=3n(Al),所以n′(H2)=(Al)。故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=
24
高考总复习
n(Al) :(Al)=2:3,故选B。
答案:B
4.解析:反应的实质为Mg+2H+===Mg2++H2↑,2Al+6H+===2Al3++3H2↑,n(H2)==0.2 mol,则参加反应的n(HCl)=n(H+)=0.4 mol。因为盐酸过量,故产生H2的量取决于金属的量,所以若换成过量的稀H2SO4,同样产生0.2 mol H2。依据得失电子守恒,由2H+→H2得电子总数为0.4 mol。0.2 mol Mg在反应中提供0.4 mol电子,0.2 mol Al在反应中提供0.6 mol电子,0.2 mol Mg、Al混合物提供的电子应大于0.4 mol而小于0.6 mol,A项不正确。
答案:A
考点二
1知识梳理
1.(1)难 (2)Al2O3+6HCl===2AlCl3+3H2O Al2O3+2NaOH===2NaAlO2+2H2O
2.(1)吸附 Al(OH)3+3HCl===AlCl3+3H2O Al(OH)3+NaOH===NaAlO2+2H2O 2Al(OH)3Al2O3+3H2O
3.(1)Al3++3NH3·H2O===Al(OH)3↓+3NH (2)AlO+CO2+2H2O===Al(OH)3↓+HCO (3)3AlO+Al3++6H2O===4Al(OH)3↓
4.(1)复 (2)KAl(SO4)2·12H2O < Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中杂质形成沉淀而净水
回扣判断 答案:(1)× (2)√ (3)× (4)√ (5)√ (6)× (7)√
2对点速练
1.解析:①Ca(OH)2与氢氧化钠不反应;②Al2O3是两性氧化物,既能与盐酸反应,又能与氢氧化钠溶液反应;③Ca(HCO3)2是弱酸的酸式盐,与盐酸反应生成氯化钙、二氧化碳和水,与氢氧化钠反应生成碳酸钙、碳酸钠和水;④Al(OH)3是两性氢氧化物,既能与盐酸反应,又能与氢氧化钠溶液反应;⑤NaHSO4与盐酸不反应;⑥Al与盐酸反应生成氯化铝和氢气,与氢氧化钠溶液反应生成偏铝酸钠和氢气;⑦(NH4)2S是弱酸弱碱盐,与盐酸反应生成硫化氢和氯化铵,与氢氧化钠溶液反应生成硫化钠和一水合氨。
答案:D
2.解析:可溶性的铝盐Al2(SO4)3溶液与少量NaOH溶液反应生成氢氧化铝沉淀,继续加过量的氢氧化钠,氢氧化铝沉淀会溶解,氢氧化铝沉淀中加盐酸也会溶解。
答案:C
3.解析:若先加盐酸,Mg、Al均溶解,制取Al(OH)3的步骤较多;从NaAlO2
24
高考总复习
制备Al(OH)3,加盐酸不容易控制量的多少,故B项操作步骤为最佳顺序。
答案:B
4.答案:(1)若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量 2Al+6H+===2Al3++3H2↑,Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)稀硫酸 (3)③ 药品用量最少,操作最为简单
5.解析:A项,试剂X应为强碱溶液,使Al2O3溶解;B项,若用强酸代替CO2,强酸过量时,Al(OH)3会溶解,不能生成Al(OH)3沉淀;D项,因Al比Fe活泼,不能用Fe置换Al。
答案:C
6.解析:(1)“碱溶”时,Al2O3与NaOH反应生成NaAlO2和H2O,注意离子方程式。
(2)“过滤Ⅰ”所得滤液为NaAlO2溶液,加入NaHCO3溶液,过滤Ⅱ后电解的是Na2CO3溶液,说明溶液的溶质由NaAlO2变为Na2CO3,发生反应AlO+HCO+H2O===Al(OH)3↓+CO,说明AlO结合H+能力强于CO,即其水解能力强,说明碱性NaAlO2>Na2CO3,溶液的pH减小。
(3)电解Al2O3,阳极O2-放电生成O2,石墨(C)电极会被O2氧化。
(4)阳极溶液中的阴离子即水中的OH-放电生成O2(图示)及H+(2H2O-4e-===O2↑+4H+),H+与CO结合生成HCO(CO+H+===HCO,由图阳极区Na2CO3生成NaHCO3),写出总反应:4CO+2H2O-4e-===4HCO+O2↑。阴极,水中的H+放电生成H2。
(5)NH4Cl加热时分解生成HCl和NH3,HCl可以破坏铝表面的氧化膜,有利于反应进行。
答案:(1)Al2O3+2OH-===2AlO+H2O
(2)减小
(3)石墨电极被阳极上产生的O2氧化
(4)4CO+2H2O-4e-===4HCO+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
真题全体验
1.答案:AB
2.解析:本题涉及的考点有离子方程式的书写、Fe3+的检验、化学平衡常数的应用,考查了学生解读化学工艺流程,将题给信息与已学知识相结合分析、解决化学问题的能力。
(1)“溶浸”步骤产生的“气体”是NH3,用NH4HCO3溶液吸收NH3的化学方程式为NH3+NH4HCO3===(NH4)2CO3。
(2)根据流程图可知,Fe2O3、Al2O3在“过滤1”步骤中除去,SiO2不溶于(NH4)2SO4
24
高考总复习
溶液,故“滤渣1”的主要成分有SiO2、Fe2O3、Al2O3;检验Fe3+通常选用KSCN溶液。
(3)根据H3BO3的解离反应以及电离平衡常数,可判断H3BO3是一元弱酸;在“过滤2”操作前B元素主要以B2O的形式存在,调节pH至3.5后生成了H3BO3沉淀,由此可推断调节pH的目的是将B2O转化成H3BO3。
(4)反应物有Mg2+、CO,生成物有Mg(OH)2·MgCO3沉淀,再结合电荷守恒、原子守恒可写出反应的离子方程式;“沉镁”后的母液的主要成分为(NH4)2SO4,可供“溶浸”工序循环使用;Mg(OH)2、MgCO3在高温条件下均易分解生成MgO,故高温焙烧碱式碳酸镁可以制备轻质氧化镁。
答案:(1)NH4HCO3+NH3===(NH4)2CO3
(2)SiO2、Fe2O3、Al2O3 KSCN
(3)一元弱 转化为H3BO3,促进析出
(4)2Mg2++3CO+2H2O===Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O===Mg(OH)2·MgCO3↓+CO2↑]
溶浸 高温焙烧
3.解析:(1)二氧化硫是酸性氧化物,少量二氧化硫与NaOH溶液反应生成正盐Na2SO3,过量二氧化硫与NaOH溶液反应生成NaHSO3。
(2)①根据高硫铝土矿的成分中含FeS2和金属硫酸盐,而已知多数金属硫酸盐的分解温度都高于600 ℃,如果不添加CaO在低于500 ℃焙烧,则去除的硫元素主要来源于FeS2,具体的反应原理为4FeS2+11O22Fe2O3+8SO2。②添加的CaO吸收SO2生成CaSO3,CaSO3易被空气中的氧气氧化为CaSO4。根据题目所给“多数金属硫酸盐的分解温度都高于600 ℃”,可知700 ℃时CaSO4可能未分解或未完全分解而留在矿粉中,从而导致添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低。
(3)高硫铝土矿中的氧化铝溶于NaOH生成NaAlO2:Al2O3+2NaOH===2NaAlO2+H2O;向NaAlO2溶液中通入过量的二氧化碳,生成氢氧化铝:CO2(过量)+2H2O+NaAlO2===Al(OH)3↓+NaHCO3。
(4)根据得失电子守恒可知FeS2与Fe2O3的物质的量之比为1:16。
答案:
(1)OH-+SO2===HSO
(2)①FeS2 ②硫元素转化为CaSO4而留在矿粉中
(3)NaAlO2 Al(OH)3
(4)1:16
4.解析:
24
高考总复习
(1)由题中所给的化学方程式知,该化合物可作阻燃剂,原因在于:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)因氧化镁为碱性氧化物,不溶于强碱,而氧化铝为两性氧化物,可溶于强碱,离子方程式为:Al2O3+2OH-===2AlO+H2O。
(3)氯化铵为强酸弱碱盐,在水溶液中发生水解NH4Cl+H2ONH3·H2O+HCl,溶液呈酸性,能把氧化镁溶解:MgO+2HCl===MgCl2+H2O。或两者相加即得:MgO+2NH4Cl+H2O===MgCl2+2NH3·H2O。
答案:
(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气
(2)Al2O3+2OH-===2AlO+H2O
(3)MgO+2NH4Cl+H2O===MgCl2+2NH3·H2O(或NH4Cl+H2ONH3·H2O+HCl、MgO+2HCl===MgCl2+H2O)
5.解析:(1)易拉罐的主要成分为Al,含有少量的Fe、Mg杂质,试剂①的作用是将Al溶解,HCl溶液和H2SO4溶液可溶解Al及Fe、Mg杂质,会引入Fe2+、Mg2+,氨水不溶解Al,NaOH溶液可溶解Al,但不溶解Fe、Mg杂质,故d项符合。
(2)选用NaOH溶液溶解易拉罐,主要发生反应
2Al+2OH-+2H2O===2AlO+3H2↑。
(3)滤液A中铝元素以AlO形式存在,与溶液中HCO发生复分解反应:AlO+HCO+H2O===Al(OH)3↓+CO,故沉淀B为Al(OH)3,明矾溶于水时,KAl(SO4)2===K++Al3++2SO,Al3++3H2OAl(OH)3+3H+,使溶液呈弱酸性。
(4)Al(OH)3溶于NaOH溶液发生反应:Al(OH)3+OH-===AlO+2H2O K1,可分两步进行:
Al(OH)3AlO+H++H2O K
H++OH-===H2O
则K1===20。
答案:(1)d
(2)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(3)Al(OH)3 Al3+水解,使溶液中H+浓度增大
(4)20
微专题·大素养⑤
【知识基础】
1.(1)Al3++3NH3·H2O===Al(OH)3↓+3NH Al3++3AlO+6H2O===4Al(OH)3↓ Al3++3OH-===Al(OH)3↓
24
高考总复习
(2)Al(OH)3+3H+===Al3++3H2O (3)Al3++4OH-===AlO+2H2O (4)AlO+4H+===Al3++2H2O (5)AlO+CO2+2H2O===Al(OH)3↓+HCO AlO+H++H2O===Al(OH)3↓ (6)Al(OH)3+OH-===AlO+2H2O
【素养专练】
1.解析:向混合溶液中逐滴滴入NaOH溶液,反应情况分为三个阶段:第一阶段为OH-+H+===H2O,此时无沉淀产生;第二阶段有白色沉定产生,反应的离子方程式为Al3++3OH-===Al(OH)3↓;第三阶段滴加NaOH溶液至过量,沉淀逐渐溶解最后完全消失,反应的离子方程式为Al(OH)3+OH-===AlO+2H2O,结合反应方程式及浓度关系可知三个阶段消耗NaOH物质的量之比为1:3:1。
答案:D
2.解析:AlCl3溶液与NaOH溶液混合有两种方式:向AlCl3溶液中缓慢滴加NaOH溶液,开始有沉淀生成,后沉淀溶解,且生成沉淀与沉淀溶解消耗的NaOH的物质的量之比为3:1,显然符合题意,则x表示NaOH的物质的量,B项错误;另一种方式是向NaOH溶液中缓慢滴加AlCl3溶液,开始没有沉淀,后有沉淀生成,与本题图示情况不符。
答案:B
3.解析:向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,首先发生反应:AlO+H++H2O===Al(OH)3↓,a表示AlO,根据盐酸消耗的体积可知:n(H+)=n(AlO)=n[Al(OH)3]=1 mol·L-1×0.05 L=0.05 mol;当AlO反应完全,CO反应,b表示CO,反应的离子方程式是:CO+H+===HCO,n(H+)=n(CO)=0.05 L×1 mol·L-1=0.05 mol;c、d表示HCO,CO反应完全,产生的HCO会发生反应:HCO+H+===CO2↑+H2O,n(HCO)=n(H+)=0.05 L×1 mol·L-1=0.05 mol;当HCO反应完全,Al(OH)3发生反应:Al(OH)3+3H+===Al3++3H2O,e表示Al3+,当Al(OH)3反应完全,消耗HCl的物质的量是Al(OH)3的3倍,n(H+)=3n[Al(OH)3]=3×0.05 mol=0.15 mol,则该阶段加入盐酸的体积是=0.15 L=150 mL。原混合溶液中的CO与AlO的物质的量之比为0.05 mol:0.05 mol=1:1,A错误;在原混合物中n(CO)=0.05 mol,在V1时溶液中的CO和HCO的物质的量相等,都等于0.025 mol,根据方程式:CO+H+===HCO可知反应0.025 mol CO时消耗盐酸的物质的量是0.025 mol,盐酸的体积为=0.025 L=25 mL,故V1=50 mL+25 mL=75 mL,根据前面的分析可知:V2=150 mL+150 mL=300 mL,所以V1:V2=75 mL:300 mL=1:4,B错误;根据前面的分析可知M点时溶液中CO完全转化为HCO,没有产生CO2,C错误;根据前面的分析可知,e曲线表示反应:Al(OH)3+3H+===Al3++3H2O,D正确。
答案:D
24
高考总复习
4.解析:(1)向NH4Al(SO4)2溶液中加入NaOH溶液,由图像分析,先发生Al3++3OH-===Al(OH)3↓,之后是NH+OH-===NH3·H2O,最后是沉淀的溶解:Al(OH)3+OH-===AlO+2H2O,故m点的离子反应为NH+OH-===NH3·H2O。
(2)因NH4Al(SO4)2的物质的量为0.01 L×1 mol·L-1=0.01 mol,Ba(OH)2的物质的量为0.02 L×1.2 mol·L-1=0.024 mol,产生沉淀的反应有两类。一是SO+Ba2+===BaSO4↓,n(SO)=0.01 mol×2=0.02 mol,0.02 mol<0.024 mol,故n(BaSO4)=0.02 mol;二是OH-参与的反应,
Al3+ + 3OH- === Al(OH)3↓
0.01 mol 0.03 mol 0.01 mol
OH-余0.024 mol×2-0.03 mol=0.018 mol,之后发生反应:NH+OH-===NH3·H2O,n(NH)=0.01 mol,再消耗OH- 0.01 mol,则剩余OH-为0.018 mol-0.01 mol=0.008 mol,最后发生沉淀的溶解:Al(OH)3+OH-===AlO+2H2O,OH-为 0.008 mol,溶解0.008 mol Al(OH)3,则剩余Al(OH)3为 0.01 mol-0.008 mol=0.002 mol。溶液中产生沉淀的物质的量为0.02 mol+0.002 mol=0.022 mol。
答案:(1)NH+OH-===NH3·H2O
(2)0.022
5.解析:A项,Al2(SO4)3为强酸弱碱盐,Al3+水解使溶液显酸性,离子方程式应为Al3++3H2OAl(OH)3+3H+,错误;B项,a~b段,加入NaOH消耗H+,使Al3++3H2OAl(OH)3+3H+反应正向进行,Al3+的浓度减小,错误;C项,b~c段,pH变化不明显,说明OH-主要用于生成Al(OH)3沉淀,正确;D项,c~d过程中,pH变化较大,当pH>10以后有比较平的阶段,说明发生了反应:Al(OH)3+NaOH===Na[Al(OH)4],所以d点以后Al(OH)3溶解完全,之后pH再变大较快,错误。
答案:C
6.解析:(2)溶液中含有镁离子、铝离子,所以加入氢氧化钠溶液后,在a点之前一定有白色沉淀生成并逐渐增多。
(3)加入氢氧化钠溶液后,b点~c点溶液的pH基本无变化,说明消耗OH-,消耗OH-的反应有Mg2+与OH-的反应、Al3+与OH-的反应、Al(OH)3与OH-的反应,所以推测2和3分别是生成Al(OH)3沉淀、Al(OH)3沉淀溶解,消耗OH-;若推测1符合实际情况,说明a点前为Al3+与OH-反应生成氢氧化铝沉淀,离子方程式是Al3++3OH-===Al(OH)3↓;此事实说明氢氧化铝比氢氧化镁更难溶于水。
(4)e点后溶液中较大量存在的含金属元素的离子为偏铝酸根离子和钠离子。检验钠离子,应用焰色反应;检验偏铝酸根离子,应滴加稀盐酸,开始有白色沉淀产生,继续滴加稀盐酸,白色沉淀溶解。
答案:
24
高考总复习
(1)碱式滴定管
(2)生成白色沉淀并逐渐增多
(3)生成Al(OH)3沉淀,消耗OH- Al(OH)3沉淀溶解,消耗 OH- Al3++3OH-===Al(OH)3↓
Al(OH)3比Mg(OH)2更难溶于水
(4)
较大量存在的含
金属元素的离子
检验方法
Na+
用洁净的铂丝蘸取少量待测液在无色火焰上灼烧,若火焰呈黄色,表明存在Na+
AlO
取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解,表明存在AlO
24
相关文档
- 2020高中化学第一章认识有机化合物2021-07-084页
- 高中化学第四单元化学与技术的发展2021-07-086页
- 高中化学第一章有机化合物的结构与2021-07-0817页
- 广东2020年普通高中学业水平考试化2021-07-0812页
- 2020高中化学专题4烃的衍生物第二2021-07-089页
- 2020高中化学课时跟踪训练13分子晶2021-07-087页
- 高中化学课时作业10化学反应中的热2021-07-089页
- 高中化学必修二知识点总结全一册2021-07-0816页
- 2020_2021学年高中化学专题一化学2021-07-085页
- 高中化学必修1、必修2知识点归纳总2021-07-0816页