- 230.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届一轮复习人教版 化学反应中的能量变化应试策略 学案
【难点突破】
能源问题已成为世界热点问题,近几年对于化学能与热能的考查的试题数目呈上升趋势,考查内容主要有:热化学方程式的书写与正误判断、比较反应热的大小、反应热的计算、化学键与反应热、反应热与能源的综合考查,但近两年都是以反应热的计算为主,对于热化学方程式的书写与正误判断的考查有所弱化,在选择题中,只出现在个别试题的选项中,在二卷中主要考查盖斯定律的应用。由于能源问题已成为社会热点,从能源问题切入,从不同的角度设问,结合新能源的开发,把反应热与能源结合起来进行考查,将是今后命题的方向,预计2019年的高考中,反应热的计算仍是考查的热点,将在综合试题中结合实验或平衡原理进行考查。
一、“两角度”理解反应热
(1)从微观的角度说,是旧化学键断裂吸收的热量与新化学键形成放出的热量的差值,如下图所示。
a——旧化学键断裂吸收的热量;
b——新化学键形成放出的热量;
c——反应热。
(2)从宏观的角度说,是反应物自身的能量与生成物自身的能量差值,如上图所示。
a——活化能;
b——活化分子结合成生成物所释放的能量;
c——反应热。
二、对中和热和燃烧热的理解
(1)中和热不包括浓溶液稀释、电解质溶解、电离、生成沉淀所产生的热效应。
(2)强酸和强碱反应的中和热ΔH为-57.3 kJ·mol-1。强酸和弱碱或弱酸和强碱反应的中和热ΔH一般大于-57.3 kJ·mol-1,因为它们在中和反应过程中进一步电离需吸热,使中和反应中所放出热量被消耗一部分。
(1)等量的可燃物完全燃烧所放出的热量肯定比不完全燃烧所放出的热量多。
(2)产物相同时,同种气态物质燃烧放出的热量比等量的固态物质燃烧放出的热量多。反应物相同时,生成同种液态物质放出的热量比生成等量的气态物质放出的热量多。
5.【2018新课标1卷】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min
0
40
80
160
260
1300
1700
∞
p/kPa
35.8
40.3
42.5.
45.9
49.2
61.2
62.3
63.1
①已知:2N2O5(g)=2N2O5(g)+O2(g) ΔH1=−4.4 kJ·mol−1
2NO2(g)=N2O4(g) ΔH 2=−55.3 kJ·mol−1
则反应N2O5(g)=2NO2(g)+O2(g)的ΔH =_______ kJ·mol−1。
【答案】(2)①53.1
【最新试题】
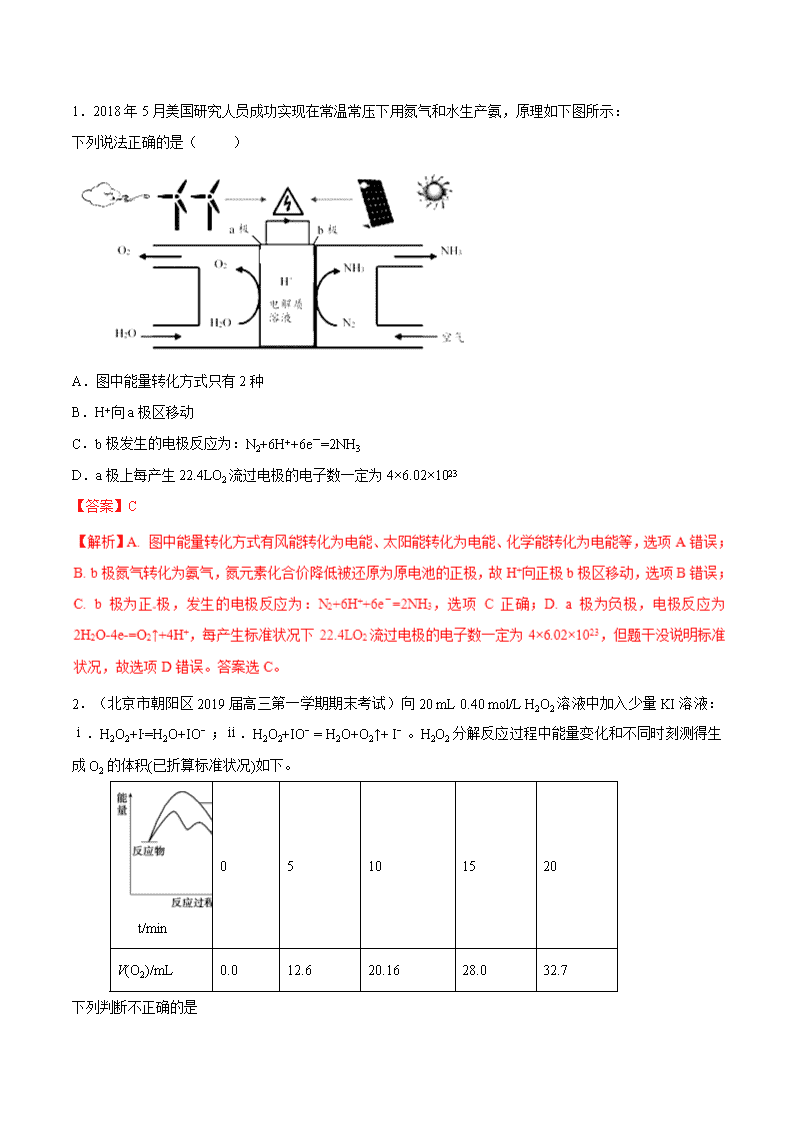
1.2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
A.图中能量转化方式只有2种
B.H+向a极区移动
C.b极发生的电极反应为:N2+6H++6e-=2NH3
D.a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
【答案】C
2.(北京市朝阳区2019届高三第一学期期末考试)向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
t/min
0
5
10
15
20
V(O2)/mL
0.0
12.6
20.16
28.0
32.7
下列判断不正确的是
A.从图中可以看出,KI能增大H2O2的分解速率
B.反应ⅰ是放热反应,反应ⅱ是吸热反应
C.0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D.H2O2在反应过程中既体现了氧化性,又体现了还原性
【答案】B
3.(湖北省鄂州市、黄冈市2019届高三上学期元月调研理科综合(节选))氨在工农业及国防工业上有广泛的用途。
(1)已知:
①4NH3(g)+3O2(g)2N2(g)+6H2O(g) △H=-1266.2k/mol
②2H2(g)+O2(g)2H2O(g) △H=-483.6kJ/mol
则合成氨反应N2(g)+3H2(g)2NH3(g) △H=___________kJ/mol,该反应属于___________。
A.高温自发 B.低温自发 C.恒自发 D.恒不自发
【答案】(1)-92.3 B
【解析】(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g),△H=-1266.2k/mol ;②2H2(g)+O2(g)2H2O(g),△H=-483.6kJ/mol,则合成氨反应N2(g)+3H2(g)2NH3(g),△H=-①/2+3/2②代入得,△H= -92.3 k/mol,反应后气体体积变小,是一个熵减的反应(ΔS<0),由△H-T△S可知ΔH<0,ΔS<0时,在低温下能自发进行。本题答案:△H= -92.3 k/mol;B
4.(江苏省天一中学2019届高三第三次诊断性测试(节选))C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·molˉ1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成 AlN 的总热化学方程式是___________________;
【答案】Al2O3(s)+3C(s)+N2(g)═2AlN(s)+3CO(g)△H=+1026kJ/mol
【解析】(1)2C(s)+O2(g)=2CO(g) △H1=-221kJ/mol ①
4Al(g)+3O2(g)=2Al2O3(s) △H2=-3351kJ/mol ②
2Al(g)+N2(g)=2AlN(s) △H3=-318kJ/mol ③
将方程式(3①-②)×1/2+③得Al2O3(s)+3C(s)+N2(g)═2AlN(s)+3CO(g),
△H=[3(-221kJ/mol)-(-3351kJ/mol)]×1/2+(-318 kJ/mol)=+1026kJ/mol,
5.(安徽省宣城市2019届高三上学期期末考试理科综合(节选))氮氧化物(NOx)是电厂主要排放污染物之一。工业上采用氨脱硝处理后排放,原理如下:
①4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1
②4NH3(g)+6NO(g)5N2(g)+6H2O(g) △H2=akJ·mol-1
当反应温度过高时,NH3会发生氧化反应:③NH3(g)+5O2(g)4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1
回答下列问题:
(2)反应②中的a=___________。
(3)反应③中,常用的催化剂有Cr2O3和Fe2O3,Cr2O3的催化效率更好一些。下列表示两种催化剂在反应③催化过程中的能量变化示意图合理的是___________(填字母序号)。
【答案】(2)-1815.0 (3) B
6.(黑龙江省哈尔滨市第六中学2019届高三上学期期末考试(节选))随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=________kJ·mol-1。
【答案】-12
【解析】(1)设C-H键能为x kJ/mol,ΔH=反应物总键能-生成物总键能=3x+351+463+3×393 -(3x+293 +2×393 +2×463)=-12kJ/mo1
7.(吉林省长春外国语学校2019届高三上学期期末考试(节选))研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NONO2N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_____________________________。
【答案】(1)3NO(g)+O3(g)===3NO2(g) ΔH=-317.1 kJ·mol-1 (2)否 该反应是焓增、熵减的反应,根据ΔG=ΔH-T·ΔS,ΔG>0
8.(黑龙江省牡丹江市第一高级中学2019届高三上学期期末考试(节选))近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
Ⅰ.用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)反应过程能量变化如图所示:
下列说法正确的是_____。
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,能改变该反应的活化能和反应热
D.有催化剂条件下,反应的活化能等于E1
【答案】I .B D
9.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键
H—H
C—O
H—O
C—H
E/(kJ·mol-1)
436
343
1 076
465
413
由此计算ΔH1=____kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
【答案】-99 +41
10.(甘肃省武威市第十八中学2019届高三上学期期末考试(节选))碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知热化学方程式:
①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)===CO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH3
则反应④2C(s)+H2(g)===C2H2(g)的ΔH=_________。(用含ΔH1、ΔH2、ΔH3的关系式表示)
【答案】2ΔH2+ΔH3-ΔH1/2
【解析】(1)已知热化学方程式:①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH1;②C(s)+O2(g)=CO2(g) ΔH2;③H2(g)+1/2O2(g)=H2O(l) ΔH3;则根据盖斯定律可知②×2+③-①×1/2即可得到反应④2C(s)+H2(g)=C2H2(g)的ΔH=2ΔH2+ΔH3-1/2ΔH1,故答案为:2ΔH2+ΔH3-1/2ΔH1。
相关文档
- 2021届高考化学一轮复习化学平衡的2021-07-086页
- 2019届高考化学一轮复习化学反应与2021-07-088页
- 2020版高考一轮复习化学通用版学案2021-07-086页
- 2020版高考一轮复习化学通用版学案2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-088页
- 2020版高考化学一轮复习化学能与热2021-07-0813页
- 2020届高考化学一轮复习化学反应速2021-07-0728页
- 2020届高考化学一轮复习化学平衡状2021-07-078页
- 2021届高考化学一轮复习化学反应速2021-07-0738页
- 2020届高考化学一轮复习化学平衡常2021-07-077页