- 1.10 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第五章 物质结构 元素周期律
考纲解读
1.了解元素、核素和同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
4.掌握元素周期律的实质。了解元素周期表的结构(周期、族)及其应用。
5.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
6.以第ⅠA和第ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
7.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
8.了解化学键的定义。了解离子键、共价键的形成。
第19讲 原子结构 化学键
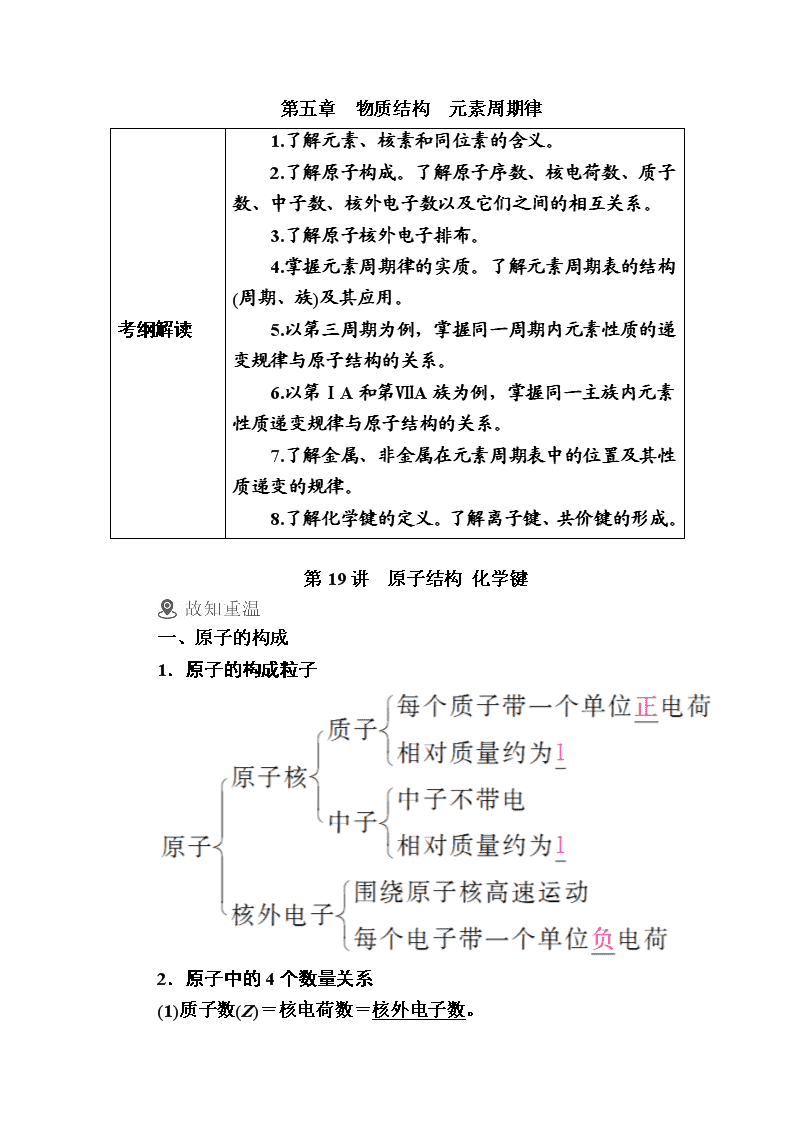
一、原子的构成
1.原子的构成粒子
2.原子中的4个数量关系
(1)质子数(Z)=核电荷数=核外电子数。
(2)质量数(A)=质子数+中子数。
(3)阳离子的核外电子数=质子数-所带电荷数。如Mg2+的核外电子数是10。
(4)阴离子的核外电子数=质子数+所带电荷数。如S2-的核外电子数是18。
3.一个信息丰富的符号
4.“三素”——元素、核素、同位素
(1)元素、核素、同位素的概念及相互关系
(2)同位素的特征与应用
①同位素的特征
a.化学性质相同,物理性质不同。
b.天然存在的同一元素各核素所占的原子百分数一般固定。
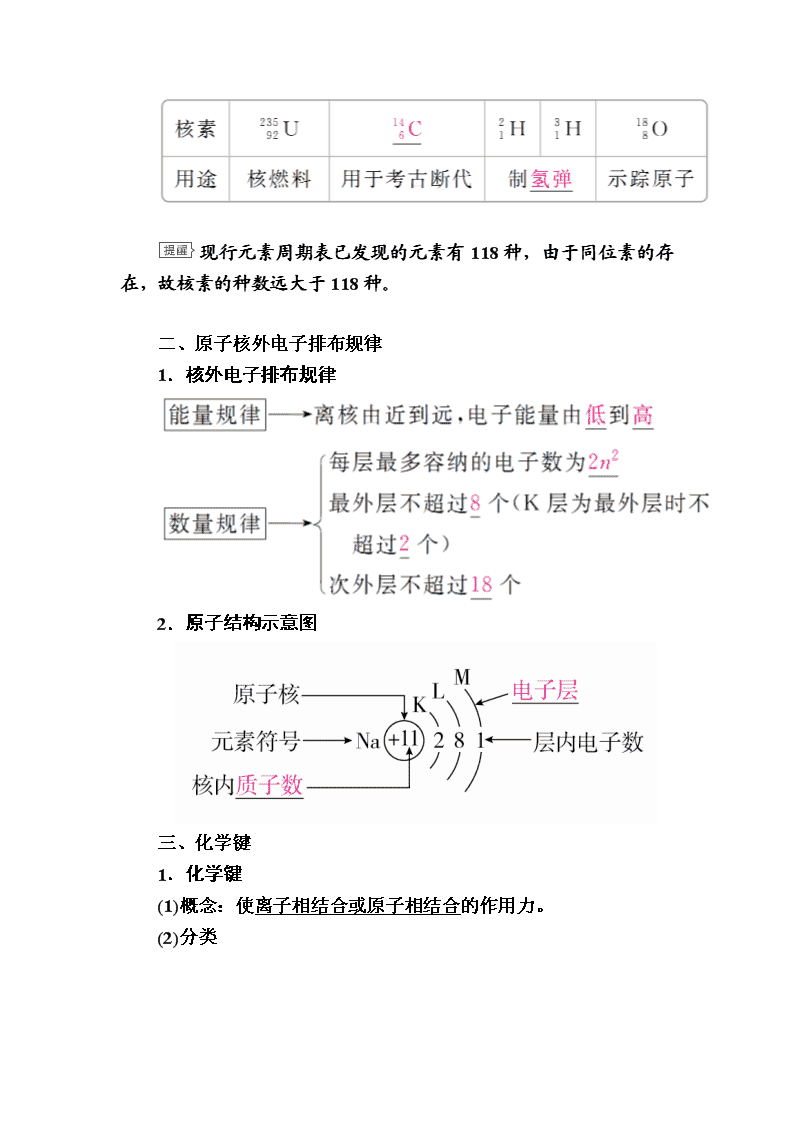
②常见的重要核素及其应用
现行元素周期表已发现的元素有118种,由于同位素的存在,故核素的种数远大于118种。
二、原子核外电子排布规律
1.核外电子排布规律
2.原子结构示意图
三、化学键
1.化学键
(1)概念:使离子相结合或原子相结合的作用力。
(2)分类
2.离子键与共价键的比较
3.离子化合物与共价化合物
4.电子式
(1)微粒的电子式书写
(2)用电子式表示化合物的形成过程
①离子化合物:左边是原子的电子式,右边是离子化合物的电子式,中间用“―→”连接,相同的原子或离子不合并。
如NaCl:Na―→Na+[]-。
②共价化合物:左边是原子的电子式,右边是共价化合物的电子式,中间用“―→”连接。
如HCl:H+―→H。
四、范德华力、氢键
1.分子间作用力
(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点
分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
(3)变化规律
一般来说,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如,熔、沸点:I2>Br2>Cl2>F2。
2.氢键
(1)定义:分子间存在的一种比分子间作用力稍强的相互作用。
(2)形成条件
除H外,形成氢键的原子通常有N、O、F原子。
(3)存在
氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点升高。
1.正误判断,正确的画“√”,错误的画“×”。
(1)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同。( )
(2)核聚变如H+H―→He+n,因为有新微粒生成,所以该变化是化学变化。( )
(3)核外电子排布相同的微粒,其质子数一定相同。( )
(4)所有物质中都存在化学键。( )
(5)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏。( )
(6)CaCl2的电子式: ·[Ca2+] ·( )
(7)次氯酸(HClO)的电子式:H ( )
答案 (1)√ (2)× (3)× (4)× (5)× (6)×
(7)×
2.教材改编题
(据人教必修二P11 T4)放射性同位素铀U的原子核内的中子数与核外电子数之差为( )
A.143 B.92 C.51 D.32
答案 C
考点1 原子结构
典例1 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是( )
A.(A-N+m) mol B.(A-N) mol
C.(A-N) mol D.(A-N+m) mol
解析 X原子的质子数为A-N,一个HmX中所含的质子数为A-N+m,HmX的摩尔质量为(A+m) g·mol-1,所以a g HmX中所含质子的物质的量为(A-N+m) mol。
答案 A
名师精讲
1.正确理解微粒的组成和结构
(1)有质子的原子不一定有中子,有质子的微粒不一定有电子。如H只有一个质子和一个电子,不含中子;H+只有一个质子,既没有中子也没有电子。
(2)质子数相同的粒子不一定属于同种元素,如Ne和H2O。
(3)任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中。
(4)核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH与OH-等。
2.求一定质量的某物质中微粒数的答题模板
物质的质量物质的量指定粒子的物质的量粒子数。
3.元素、核素、同位素之间的关系
4.同位素的“六同三不同”
1.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R原子完全转化为R2-时,含有电子的物质的量是( )
A. mol B. mol
C. mol D. mol
答案 D
解析 R原子的质子数为m-n,其核外电子数也为m-n,所以
R2-的核外电子数为m-n+2,而w g R原子的物质的量为 mol,所以形成的R2-含有的电子为 mol,故选D。
2.下列关于Pu的说法正确的是( )
A.Pu与U互为同位素
B.Pu与Pu互为同素异形体
C.Pu与U具有完全相同的化学性质
D.Pu与Pu具有相同的最外层电子数
答案 D
解析 质子数相同,中子数不同的同一种元素的不同核素互为同位素,Pu与U的质子数不同,不互为同位素,A错误;由同一种元素形成的不同单质互为同素异形体,Pu与Pu均是核素,不是单质,不互为同素异形体,B错误;Pu与U的质子数不同,属于不同的元素,不可能具有完全相同的化学性质,C错误;Pu与Pu的质子数相同,互为同位素,具有相同的最外层电子数,D正确。
考点2 核外电子排布
典例2 (2017·连云港模拟)短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为a-b,L层电子数为a+b,则X、Y两元素形成的化合物可能具有的性质是( )
A.和水反应 B.和硫酸反应
C.和氢氧化钠反应 D.和氯气反应
解析 根据Y原子的L层电子数为a+b,M层电子数为a-b知a+b=8,再根据X原子次外层电子数为b,可知b=2,则a=6,进而确定X为氧(O),Y为硅(Si)。两元素形成SiO2,SiO2为酸性氧化物,可与NaOH反应。
答案 C
名师精讲
1.“等电子”粒子
(1)寻找“10电子”粒子和“18电子”粒子的方法
①“10电子”粒子
②“18电子”粒子
(2)质子数和核外电子数分别相等的两种微粒关系
①可以是两种原子,如同位素原子。
②可以是两种分子,如CH4、NH3等。
③可以是两种带电荷数相同的阳离子,如NH、
H3O+。
④可以是两种带电荷数相同的阴离子,如OH-、F-。
2.核外电子排布规律应用
(1)应用核外电子排布规律的注意事项
核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条。例如:当M层不是最外层时,最多排布的电子数为2×32=18个;而当它是最外层时,则最多只能排布8个电子。
(2)利用稀有气体的原子结构推断元素的周期序数
稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期主族的金属元素形成的阳离子的电子层结构相同。
3.短周期主族元素A、B、C、D、E的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍;B原子的质子数是同主族D原子质子数的;C元素的单质是常见的金属,可作海洋电池的负极材料。下列说法正确的是( )
A.元素A、B形成的常见化合物中既含极性键又含非极性键
B.元素A、B、D、E的简单气态氢化物中,E的简单气态氢化物沸点最高
C.元素C、E的最高价氧化物对应的水化物之间不能反应
D.元素C、D分别形成的简单离子,后者的离子半径较前者的大
答案 D
解析 根据已知信息可推知:A为C(碳),B为O,C为Al,D为S,E为Cl。元素A、B形成的常见化合物为CO、CO2,CO和CO2中均不含非极性键,A项错误;B元素形成的简单气态氢化物是H2O,H2O常温下呈液态,而CH4、H2S、HCl常温下呈气态,故H2O的沸点最高,B项错误;元素C、E的最高价氧化物对应的水化物分别为Al(OH)3、HClO4,两者之间能发生反应,C项错误;元素C、D形成的简单离子分别为Al3+(10个电子)、S2-(18个电子),S2-的离子半径大,D项正确。
4.A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-===D+E↑;②B++C-===2D。
请回答:
(1)C-的电子式是____________________。
(2)分别写出A+和D反应、B+和E反应的离子方程式:
____________________、____________________。
(3)除D、E外,请再写出两种含10个电子的分子的分子式________________。
答案 (1)[H]-
(2)NH+H2O??NH3·H2O+H+
H3O++NH3===NH+H2O
(3)CH4、Ne
解析 因A+、C-、D、E均为10电子微粒,且A++C-===D+E↑,则A+为NH,C-为OH-,E为NH3,D为H2O,进而推知B+为H3O+。
考点3 化学键
典例3 (2017·湖北武汉检测)下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.共价化合物中的化学键全部是极性键
D.含有共价键的化合物一定是共价化合物
解析 离子化合物中一定含有离子键,A正确;双原子气体单质分子中均存在化学键,B错误;H2O2中含有“O—O”非极性键,C错误;NaOH等离子化合物中含有共价键,D错误。
答案 A
名师精讲
1.化学键类型的判断方法
(1)从物质构成角度判断
(2)从物质类别角度判断
2.化合物类型的判断
(1)化学键与物质类别的关系
(2)化合物类型的判断
3.误区警示
(1)存在离子键的化合物一定是离子化合物。
(2)离子化合物中一定存在离子键,可能存在共价键,如NaOH、Na2O2、(NH4)2SO4等。
(3)共价化合物中只有共价键,一定没有离子键。
(4)含有共价键的化合物不一定是共价化合物,如NH4Cl、NaOH、Na2O2等。
(5)全部由非金属元素组成的化合物也可能是离子化合物,如NH4Cl、NH4NO3等铵盐,铵根离子和酸根离子之间以离子键结合。由金属元素和非金属元素形成的化合物也可能是共价化合物,如AlCl3。
5.现有下列物质:①NaCl ②Na2O ③Na2O2 ④NaOH
⑤AlCl3 ⑥H2O ⑦N2 ⑧NH4Cl ⑨CO2 ⑩H2O2
(1)属于离子化合物的是________(填序号,下同),其中含非极性键的离子化合物是________。
(2)属于共价化合物的是________,含非极性键的共价化合物是________。
答案 (1)①②③④⑧ ③ (2)⑤⑥⑨⑩ ⑩
6.X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为________、________、________。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有________、________。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是________。
答案 (1)H O Na (2)NaOH Na2O2 (3)H2O2
考点4 物质变化过程中的作用力
典例4 (2017·甘肃兰州模拟)在下列变化过程中,既有离子键被破坏又有共价键被破坏的是 ( )
A.将SO2通入水中 B.烧碱溶于水
C.将HCl通入水中 D.硫酸氢钠溶于水
解析 SO2、HCl不含有离子键,所以不会有离子键的破坏过程,A、C错误;烧碱在水溶液中电离产生了钠离子和氢氧根离子,没有共价键的破坏过程,B错误;硫酸氢钠既含有离子键又含有共价键,溶于水时钠离子与硫酸氢根离子之间的离子键被破坏,同时硫酸氢根离子中的共价键也被破坏。
答案 D
名师精讲
1.物质熔化、溶解时化学键的变化
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③某些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
④单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
2.氢键对物质物理性质的影响:分子间氢键使物质的熔、沸点升高,如HF、H2O、NH3的沸点都反常的高。又如乙醇的沸点也比乙烷的沸点高出很多。此外,如NH3、C2H5OH、CH3COOH,由于它们能与水形成氢键,使得它们在水中的溶解度很大。
7.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的相互作用依次是( )
A.氢键;分子间作用力;非极性键
B.氢键;极性键;分子间作用力
C.氢键;氢键;极性键
D.分子间作用力;氢键;非极性键
答案 C
解析 雪花→水→水蒸气是状态的改变,破坏的是氢键。由水蒸气→氧气和氢气,发生了化学变化,破坏极性共价键。
考点5 电子式
典例5 氯水中存在多种微粒,下列有关粒子的表示方法正确的是( )
A.氯气的电子式:ClCl
B.氢氧根离子的电子式:H
C.次氯酸分子的结构式:H—O—Cl
D.HClO的电子式:HO
解析 氯气的电子式为,故A错误;氢氧根离子的电子式为[H]-,故B错误;HClO的电子式为H,故D错误。
答案 C
名师精讲
电子式书写易错总结
(1)漏写孤电子对
①如N2的电子式应为N⋮⋮N,易误写成N⋮⋮N。
②如NH3的电子式应为,易误写成。
(2)混淆电子式与化学式的书写
如Na2S的电子式应为Na+[]2-Na+,易误写成Na[]2-。
(3)共用电子对数目写错
如CO2的电子式应为C,易误写成C。
(4)根、基电子式混淆不清
如OH-的电子式应为[H]-,易误写成H。
(5)原子结合顺序写错
如HClO的电子式应为H,易误写成H。
(6)错误使用括号
如HCl的电子式应为H,易误写成H+[]-。
(7)误将电荷数标成化合价
如Na2O的电子式应为Na+[]2-Na+,易误写成Na+[]-2Na+。
(8)复杂阳离子与简单阳离子混淆不清
①如Na+的电子式应为Na+,易误写成[]+。
②如NH的电子式应为,易误写成NH。
(9)“―→”与“===”表示意义不清
如用电子式表示MgCl2的形成过程应为
易误写成
8.下列有关电子式书写正确的是( )
A.N2的电子式:N⋮⋮N
B.NH4Cl的电子式:
C.Na2O2的电子式:Na+[ ]2-Na+
D.次氯酸的电子式:HO
答案 C
解析 N2的电子式应该是N⋮⋮N,A错误;Cl-的电子式表达错误,B错误;Na2O2为离子化合物,C正确;次氯酸的电子式为
H,D错误。
(建议用时:40分钟)
一、选择题(每题6分,共72分)
1.我国限制稀有金属对外出口,此举对我国战略安全具有重要意义,稀土元素钕(Nd)是制造导弹合金材料的重要元素。下列
说法中正确的是( )
A.Nd和Nd是同一核素
B.一个Nd原子的质量约为 g(NA表示阿伏加德罗常数的值)
C.Nd原子的中子数与质子数之差为80
D.14 g钕元素含有6 mol电子
答案 B
解析 Nd和Nd是不同核素,A项错误;1 mol Nd
原子的质量约为140 g,一个原子的质量约为 g,B项正确;Nd原子的中子数为80、质子数为60,二者之差为20,C项错误;元素的相对原子质量是该元素的各种天然同位素的相对原子质量和所占的原子个数百分比算出的平均值,因此14 g钕元素对应的钕原子的物质的量并非0.1 mol,含有的电子也不是6 mol,D项错误。
2.下列各组物质中都既含有离子键又含有共价键的是( )
A.NaOH、H2O、NH4Cl B.KOH、Na2O2、(NH4)2S
C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2
答案 B
解析 既含有离子键又含有共价键的化合物肯定是离子化合物。H2O、HCl只含有共价键,排除A、D;MgO、CaBr2只含有离子键,排除C。故答案为B。
3.下列化学符号表示同一种元素的是( )
①X ②X ③ ④
A.①③ B.②③
C.①②③ D.①②③④
答案 C
解析 元素的种类是由质子数决定的,①②③中三种微粒的质子数都是17,所以是同种元素。
4.下列说法正确的是( )
A.所含质子数和电子数相等的粒子一定是原子
B.两种粒子如果核外电子排布相同,化学性质就一定相同
C.质量数相同的原子其化学性质一定相同
D.具有相同核电荷数的原子或简单的离子,一定是同种元素
答案 D
解析 化学中的粒子可以是分子、原子、离子,也可以是质子、中子、电子等,HF和H2O所含的质子数、电子数均相等,但它们是分子而不是原子。Na+、Mg2+
核外电子排布相同,但它们的化学性质却有很大差异。元素的化学性质取决于原子核外的最外层电子数,与质量数无关。A、B、C都错误。核电荷数即质子数决定元素的种类,所以正确的说法为D。
5.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互称为同位素
C.H2O与D2O互称同素异形体
D.1HO与DO的相对分子质量相同
答案 C
解析 H2O与D2O均表示水分子,同素异形体必须是同种元素形成的不同的单质。
6.具有广泛用途的Co放射源首次实现了国内批量生产。另
外,钴还有多种原子,如Co、Co、Co和Co。下列关于钴原子的说法正确的是( )
A.Co、Co、Co、Co和Co是摩尔质量不同的五种同素异形体
B.Co放射源可以用来治疗癌症,其中子数与电子数之差等于6
C.Co、Co、Co、Co和Co互为同位素,物理性质几乎相同,化学性质不同
D.Co、Co、Co、Co和Co互为同分异构体
答案 B
解析 Co、Co、Co、Co和Co互为同位素,物理性质不同,化学性质几乎完全相同,A、C、D错误;Co的中子数为60-27=33,与电子数之差为33-27=6,B正确。
7.在第n电子层中,当它作为原子的最外层时,容纳电子数最多与n-1层相同。当它作为原子的次外层时,其电子数比n-1层多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
答案 C
解析 原子最外层(第n电子层)最多容纳电子数是8个,即第n-1层容纳8个电子,那么第n-1层为L层,第n电子层为M层;再对照M层作为次外层时可容纳18个电子,比L层多10个电子,符合题意。
8.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
答案 B
解析 由题意推知,a为H,b为S,c为Cl,d为K。A项S、Cl处于第三周期,Cl的原子序数大于S,则Cl的非金属性强于S;由H2S中S元素显-2价、H元素显+1价可知,S的非金属性强于H,因此三种元素的非金属性次序为Cl>S>H。B项H和S、Cl可形成共价化合物H2S和HCl,而H与K则形成离子化合物KH。C项K和H、S、Cl均可形成离子化合物,分别为KH、K2S和KCl。D项H、S、Cl的最高化合价分别为+1、+6和+7,最低化合价分别为-1、-2和-1,因此三种元素各自最高和最低化合价的代数和分别为0、4、6。
9.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d分别与氢形成的化合物中化学键均为极性共价键
答案 D
解析 由题意推知,a为Na,b为C,c为S,d为Cl。四种元素中Cl的非金属性最强,A项正确;四种元素形成的氧化物有:Na2O、Na2O2,CO、CO2,SO2、SO3,ClO2、Cl2O7等,B项正确;只有钠为金属元素,钠与非金属元素C、S、Cl可以形成离子化合物,C项正确;C与H可形成C2H6,C与C之间为非极性共价键,D项错误。
10.下图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是( )
A.H2S B.HCl C.PH3 D.SiH4
答案 D
解析 在第ⅣA~ⅦA族元素的氢化物中,NH3、H2O、HF因存在氢键,沸点反常地高,则含a的线为第ⅣA族元素的氢化物,则a点为SiH4。
11.已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是( )
A.M元素存在同素异形体
B.M元素为非金属元素
C.M的最高价氧化物对应的水化物都是强酸
D.常温下,能稳定存在的M的氧化物都是酸性氧化物
答案 C
解析 第三周期元素原子次外层与最内层电子数之差为6,原子最外层达到饱和时所需的电子数小于6的元素有Al、Si、P、S、Cl,其中达到饱和需要的电子数分别为5、4、3、2、1,这些元素原子最内层均为2个电子,因此符合条件的元素为Si和S。硫存在斜方硫、单斜硫等同素异形体,A项正确;Si和S均为非金属元素,B项正确;Si的最高价氧化物对应的水化物是硅酸,为弱酸,C项错误;SiO2、SO2、SO3均为酸性氧化物,D项正确。
12.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
答案 B
解析 Y2-与Z+核外电子层的结构相同,可知Y在Z的上一周期,所以Y为O、Z为Na,则X为H。A项Na2O只有离子键;B项H2O2既有非极性共价键,也有极性共价键;C项Na2O2有离子键、非极性共价键,没有极性共价键;D项NaOH有离子键、极性共价键。
二、非选择题(共28分)
13.(12分)城市为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液做保湿剂。X原子的结构示意图为,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该保湿剂的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:X2+[]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为
答案 (1)20 CaCl2 (2)硫 碳 (3)B (4)BD
解析 根据题意,可以推断X为Ca、Y为Cl、Z为S、W为C。
14.(16分)现有部分短周期主族元素的性质或原子结构如下表所示:
(1)写出X、Y、Z、N四种元素的名称:X________,Y________,Z________,N________。
(2)由X、Y、Z、M、N五种元素两两组成的分子中,许多分子含有的电子数相等,写出符合下列要求的分子式:
①含10e-且呈正四面体结构的分子________;
②含14e-的双原子分子________;
③含16e-且能使溴水褪色的分子________;
④含18e-且常温下呈液态的分子________。
答案 (1)氢 氧 硅 硫
(2)①CH4 ②CO ③C2H4 ④H2O2
解析 (1)根据周期序数=主族序数=原子序数,推知X为氢元素;根据电子数L层=a+b,M层=a-b,最外层为a,次外层为b,得出b=2,a=6,从而推得Y、Z分别为氧元素、硅元素;金刚石在自然界中的硬度最大,故M为碳元素,N的最外层电子数是电子层数的2倍,则推得N为硫元素。
(2)①CH4为正四面体分子。②CO为双原子14e-分子。③乙烯能和溴水发生加成反应,使溴水褪色。④H2O2在常温下为18e-的液态物质。
相关文档
- 2021届高考化学一轮复习化学平衡的2021-07-086页
- 2019届高考化学一轮复习化学反应与2021-07-088页
- 2020版高考一轮复习化学通用版学案2021-07-086页
- 2020版高考一轮复习化学通用版学案2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-088页
- 2020版高考化学一轮复习化学能与热2021-07-0813页
- 2020届高考化学一轮复习化学反应速2021-07-0728页
- 2020届高考化学一轮复习化学平衡状2021-07-078页
- 2021届高考化学一轮复习化学反应速2021-07-0738页
- 2020届高考化学一轮复习化学平衡常2021-07-077页