- 485.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
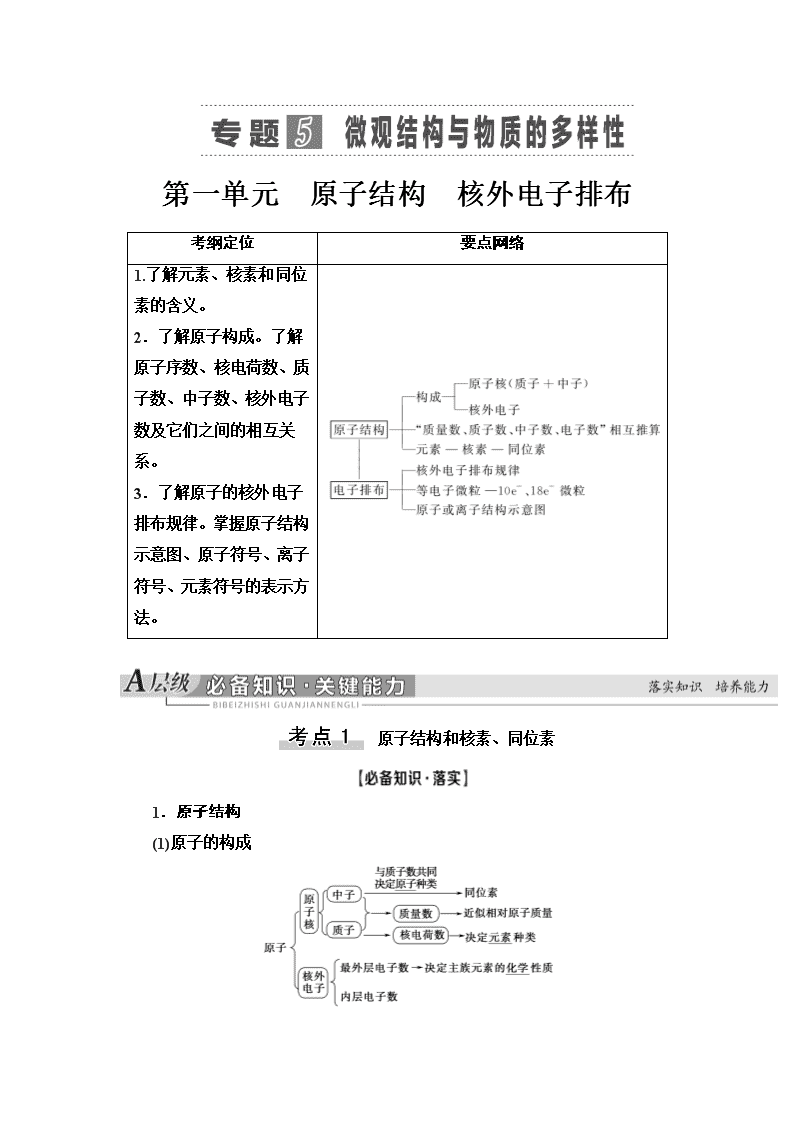
第一单元 原子结构 核外电子排布
考纲定位
要点网络
1.了解元素、核素和同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数及它们之间的相互关系。
3.了解原子的核外电子排布规律。掌握原子结构示意图、原子符号、离子符号、元素符号的表示方法。
原子结构和核素、同位素
1.原子结构
(1)原子的构成
(2)核素(原子)符号表示
AZX表示质子数为Z、质量数为A、中子数为A-Z的核素,如氘H。
(3)微粒中的“各数”间的关系
①质量关系:质量数(A)=质子数(Z)+中子数(N)。
②电性关系
[补短板]
原子结构中的“不一定”
(1)原子中不一定都含有中子,如H中没有中子;(2)电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子;(3)易失去1个电子形成+1价阳离子的不一定是金属原子,如氢原子失去1个电子形成H+;(4)形成稳定结构的离子最外层不一定是8个电子,如Li+为2电子稳定结构;(5)阳离子不一定均有电子,如H+。
2.元素、核素、同位素
(1)“三素”关系及含义
(2)几种重要的核素及其应用
核素
U
C
H
H
O
用途
核燃料
用于考古断代
制氢弹
示踪原子
(3)氢元素的三种核素
H:用字母H表示,名称为氕,不含中子。
H:用字母D表示,名称为氘或重氢,含1个中子。
H:用字母T表示,名称为氚或超重氢,含2个中子。
[补短板]
(1)现行元素周期表已发现的元素有118种,由于同位素的存在,故核素(或原子)的种数远大于118种。(2)不同核素可能具有相同的质子数,如H、H;也可能具有相同的中子数,如C、O;也可能具有相同的质量数,如C、
N。(3)一种元素可以有多种核素,也可能只有一种核素。(4)同位素之间的转化,既不是物理变化也不是化学变化,是核反应。(5)同位素是指同一元素的不同“原子”间的关系,同素异形体是指同一元素的不同“单质”间的关系。
[基础判断]
正误判断(正确的打“√”,错误的打“×”)
(1)H2与H2互为同位素。 ( )
(2)H2、D2、HD均为单质。 ( )
(3)质子数为35、中子数为45的该原子符号为Br。 ( )
(4)D2O与H2O中含有的质子数与中子数均不同。 ( )
[答案] (1)× (2)√ (3)√ (4)×
[知识应用]
(1)H的质子数为________,中子数为________,质量数为________;Fe2+的中子数为________,质子数为________,核外电子数为________;Cl-的中子数为________,质子数为________,核外电子数为________。
(2)2.0 g D2O中核外电子数为________,质子数为________,中子数为________。
[答案] (1)1 2 3 30 26 24 20 17 18
(2)6.02×1023 6.02×1023 6.02×1023
◎命题点1 原子结构的粒子构成及数目计算
1.国际纯粹与应用化学联合会(IUPAC)公布了118号元素符号为Og。下列关于Og的说法错误的是( )
A.原子序数为118
B.中子数为179
C.核外电子数为118
D.质子数与中子数之差为179
D [质子数为118,质量数为297,中子数为297-118=179,质子数与中子数之差为179-118=61,D错误。]
2.铁60同位素的现身,揭秘了超新星爆炸历史的真相。下列说法中正确的是( )
A.铁元素的质量数为60
B.Fe的核内质子数比中子数多8
C.Fe与Fe的核外电子数相同,属于同一种核素
D.30 g铁60中含有的中子约为17 mol
D [Fe这种铁原子的质量数为60,而不是铁元素的质量数,A错;Fe的核内质子数(26)比中子数(34)少8,B错;Fe与Fe的质子数相同但中子数不同,是两种不同的核素,C错;30 g 60Fe中含有的中子约为×34 mol=17 mol,D正确。]
3.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子构成HmX分子,在a g Hm X中所含原子的物质的量为________,所含中子的物质的量为________,所含质子数为________,所含电子数为________。
[答案] (m+1) mol N mol (m+A-N)NA (m+A-N)NA
求一定质量的某物质中微粒数的思维模板
物质的质量物质的量指定微粒的物质的量微粒数
◎命题点2 元素、核素、同位素的判断
4.(2018·锦州期末)地表水和地下水都来源于大气降水,但重水和轻水中同位素含量是不同的,有时差别还相当大,氢包括两种稳定核素:H和D,氧常见的核素16O、17O和18O,下列有关说法正确的是( )
A.H2和D2互为同分异构体,其化学性质完全相同
B.HO、HO、HO互为同位素,都能与金属钠发生反应
C.18O2和18O3互为同素异形体,其密度之比为2∶3
D.电解一定量的DO时,阴、阳两极所得气体的质量之比约为2∶9
D [同分异构体一般指分子式相同,结构不同的有机物,H2和D2
为组成和结构都相同的无机物,A错误;16O、17O、18O互为同位素,HO、HO、HO既不互为同位素,也不是同素异形体,B错误;18O2和18O3互为同素异形体,但只有在同温同压下,它们的密度之比才为2∶3,C错误;电解一定量的DO时,阴、阳两极会收集到物质的量之比为2∶1的D2和18O2,其质量之比约为2∶9,D正确。]
5.同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域。下列有关叙述正确的是( )
A.14C与12C是两种不同的元素或核素
B.通过化学变化可以实现16O与18O之间的相互转化
C.35Cl2与37Cl2互为同素异形体
D.铯元素的两种同位素中137Cs比133Cs多4个中子
D [A项,14C与12C是同种元素的不同核素,错误;B项,16O与18O之间的相互转化实际上是改变原子核的结构,不属于化学变化的范围,错误;C项,35Cl2与37Cl2都是Cl2的单质,不是同素异形体,错误;D项,铯元素的两种同位素中137Cs比133Cs多4个中子,正确。]
6.重水(D2O)是重要的核工业原料。下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同分异构体
D.1HO与DO的相对分子质量相同
[答案] C
核外电子排布与等电子粒子
1.核外电子排布规律
提醒:核外电子排布的几条规律之间既相互独立,又相互统一,不能独立地应用其中一条,如M层最多排18个电子,但钾原子的M层排8个电子。
2.原子或离子结构示意图
3.等电子粒子
(1)2电子粒子:He、H-、Li+、Be2+、H2。
(2)10电子粒子:
(3)18电子粒子:
[知识应用]
1.在1~18号元素间选填相应元素符号。
(1)原子序数与电子层数相同的元素为________。
(2)最外层电子数是次外层电子数2倍的元素:______;最外层电子数是次外层电子数3倍的元素:________;最外层电子数是次外层电子数4倍的元素:________。
(3)最外层电子数是电子层数3倍的元素:________。
[答案] (1)H (2)C O Ne (3)O
2.下图为几种粒子结构示意图,完成以下填空。
(1)属于阳离子结构的粒子是________(填编号,下同)。
(2)具有稳定性结构的原子是________________。
(3)只能得电子的粒子是________;只能失电子的粒子是________。
[答案] (1)③⑤ (2)② (3)③⑤ ①④⑥
◎命题点1 核外电子排布规律的应用——元素推断
1.(2019·鞍山模拟)短周期元素X和Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b)。则X、Y两元素形成的化合物可能具有的性质是( )
A.和水反应 B.和硫酸反应
C.和氢氧化钠反应 D.和氯气反应
C [根据Y原子的L层电子数为(a+b),M层电子数为(a-b),知a+b=8,再根据X原子次外层电子数为b,可知b=2,则a=6,进而确定X为氧(O),Y为硅(Si)。两元素形成SiO2,SiO2为酸性氧化物,可与NaOH反应。]
2.A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。
(1)这4种元素的元素符号依次是A________、B________、C________、D________。
(2)C的原子结构示意图为________。
(3)D的离子结构示意图为________。
(4)B的单质与D的最高价氧化物对应的水化物反应的化学方程式为____________________________________________________。
(5)A单质与浓硫酸共热的化学方程式为___________________
____________________________________________________。
[解析] A原子的L层电子数与K、M层电子数之和相等,所以A的核电荷数为2×8=16,A为硫元素。D原子的K、L层电子数之和等于电子总数的一半,所以D原子的核电荷数是(2+8)×2=20,D为钙元素。根据核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8,可以判断出B为氯元素,C为钾元素。
[答案] (1)S Cl K Ca
(2)
(4)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(5)S+2H2SO4(浓)3SO2↑+2H2O
◎命题点2 等电子粒子及转化
3.已知A、B、C、D是中学化学中常见的四种不同多核粒子,它们之间存在如下关系:
(1)如果A、B、C、D均是10电子的粒子,请写出:
A与B反应的离子方程式为________________________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,举例写出:
①A与B在溶液中反应的离子方程式为__________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_______________ ____________。
(3)已知肼(H2N—NH2)和甲胺(H3C—NH2)都是18电子的分子。分析肼和甲胺的结构特点并从中得到启发,写出与其具有相同电子数的有机化合物的结构简式:_______________(至少写两个)。
[解析] (1)若A、B、C、D均为10e-粒子,根据图可知A为NH,B为OH-,C为NH3,D为H2O。
(2)若A、C为18e-粒子,B、D为10e-粒子,由图示可知A可以为H2S,B为OH-,则C为HS-,D为H2O。
(3)根据H2N—NH2、H3C—NH2均为18e-的分子,可得—NH2、—CH3均为9e-基团,其他为9e-基团的还有—OH、—F。故构成18e-的有机分子为CH3—OH、CH3—F、CH3—CH3。
[答案] (1)NH+OH-NH3↑+H2O
(2)①H2S+OH-===HS-+H2O
②OH->HS-(答案合理即可)
(3)CH3—CH3、CH3—F、CH3—OH(任写两个)
1.下列说法正确的是________(填序号)。
①(2019·全国卷Ⅱ)3 g 3He含有的中子数为1NA
②(2018·全国卷Ⅰ)22.4 L(标准状况)氩气含有的质子数为18NA
③(2018·全国卷Ⅲ)24 g镁与27 g铝中,含有相同的质子数
④(2018·全国卷Ⅲ)1 mol重水与1 mol水中,中子数比为2∶1
⑤(2018·全国卷Ⅲ)同等质量的氧气和臭氧中,电子数相同
⑥(2017·全国卷Ⅲ)0.1 mol的11B中,含有0.6NA个中子
[解析] ③项,24 g(1 mol)Mg含质子12 mol,27 g(1 mol)Al含质子13 mol;④项,1 mol D2O中含中子10NA,1 mol水中含中子8NA,中子数之比为5∶4。
[答案] ①②⑤⑥
2.(2015·全国卷Ⅰ)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Yb>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
B [由a的最外层电子数为1,a-的电子层结构与氦相同可知,a为H。b和c的次外层有8个电子,则b、c处于第3周期,又知b、c的最外层电子数分别为6、7,从而推知,b、c分别为S、Cl。由c-和d+的电子层结构相同可知,d为K。]
相关文档
- 2020届高考化学一轮复习化学平衡状2021-07-0813页
- 2020届高考化学一轮复习化学计量在2021-07-0811页
- 2021届高考化学一轮复习化学平衡的2021-07-086页
- 2019届高考化学一轮复习化学反应与2021-07-088页
- 2020版高考一轮复习化学通用版学案2021-07-086页
- 2020版高考一轮复习化学通用版学案2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-088页
- 2020版高考化学一轮复习化学能与热2021-07-0813页
- 2020届高考化学一轮复习化学反应速2021-07-0728页
- 2020届高考化学一轮复习化学平衡状2021-07-078页