- 961.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
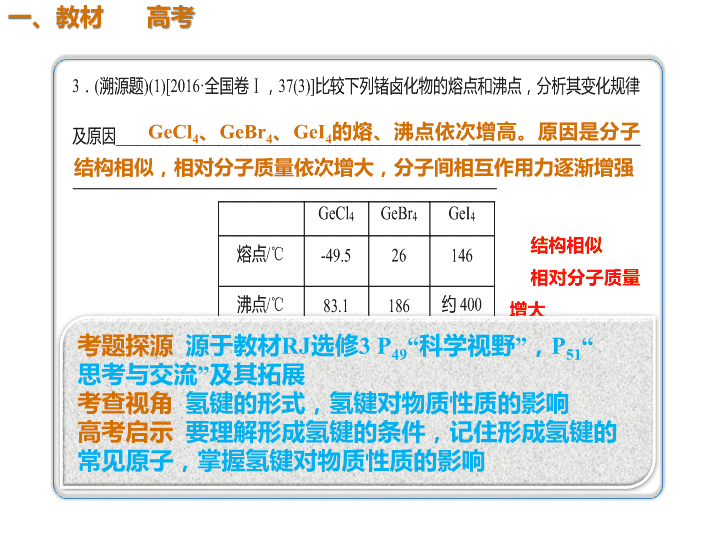
GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子
结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强
高于
NH3分子间可形成氢键 极性
sp3
结构相似
相对分子质量
增大
4.(2018·烟台模拟)请回答下列问题:
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经
系统的作用,该物质的结构简式如图所示:
以下关于维生素B1的说法正确的是________。
a.只含σ键和π键 b.既有共价键又
有离子键
c.该物质的熔点可能高于NaCl d.既含有极性
键又含有非极性键
(2)维生素B1晶体溶于水的过程中要克服的微粒间的作
用力有________。
a.离子键、共价键 b.离子键、氢键、共价
键
c.氢键、范德华力 d.离子键、氢键、范德
华力
bd
d
CO2
氨气分子为极性分子,易溶于极性溶剂水中,氨气分子与水分子
间易形成氢键,氨气可与水反应
氢键、范德华力 非极性键
分子晶
体
解析 (1)由结构简式知,维生素B1中含有Cl-及另一种有机离子,
存在离子键,其他原子之间形成共价键,故a错误、b正确;与
氯化钠晶体相比,维生素B1中的阳离子比Na+半径大,晶格能小,
熔点不可能高于NaCl,故c错误;维生素B1中碳碳键为非极性键,
氮氢键、氧氢键、碳氢键等为极性键,故d正确。
(2)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,维生
素B1分子间存在氢键、范德华力,故d正确。
(3)N2为单质,另外五种化合物中属于非极性分子的是CO2。NH3
极易溶于水,是因为NH3和水均为极性分子,NH3溶于水后,
NH3与水之间可形成氢键,NH3可与水反应。
(4)液氨汽化破坏了分子间作用力,包括氢键和范德华力;氨气
分解生成N2和H2,破坏了氮氢极性键;N2、H2生成氮原子和氢
原子,破坏了非极性键。
无机含氧酸分子的酸性判断及比较的思维方法
(1)无机含氧酸分子之所以能显示酸性,是因
为其分子中含有—OH,而—OH上的H原子在
水分子的作用下能够变成H+而显示一定的酸
性。如HNO3、H2SO4的结构式分别是
(2)同一种元素的含氧酸酸性规律
H2SO4与HNO3是强酸,其—OH上的H原子能
够完全电离成为H + 。而同样是含氧酸的
H2SO3和HNO2却是弱酸。即酸性强弱为H2SO3
<H2SO4,HNO2<HNO3。其他的有变价的非
金属元素所形成的含氧酸也有类似的情况。
如酸性强弱HClO<HClO2<HClO3<HClO4。
不难得出:对于同一种元素的含氧酸来说,
该元素的化合价越高,其含氧酸的酸性越强。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页