- 253.26 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微考点47 热化学方程式的四种常见考查形式
1.(2019·哈尔滨质检)已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=-2bkJ·mol-1
B.C2H2(g)+O2(g)===2CO2(g)+H2O(l)
ΔH=+2bkJ·mol-1
C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=-4bkJ·mol-1
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=+bkJ·mol-1
2.(2019·贵州贵阳质检)已知:①CO的结构式为CO;
②298K时相关化学键的键能数据如下表:
化学键
H—H
O—H
C—H
CO
键能/
kJ·mol-1
436
465
413
1076
则反应CO(g)+3H2(g)CH4(g)+H2O(g)的ΔH的值为( )
A.-198kJ·mol-1 B.+267kJ·mol-1
C.-298kJ·mol-1 D.+634kJ·mol-1
3.根据如图关系(图中计量单位为mol)计算2NO(g)+2H2(g)===N2(g)+2H2O(g)的ΔH为( )
8
A.(a+b-c-d)kJ·mol-1
B.(c+a-d-b)kJ·mol-1
C.(c+d-a-b)kJ·mol-1
D.(c+d-a-b)kJ·mol-1
4.由金红石TiO2制取单质Ti,涉及的步骤为TiO2―→TiCl4Ti。已知:
①C(s)+O2(g)===CO2(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为( )
A.ΔH3+2ΔH1-2ΔH2
B.ΔH3+ΔH1-ΔH2
C.ΔH3+2ΔH1-ΔH2
D.ΔH3+ΔH1-2ΔH2
5.(2019·浙江联考)根据能量变化示意图,下列说法正确的是( )
A.反应物的总能量高于生成物的总能量
B.2molH和1molO结合生成1molH2O(g)放出akJ热量
C.1molC(s)和1molH2O(g)反应生成1molCO(g)和1molH2(g),需要吸收131.3kJ的热量
D.反应的热化学方程式可表示为C(s)+H2O(g)===CO(g)+H2(g) ΔH=+(a-b)kJ·mol-1
8
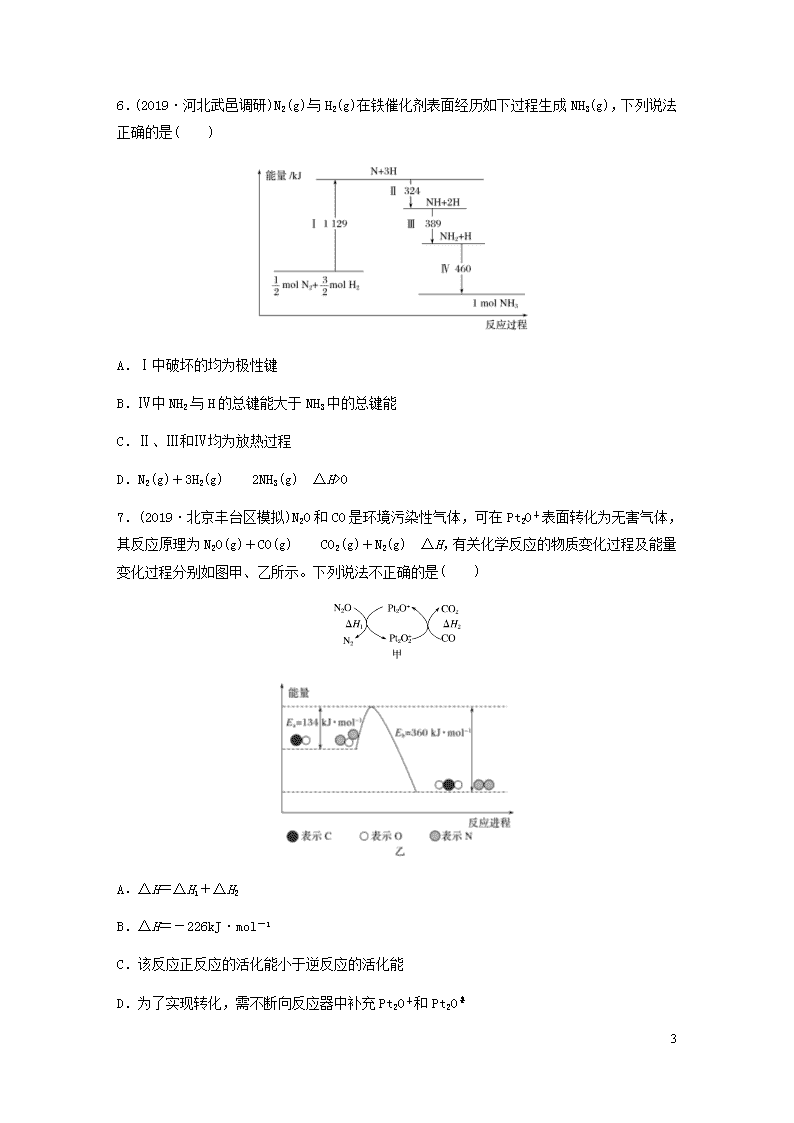
6.(2019·河北武邑调研)N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g),下列说法正确的是( )
A.Ⅰ中破坏的均为极性键
B.Ⅳ中NH2与H的总键能大于NH3中的总键能
C.Ⅱ、Ⅲ和Ⅳ均为放热过程
D.N2(g)+3H2(g)2NH3(g) ΔH>0
7.(2019·北京丰台区模拟)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应原理为N2O(g)+CO(g)CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是( )
A.ΔH=ΔH1+ΔH2
B.ΔH=-226kJ·mol-1
C.该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充Pt2O+和Pt2O
8
8.写出下列反应的热化学方程式。
(1)[2018·北京,27(1)]近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g)
ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:_______________________________________________________。
(2)[2017·天津,7(3)]0.1molCl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)[2014·大纲全国卷,28(1)]化合物AX3和单质X2在一定条件下反应可生成化合物AX5。已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成1molAX5,放出热量123.8kJ。该反应的热化学方程式为__________________
________________________________________________________________________。
(4)下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/kJ·mol-1
a
b
c
x
8
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,则表中x=________________________________________________________________________(用含有a、b、c、d的代数式表示)。
9.(1)目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ.2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH1
反应Ⅱ.NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
反应Ⅲ.(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系:ΔH3=_______________________________________
________________________________________________________________________。
(2)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26kJ·mol-1
②CaO(s)+SiO2(s)===CaSiO3(s)
ΔH2=-89.61kJ·mol-1
③2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________________kJ·mol-1。
(3)分析图像可知,若0.5molCO被氧化,放出QkJ热量,则Q=________________;若该反应是可逆反应,则在相同条件下将0.5molCO与1molNO2混合充分反应后放出的热量________________Q(填“>”“<”或“=”)kJ。
(4)真空碳还原—氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=akJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=bkJ·mol-1
则反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________________kJ·mol-1(用含a、b的代数式表示)。
8
10.(2020·临沂调研)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_____________________________________________
________________________________________________________________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键形成的过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H—H
N—H
N≡N
键能/kJ·mol-1
436
391
945
已知反应:
N2(g)+3H2(g)2NH3(g) ΔH=akJ·mol-1
试根据表中所列键能数据估算a的值为__________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g)
ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:___________
_____________________________________________________________。
8
答案精析
1.C 2.A
3.A [由图中转化可知,断裂化学键吸收能量,形成化学键释放能量,2NO(g)+2H2(g)===N2(g)+2H2O(g) ΔH=(a+b-c-d)kJ·mol-1。]
4.C
5.C [由图可知,反应物[C(s)+H2O(g)]具有的总能量低于生成物[CO(g)+H2(g)]具有的总能量,A错误;1molC(g)、2molH(g)和1molO(g)结合生成1molCO(g)和1molH2(g)放出akJ热量,并未生成H2O(g),B错误;由图可知,生成物具有的总能量比反应物具有的总能量高131.3kJ,故1molC(s)和1molH2O(g)反应生成1molCO(g)和1molH2(g),需要吸收131.3kJ的热量,C正确;根据反应热与正、逆反应活化能的关系“ΔH=Ea(正反应)-Ea(逆反应)”可知,该反应的ΔH=+(b-a) kJ·mol-1,D错误。]
6.C 7.D
8.(1)3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1
(2)2Cl2(g)+TiO2(s)+2C(s)===TiCl4(l)+2CO(g)
ΔH=-85.6kJ·mol-1
(3)AX3(l)+X2(g)===AX5(s) ΔH=-123.8kJ·mol-1
(4)
解析 (1)由题图可知,反应Ⅱ的化学方程式为3SO2+2H2O2H2SO4+S↓。根据盖斯定律,反应Ⅱ=-(反应Ⅰ+反应Ⅲ)可得:3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1。
(2)由所给数据不难计算,该反应的热化学方程式为2Cl2(g)+TiO2(s)+2C(s)===TiCl4(l)+2CO(g)
ΔH=-85.6kJ·mol-1。
(3)根据AX3的熔点和沸点可知室温时AX3为液体,由AX5的熔点可知AX5室温时为固体。由此可写出室温时AX3与气体X2反应生成AX5的热化学方程式:AX3(l)+X2(g)===AX5(s) ΔH=-123.8kJ·mol-1。
8
(4)利用焓变ΔH=E反应物的键能之和-E生成物的键能之和,根据化学方程式P4+5O2===P4O10,得出ΔH=(6molP—P+5molO===O)-(4molP===O+12molP—O)=-d。
9.(1)2ΔH2-ΔH1 (2)+2821.6 (3)117 < (4)(a+b)
解析 (1)根据盖斯定律,利用NH3和(NH4)2CO3作工业捕碳剂与CO2反应的三个反应,将Ⅱ式×2-Ⅰ式即可得到Ⅲ式。(2)根据反应可得①+②×6=③,所以ΔH3=+3 359.26 kJ·mol-1-89.61 kJ·mol-1×6=+2 821.6 kJ·mol-1。(3)由图知,消耗0.5 mol CO时放出的热量为(368 kJ·mol-1-134 kJ·mol-1)×0.5 mol=117 kJ,可逆反应过程中反应物不可能消耗完,因此放出的热量小于Q kJ。(4)根据盖斯定律,将题中所给的两个热化学方程式相加可得所求的热化学方程式,该反应的ΔH=(a+b)kJ·mol-1。
10.(1)2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1452.8kJ·mol-1
(2)-93 (3)+226.7kJ·mol-1
解析 (1)设2 mol CH3OH(l)完全燃烧生成CO2气体和液态水放出的热量为Q。则有=,解得Q=1 452.8 kJ,所以甲醇燃烧的热化学方程式为2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452.8 kJ·mol-1。
(2)反应热ΔH=a=反应物键能总和-生成物键能总和=3×436 kJ·mol-1+945 kJ·mol-1-6×391 kJ·mol-1=-93 kJ·mol-1。(3)ΔH=×(4ΔH1+ΔH2-ΔH3)=×[4×(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)-(-2 599 kJ·mol-1)]=+226.7 kJ·mol-1。
8
相关文档
- 江西省高安中学2019-2020学年高二2021-07-088页
- 【化学】湖北省武汉市2019-2020学2021-07-088页
- 2020届高考化学一轮复习化学反应与2021-07-0821页
- 高考化学一轮复习学案课件(人教版):第2021-07-0830页
- 新疆石河子第二中学2019-2020年高2021-07-086页
- 河北省衡水市桃城区第十四中学20192021-07-0811页
- 2019届二轮复习小题分点提速练(五)2021-07-086页
- 2021版浙江高考选考化学一轮复习教2021-07-0817页
- 【化学】河北省石家庄市行唐县三中2021-07-0820页
- 高一化学物质的量教案2021-07-085页