- 226.93 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
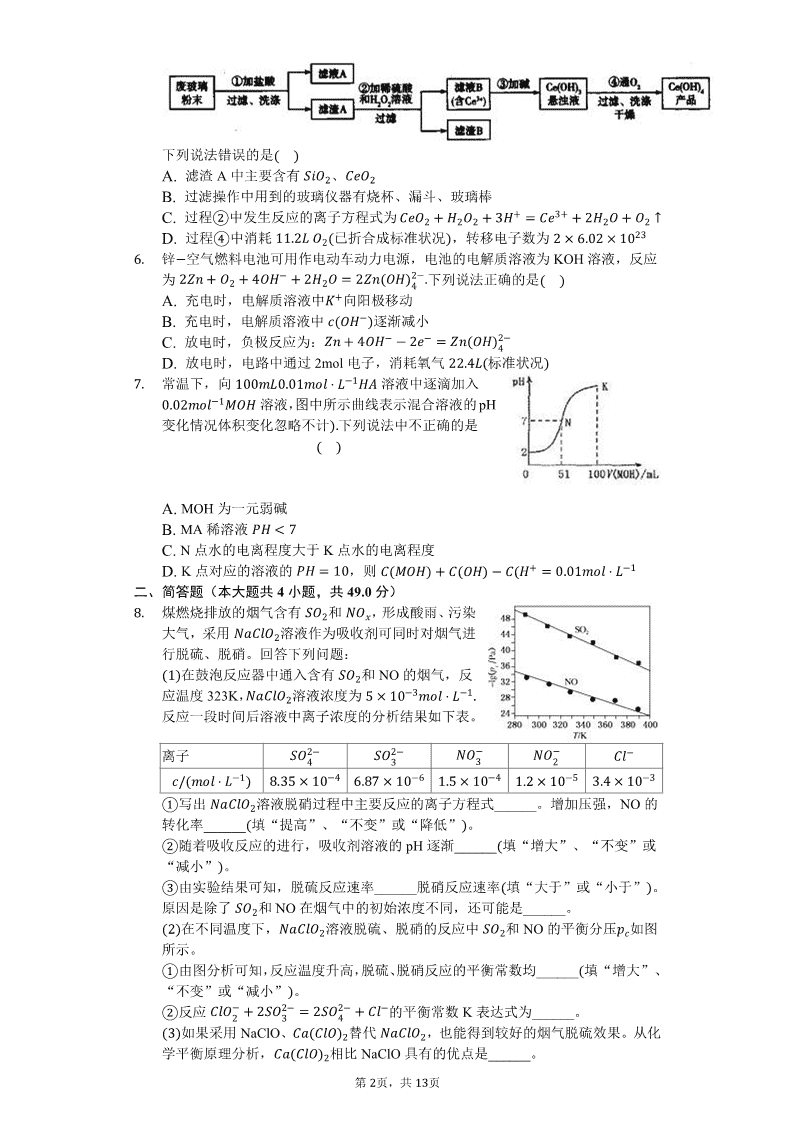
- 网站客服QQ:403074932
:设计实验流程如图
,某课题组以此粉末为原料回收铈,
����2
、
��2�3
、
���2
含
�
生大量的废玻璃粉末
是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产
��������4
氢氧化铈
5.
发生加成反应
3ᦙ䁪��2
可与
���
D. 1mol 化合物
可通过苯与 Cl 发生加成反应制得
��合
�������C. 化合物
分子式为
��合
B. 化合物
不能与乙醇发生反应
���
A. 化合物
������
。下 列说法正确的是
�
图
如
�
微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的
4.
D. 利用 Y 的含氧酸酸性强于 W 的含氧酸酸性,可证明非金属性 W 强于 Y
的结构和化学性质相似
��2
和
��2
C.
B. X、Y、Z 三种元素对应原子的半径依次减小
A. X 位于元素周期表中的第 3 周期第ⅥA 族
X W
������Y Z
原子序数为 Z 元素原子序数的两倍,则下列说法正确的是
W、X、Y、Z 四种短周期元素,在元素周期表中的位置如图所示,其中 W 元素的
3.
2�A. A B. B C. C D. D
��
该待测液中一定含有
出现血红色
某待测液中先滴入氯水无明显现象,后滴入硫氰化钾溶液
D
萄糖
说明尿液中不含有葡
成
悬浊液,没有砖红色沉淀生
�ݑ����2
向尿液中加入新制
C
�2
��
,无
�3
��
该无色溶液中一定有
沉淀又会全部消失
向某无色溶液中滴加 NaOH 溶液,先产生白色沉淀,后
B
���3
说明该食盐不含
焰显黄色
用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火
A
项 实验操作及现象 实验结论
������选
下列有关实验操作与结论都正确的是
2.
D. 漂洗衣服时,可以采用萃取原理中的“少量多次”来节约用水
C. “长征九号”运载火箭的壳体通常采用纤维作增强体,金属作基体的复合材料
的有害气体一般没有得到转化或吸收
B. 严格地讲实验室中的“通风厨”是一种不负责任的防污染手段,因为实验产生
������A. 用氟利昂做制冷剂会加剧雾霾天气的形成
化学与生活密切相关,下列叙述中不正确的是
1.
一、单选题(本大题共 7 小题,共 42.0 分)
学校:___________姓名:___________班级:___________考号:___________
2020 年四川省成都市实验中学高考化学模拟试卷(二)
页
13
页,共
1
第
第
2
页,共
13
页
下列说法错误的是
������A. 滤渣 A 中主要含有
���2
、
���2B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程
�
中发生反应的离子方程式为
���2 � �2�2 � 3�
�
� ��
3�
� 2�2� � �2 �D. 过程
�
中消耗
11.2� �2�
已折合成标准状况
�
,转移电子数为
2 � �.䁨2 � 1䁨
23
�.
锌
�
空气燃料电池可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,反应
为
2�ㄲ � �2 � 4��
�
� 2�2� � 2�ㄲ����4
2�
.
下列说法正确的是
������A. 充电时,电解质溶液中
�
�
向阳极移动
B. 充电时,电解质溶液中
����
�
�
逐渐减小
C. 放电时,负极反应为:
�ㄲ � 4��
�
� 2�
�
� �ㄲ����4
2�D. 放电时,电路中通过 2mol 电子,消耗氧气
22.4��
标准状况
�
7.
常温下,向
1䁨䁨ᦙ�䁨.䁨1ᦙ䁪� � �
�1
��
溶液中逐滴加入
䁨.䁨2ᦙ䁪�
�1
���
溶液,图中所示曲线表示混合溶液的pH
变化情况体积变化忽略不计
�.
下列说法中不正确的是
������
A. MOH 为一元弱碱
B. MA 稀溶液
�� 液 7C. N 点水的电离程度大于 K 点水的电离程度
D. K 点对应的溶液的
�� � 1䁨
,则
������ � ����� � ���
�
� 䁨.䁨1ᦙ䁪� � �
�1二、简答题(本大题共 4 小题,共 49.0 分)
8.
煤燃烧排放的烟气含有
��2
和
���
,形成酸雨、污染
大气,采用
�ᦙ���2
溶液作为吸收剂可同时对烟气进
行脱硫、脱硝。回答下列问题:
�1�
在鼓泡反应器中通入含有
��2
和 NO 的烟气,反
应温度 323K,
�ᦙ���2
溶液浓度为
5 � 1䁨
�3
ᦙ䁪� � �
�1
.
反应一段时间后溶液中离子浓度的分析结果如下表。
离子
��4
2�
��3
2�
��3
�
��2
�
��
�
�Ͳ�ᦙ䁪� � �
�1
� 8.35 � 1䁨
�4
�.87 � 1䁨
��
1.5 � 1䁨
�4
1.2 � 1䁨
�5
3.4 � 1䁨
�3
�
写出
�ᦙ���2
溶液脱硝过程中主要反应的离子方程式______。增加压强,NO 的
转化率______
�
填“提高”、“不变”或“降低”
�
。
�
随着吸收反应的进行,吸收剂溶液的 pH 逐渐______
�
填“增大”、“不变”或
“减小”
�
。
�
由实验结果可知,脱硫反应速率______脱硝反应速率
�
填“大于”或“小于”
�
。
原因是除了
��2
和 NO 在烟气中的初始浓度不同,还可能是______。
�2�
在不同温度下,
�ᦙ���2
溶液脱硫、脱硝的反应中
��2
和 NO 的平衡分压
��
如图
所示。
�
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______
�
填“增大”、
“不变”或“减小”
�
。
�
反应
���2
�
� 2��3
2�
� 2��4
2�
� ��
�
的平衡常数 K 表达式为______。
�3�
如果采用 NaClO、
�ᦙ�����2
替代
�ᦙ���2
,也能得到较好的烟气脱硫效果。从化
学平衡原理分析,
�ᦙ�����2
相比 NaClO 具有的优点是______。
第
3
页,共
13
页
9. 用含锂废渣
�
主要金属元素的含量:
���3.5䁨������.55���ᦙ��.41����13.24��
制备
��2��3
,并用其制备
��
�
电池的正极材料
������4.
部分工艺流程如图:
资料:Ⅰ
.
滤液 1、滤液 2 中部分离子的浓度
�� � �
�1
�
:
��
�
��
2�
�ᦙ
2�
��
2�滤液 1
22.72 2䁨.�8 䁨.3� �䁨.18滤液 2
21.Ǥ4 7.7 � 1䁨
�3
䁨.䁨8 䁨.78 � 1䁨
�3Ⅱ
.ܧ�ܦ�
能和某些二价金属离子形成稳定的水溶性络合物。
Ⅲ
.
某些物质的溶解度
���
:
ܦͲ�
20 40 60 80 100
����2��3�Ͳ� 1.33 1.17 1.䁨1 䁨.85 䁨.72
����2��4�Ͳ� 34.7 33.� 32.7 31.7 3䁨.ǤⅠ
.
制备
��2��3
粗品
���
上述流程中为加快化学反应速率而采取的措施是______。
�2�
滤渣 2 的主要成分有______。
�3�
向滤液 2 中先加入 EDTA,再加入饱和
�ᦙ2��3
溶液,
Ǥ䁨�
充分反应后,分离出
固体
��2��3
粗品的操作是______。
�4�
处理 lkg 含锂
3.5䁨�
的废渣,锂的浸出率为 a,
��
�
转化为
��2��3
的转化率为 b,
则粗品中含
��2��3
的质量是______g。
Ⅱ
.
纯化
��2��3
粗品
�5�
将
��2��3
转化为
�����3
后,用隔膜法电解
�����3
溶液制备高纯度的 LiOH,
再转化得电池级
��2��3.
电解原理如图所示,阳极的电极反应式是,该池使用了
______
�
填“阳”或“阴”
�
离子交换膜。
Ⅲ
.
制备
������4
���
将电池级
��2��3
和 C、
����4
高温下反应,生成
������4
和一种可燃性气体,
该反应的化学方程式是______。
10. 张亭栋研究小组受民间中医启发,发现
��2�3�
俗称砒霜
�
对白血病有明显的治疗作
用。氮
���
、磷
���
、砷
����
等都是 VA 族的元素,该族元素的化合物在研究和生产
中有许多重要用途。回答下列问题:
第
4
页,共
13
页
�1��
、P、As 原子的第一电离能由大到小的顺序为______;As 原子的核外电子排
布式为______。
�2���3
的沸点比
��3
______
�
填“高“或“低”
�
,原因是______。
�3��ᦙ3���4
中含有的化学键类型包括______;
���4
3�
的空间构型为______,
��4��的分子结构如图 1 所示,则在该化合物中 As 的杂化方式是______。
�4�
白磷
��4�
的晶体属于分子晶体,其晶胞结构如图
2�
小圆圈表示白磷分子
�
。已知
晶胞的边长为 acm,阿伏加德罗常数为
��ᦙ䁪�
�1
,则该晶胞中含有的 P 原子的个数
为______,该晶体的密度为______
� � �ᦙ
�3
�
用含
��
、a 的式子表示
�
。
11. Prolitane 是一种抗抑郁药物,以芳香烃 A 为原料的合成路线如下:
请回答以下问题:
�1��
的化学名称为______,
� � �ݎ䁪��݈ᦙㄲ�
的反应类型为______。
�2�ܧ
的官能团名称分别为______和______。
�3�合
的结构简式为______。
�4�� � �
的化学方程式为______。
�5��
的同分异构体中能同时满足下列条件的共有______种
�
不含立体异构
�
;
�
属于芳香化合物
�
能发生银镜反应
�
能发生水解反应
其中核磁共振氢谱显示为 4 组峰,其峰面积比为 3:2:2:1,写出符合要求的该
同分异构体的结构简式______。
���
参照 Prolitane 的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成
路线______
�
其他无机试剂和溶剂任选
�
。
三、实验题(本大题共 1 小题,共 14.0 分)
12. 铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测
定某含镁
3�
~
5�
的铝镁合金
�
不含其他元素
�
中镁的质量分数,设计了下列两种不
同实验方案进行探究.填写下列空白:
�
方案一
�
�
实验方案
�
将铝镁合金与足量 NaOH 溶液反应,测定剩余固体质量.
实验中发生反应的化学方程式是 ______ .
�
实验步骤
�
�1�
称取
1䁨.8�
铝镁合金粉末样品,溶于体积为 V、物质的量浓度为
4.䁨ᦙ䁪� �
�
�1
�ᦙ��
溶液中,充分反应.则 NaOH 溶液的体积
� �
______ mL.
�2�
过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
______
�
填“偏高”、“偏低”或“无影响”
�
.
�
方案二
�
第
5
页,共
13
页
�
实验方案
�
将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
�
实验步骤
�
�1�
同学们拟选用如图 1 实验装置完成实验:
你认为最简易的装置其连接顺序是 A 接 ______ 接 ______ 接 ______
�
填接口字
母,可不填满
�
.
�2�
仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴
入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验
结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他
们设计了如图 2 所示的实验装置.
�
装置中导管 a 的作用是 ______ .
�
实验前后碱式滴定管中液面读数分别为
�1
mL、
�2
mL,则产生氢气的体积为
______ mL.
�
若需确定产生氢气的量,还需测定的数据是 ______ .
本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构来推断元素为解
为 N 元素,X 为 Si 元素,以此解答该题。
子序数为 Z 元素原子序数的两倍,则 W 应为 S 元素,Z 为 O 元素,由相对位置可知 Y
由元素在周期表中的位置可知 Y、Z 位于第二周期,X、W 位于第三周期,W 元素的原
故选:B。
非金属性,故 D 错误;
D.非金属性越强,对应最高价含氧酸的酸性越强,不是最高价含氧酸不能通过酸性比较
是分子晶体,二者结构不同,故 C 错误;
��2
是原子晶体,
���2
C.
故 B 正确;
,
� � �
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径为
A.X 为 Si 元素,位于元素周期表中的第 3 周期第 IVA 族,故 A 错误;
【解析】解:由以上分析可知 X 为 Si 元素、Y 为 N 元素、Z 为 O 元素,W 为 S 元素。
3.【答案】B
度不大。
实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、离子检验、
D.先加氯水可氧化亚铁离子,不能排除原溶液是否含铁离子。
C.反应需要加热至沸腾;
B.氢氧化铝具有两性;
A.观察 K 的焰色反应需要透过蓝色的钴玻璃;
故选:B。
误;
,也有同样的现象,检验亚铁离子时试剂顺序不合理,故 D 错
�3
��
D.若待测液中含有
悬浊液与葡萄糖只有在加热条件下才能产生砖红色沉淀,故 C 错误;
�ݑ����2
C.新制
均合理,故 B 正确;
遇 NaOH 才能产生“先生成沉淀后沉淀溶解”的现象,操作、现象、结论
�3
��
B.只有
合理,故 A 错误;
,K 元素的焰色浅紫色能被 Na 元素的焰色黄色遮挡,操作不
���3
若含
�.
【解析】解:
2.【答案】B
目难度不大。
本题考查了化学与生活的分析应用,注意知识的积累和理解,掌握基础是解题关键,题
D.少量多次漂洗衣物可以节约用水量。
C.含有两种以上类型的材料称为复合材料;
B.“通风厨”只是避免了实验室内的污染,排放到空气中照样污染环境;
A.氟利昂可导致臭氧空洞;
故选:A。
D.采用萃取原理中的“少量多次”,漂洗衣服时能节约用水,故 D 正确;
导电、导热,二者的密度都较小,故 C 正确;
C.以纤维为增强体、金属为基体的是复合材料,碳纤维熔点高、硬度大,金属钛熔点高、
环境,故 B 正确;
B.“通风厨”只是避免了实验室内的污染,有害气体未被吸收处理,排放到空气中污染
氟利昂可导致臭氧空洞,与雾霾无关,故 A 错误;
�..
【解析】解:
1.【答案】A
答案和解析
页
13
页,共
�
第
第
7
页,共
13
页
答的关键,侧重分析与应用能力的考查,注意元素化合物知识及规律性知识的应用,题
目难度不大。
4.【答案】D
【解析】解:
�.
化合物 A 含有羧基,可发生酯化反应,故 A 错误;
B.化合物 B 不含 H 原子,分子式为
�����
,故 B 错误;
C.化合物 B 含有苯环,由苯和氯气发生取代反应生成,故 C 错误;
D.化合物 A 含有苯环,可与氢气发生加成反应,则 1mol 化合物
���
可与
3ᦙ䁪��2
发生加
成反应,故 D 正确。
故选:D。
A.A 含有羧基,可发生酯化反应;
B.B 不含 H 原子;
C.B 由苯和氯气发生取代反应生成;
D.化合物 A 含有苯环,可与氢气发生加成反应。
本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关
键,侧重分析与应用能力的考查,题目难度不大。
5.【答案】C
【解析】解:废玻璃粉末
�
含
���2
、
��2�3
、
���2
以及其他少量可溶于稀酸的物质
�
中加
入稀盐酸,
��2�3
转化
����3
存在于滤液中,滤渣为
���2
和
���2
;加入稀硫酸和
�2�2
,
���2
转化为
��
3�
,滤渣为
���2
;加入碱后
��
3�
转化为沉淀,最后通入氧气将 Ce 从
� 3
氧化为
� 4
,得到产品
������4
,
A.分析可知滤渣 A 中主要含有
���2
、
���2
,故 A 正确;
B.过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒,故 B 正确;
C.稀硫酸、
�2�2
,
���2
三者反应生成转化为
��2���4�3
、
�2
和
�2�
,反应的离子方程式
为:
��
�
� �2�2 � 2���2 � 2��
3�
� �2 �� 4�2�
,故 C 错误;
D.过程
�
是通入氧气将 Ce 从
� 3
氧化为
� 4
,得到产品
������4
,
4������3 � �2 �
2�2� � 4������4
,消耗
11.2� �2�
已折合成标准状况
�
,转移电子数
�
11.2�
22.4�Ͳᦙ䁪� � 4 �
�.䁨2 � 1䁨
23
� 2 � �.䁨2 � 1䁨
23
,故 D 正确;
故选:C。
废玻璃粉末
�
含
���2
、
��2�3
、
���2
以及其他少量可溶于稀酸的物质
�
中加入稀盐酸,
��2�3
转化
����3
存在于滤液中,滤渣为
���2
和
���2
;加入稀硫酸和
�2�2
,
���2
转化
为
��
3�
,滤渣为
���2
;加入碱后
��
3�
转化为沉淀,最后通入氧气将 Ce 从
� 3
氧化为
� 4
,
得到产品
������4
,据此解答。
本题以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化
还原反应等相关知识,题目难度中等。
6.【答案】C
【解析】【分析】
本题考查原电池与电解池的基础知识,正确判断正负极、阴阳极,注意电极反应式的书
写及电子转移的计算,正确判断化合价的变化为解答该题的关键,题目难度中等。
【解答】
根据
2�ㄲ � �2 � 4��
�
� 2�2� � 2�ㄲ����4
2�
可知,
�2
中元素的化合价降低,被还原,
应为原电池正极,Zn 元素化合价升高,被氧化,应为原电池负极,电极反应式为
�ㄲ �
4��
�
� 2�
�
� �ㄲ����4
2�
,充电时阳离子向阴极移动,以此解答该题。
A.充电时阳离子向阴极移动,故 A 错误;
B.充电时,总反应为
2�ㄲ����4
2�
� 2�ㄲ � �2 � 4��
�
� 2�2�
,则电解质溶液中
����
�
�
第
8
页,共
13
页
逐渐增大,故 B 错误;
C.放电时,负极反应式为
�ㄲ � 4��
�
� 2�
�
� �ㄲ����4
2�
,故 C 正确;
D.放电时,电路中通过 2mol 电子,消耗氧气
11.2��
标准状况
�
,故 D 错误。
故选 C。
7.【答案】D
【解析】解:
�.䁨.䁨1ᦙ䁪� � �
�1
��
溶液中
�� � 2
,则 HA 是强酸,5ml 碱溶液恰好反应
后,溶液呈酸性,51ml 恰好溶液呈中性,说明碱为弱碱,故 A 正确;
B.HA 是强酸,碱为弱碱,MA 是强酸弱碱盐,其稀溶液
�� 液 7
,故 B 正确;
C.由图象可知,N 点溶液呈中性,水电离的氢离子为
1䁨
�7
ᦙ䁪�Ͳ�
,K 点溶液呈碱性,MOH
电离的氢氧根离子抑制了水电离,水电离的氢离子小于
1䁨
�7
ᦙ䁪�Ͳ�
,所以 N 点水的电离
程度大于 K 点水的电离程度,故 C 正确;
D.在 K 点时混合溶液体积是碱溶液的 2 倍,根据物料守恒结合溶液体积变化知,
������ � ���
�
� � 䁨.䁨1ᦙ䁪� � �
�1
,根据电荷守恒得
���
�
� � ���
�
� � ����
�
� � ���
�
�
,
������ � ����
�
� � ���
�
� � ���
�
� � ���
�
� � ������ � 䁨.䁨1ᦙ䁪� � �
�1
� 䁨.䁨䁨5ᦙ䁪� �
�
�1
� 䁨.䁨䁨5ᦙ䁪� � �
�1
,故 D 错误;
故选:D。
䁨.䁨1ᦙ䁪� � �
�1
��
溶液中
�� � 2
,则 HA 是强酸,N 点时溶液呈中性,MOH 的物质的
量大于 HA 的物质的量,说明 MOH 是弱碱,酸或碱性溶液抑制水电离,含有弱根离子
的盐促进水电离,根据物料守恒计算 K 点
������
和
���
�
�
的和.
A.根据
䁨.䁨1ᦙ䁪�Ͳ�
的 HA 溶液的
�� � 2
可知,HA 在溶液中完全电离,则 HA 为强电
解质,恰好反应需要碱 50ml,溶液呈酸性分析;
B.N 点为中性溶液,而 K 点溶液显示碱性,氢氧根离子抑制了水电离电离,MOH 的物
质的量大于 HA 的物质的量,说明 MOH 是弱碱;
C.由图象可知,N 点溶液呈中性,水电离的氢离子为
1䁨
�7
ᦙ䁪�Ͳ�
,K 点溶液呈碱性,MOH
电离的氢氧根离子抑制了水电离,水电离的氢离子小于
1䁨
�7
ᦙ䁪�Ͳ�
,所以 N 点水的电离
程度大于 K 点水的电离程度;
D.根据物料守恒、电荷守恒判断溶液中
������ � ����
�
� � ���
�
�
结果.
本题考查了酸碱混合时的定性判断,注意根据酸溶液的 pH 和酸的浓度确定酸的强弱,
为易错点,题目难度中等.
8.【答案】
4�� � 3���2
�
� 4��
�
� 4��3
�
� 2�2� � 3��
�
提高 减小 大于 NO
溶解度较低或脱硝反应活化能较高 减小
�
2
���4
2�
������
�
�
�����2
�
���
2
���3
2�
�
形成
�ᦙ��4
沉淀,反应平衡
向产物方向移动,
��2
转化率提高
【解析】解:
�1����
、
���2
�
在碱性条件下反应生成
��3
�
、
��
�
,N 元素化合价由
� 2
价变为
� 5
价、Cl 元素化合价由
� 3
价变为
� 1
价,根据转移电子守恒及电荷守恒配平
方程式为
4�� � 3���2
�
� 4��
�
� 4��3
�
� 2�2� � 3��
�
,该反应前后气体体积减小,
则增大压强平衡正向移动,NO 的转化率提高,
故答案为:
4�� � 3���2
�
� 4��
�
� 4��3
�
� 2�2� � 3��
�
;提高;
�
随着吸收反应的进行,溶液由碱性转化为中性,则溶液的 pH 减小,
故答案为:减小;
�
由实验结果可知,脱硫反应速率大于脱硝反应速率,
��2
较 NO 易溶于水,化学反应
速率还与活化能有关,活化能越大化学反应速率越低,所以除了
��2
和 NO 在烟气中的
初始浓度不同,还可能是 NO 溶解度较低或脱硝反应活化能较高,
故答案为:大于;NO 溶解度较低或脱硝反应活化能较高;
�2��
由图分析可知,反应温度升高,
��2
和 NO 的平衡分压
��
越大,说明平衡逆向移动,
脱硫、脱硝反应的平衡常数均减小,
第
Ǥ
页,共
13
页
故答案为:减小;
�
反应
���2
�
� 2��3
2�
� 2��4
2�
� ��
�
的平衡常数
� �
�
2
���4
2�
������
�
�
�����2
�
���
2
���3
2�
�
,
故答案为:
�
2
���4
2�
������
�
�
�����2
�
���
2
���3
2�
�
;
�3�
形成
�ᦙ��4
沉淀,反应平衡向产物方向移动,
��2
转化率提高,NaClO 反应后生成
NaCl,不如生成硫酸钙沉淀容易,
故答案为:形成
�ᦙ��4
沉淀,反应平衡向产物方向移动,
��2
转化率提高。
�1����
、
���2
�
在碱性条件下反应生成
��3
�
、
��
�
,N 元素化合价由
� 2
价变为
� 5
价、
Cl 元素化合价由
� 3
价变为
� 1
价,根据转移电子守恒及电荷守恒配平方程式;增大压
强平衡向气体体积减小的方向移动,根据平衡移动方向判断 NO 转化率改变;
�
随着吸收反应的进行,溶液由碱性转化为中性;
�
由实验结果可知,脱硫反应速率大于脱硝反应速率,
��2
较 NO 易溶于水,化学反应
速率还与活化能有关;
�2��
由图分析可知,反应温度升高,
��2
和 NO 的平衡分压
��
越大,说明平衡逆向移动;
�
反应
���2
�
� 2��3
2�
� 2��4
2�
� ��
�
的平衡常数 K 为生成物浓度幂之积与反应物浓度
幂之积的比;
�3��ᦙ��4
沉淀,促进平衡正向移动。
本题考查化学平衡计算、氧化还原反应等知识点,侧重考查分析计算能力,明确元素化
合物性质、化学平衡常数含义是解本题关键,注意
�2�
题图纵坐标与气体分压成反比,
为易错点。
9.【答案】研磨、
7䁨�
加热
������2
、
������2
、
�ᦙ����2
趁热过
滤 185ab 阳
��2��3 � 2� � 2����4
�
�
高温
�
� 2������4 � 3�� �
【解析】解:
�1�
流程中为加快化学反应速率而采取的措施有研磨、
7䁨�
加热,
故答案为:研磨、
7䁨�
加热;
�2�
由上述分析可知,滤液 1 中加入 NaOH 调节
�� � 12
沉淀
��
2�
、
�ᦙ
2�
、
��
2�
,故
滤渣 2 主要为
������2
、
������2
还有极少量的
�ᦙ����2
,
故答案为:
������2
、
������2
、
�ᦙ����2
;
�3�
根据表可知
��2��3
高温溶解度小,故
Ǥ䁨�
充分反应后,通过趁热过滤分离出固体
��2��3
粗品;
故答案为:趁热过滤;
�4��ꀀ�
含锂
3.5䁨�
的废渣,锂的浸出率为 a,则浸出的
ㄲ���
�
� �
1䁨䁨䁨��3.5��ᦙ
7�Ͳᦙ䁪� � 5ᦙᦙ䁪�
,
��
�
转化为
��2��3
的转化率为 b,则粗品中含
��2��3
的质量是
5ᦙᦙ䁪� �
1
2 � � � 74�Ͳ
ᦙ䁪� � 185ᦙ���
,
故答案为:185ab;
�5�
根据电解图,阳极失去电子发生氧化反应,放电为氢氧根离子,电极反应为:
4��
�
�
4�
�
� 2�2� � �2 �
;阴极放电的是氢离子,阴极生成
��
�
,根据题意得到 LiOH,则
LiOH 在阴极生成,
��
�
移向阴极,为阳离子交换膜;
故答案为:
4��
�
� 4�
�
� 2�2� � �2 �
;阳;
�����2��3
和 C、
����4
高温下反应,生成
������4
和一种可燃性气体,根据元素分析该
气体为 CO,则反应为
��2��3 � 2� � 2����4
�
�
高温
�
� 2������4 � 3�� �
,
故答案为:
��2��3 � 2� � 2����4
�
�
高温
�
� 2������4 � 3�� �
。
第
1䁨
页,共
13
页
由流程可知,将含锂废渣研磨后,在
7䁨�
条件下用稀硫酸酸浸其中的金属离子,得到
含有的
��
�
、
��
2�
、
�ᦙ
2�
、
��
2�
酸性溶液,其中部分
�ᦙ
2�
与硫酸根离子生成
�ᦙ��4
沉
淀,过滤,滤渣 1 主要是
�ᦙ��4
,向滤液 1 中加入 NaOH 调节
�� � 12
沉淀
��
2�
、
�ᦙ
2�
、
��
2�
,滤渣 2 主要为
������2
、
������2
还有极少量的
�ᦙ����2
,滤液 2 含有
��
�
,
向滤液 2 中先加入 EDTA,再加入饱和
�ᦙ2��3
溶液,
Ǥ䁨�
充分反应后,得到沉淀,趁
热过滤得到粗品
��2��3
,将
��2��3
转化为
�����3
后,用隔膜法电解
�����3
溶液制备
高纯度的 LiOH,再转化得电池级
��2��3
,将电池级
��2��3
和 C、
����4
高温下发生
��2��3 � 2� � 2����4
�
�
高温
�
� 2������4 � 3�� �
,以此来解答。
本题考查物质的制备实验,为高频考点,把握物质的性质、发生的反应、制备原理、实
验技能为解答关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难
度不大。
10.【答案】
� � �� 1�
2
2�
2
2�
�
3�
2
3�
�
3�
1䁨
4�
2
4�
3
高
��3
分子间存在较强的
氢键作用,而
��3
分子间仅有较弱的范德华力 离子键和共价键 正四面体
��
3
16
4Ǥ�
ᦙ
3
��
【解析】解:
�1�
同一主族元素的第一电离能随着原子序数增大而减小,所以 N、P、As
第一电离能大小顺序是
� � ��
;As 原子的核外有 33 个电子,根据构造原理书写
As 原子的电子排布式为
1�
2
2�
2
2�
�
3�
2
3�
�
3�
1䁨
4�
2
4�
3
,
故答案为:
� � ��
;
1�
2
2�
2
2�
�
3�
2
3�
�
3�
1䁨
4�
2
4�
3
;
�2���3
分子间能形成氢键,
��3
不能形成氢键,分子间只存在范德华力,所以
��3
熔
沸点较高,
故答案为:高;
��3
分子间存在较强的氢键作用,而
��3
分子间仅有较弱的范德华力;
�3��ᦙ3���4
中
���4
3�
和钠离子之间存在离子键、
�� � �
元素之间存在共价键;
���4
3�
中 As 原子价层电子对个数
� 4 �
5�3�4�2
2 � 4
,根据价层电子对互斥理论判断该离
子的空间构型为正四面体;
��4��
的分子结构中每个 As 原子价层电子对个数是 4 且含有一个孤电子对,根据价层
电子对互斥理论判断在该化合物中 As 的杂化方式为
��
3
,
故答案为:离子键和共价键;正四面体;
��
3
;
�4�
该晶胞中白磷分子个数
� 8 �
1
8 � � �
1
2 � 4
,每个白磷分子中含有 4 个 P 原子,所以
该晶胞中含有 16 个 P 原子;晶胞体积
� ᦙ
3
�ᦙ
3
,该晶胞密度
�
ᦙ
� �
31�4
�� �4
ᦙ
3
�Ͳ�ᦙ
3
�
4Ǥ�
ᦙ
3
�� �Ͳ
�ᦙ
3
,
故答案为:16;
4Ǥ�
ᦙ
3
��
。
�1�
同一主族元素的第一电离能随着原子序数增大而减小;As 原子的核外有 33 个电子,
根据构造原理书写 As 原子的电子排布式;
�2�
含有氢键的氢化物熔沸点较高;
�3��ᦙ3���4
中阴阳离子之间存在离子键、非金属元素之间存在共价键;
���4
3�
中 As 原子价层电子对个数
� 4 �
5�3�4�2
2 � 4
,根据价层电子对互斥理论判断该离
子的空间构型;
��4��
的分子结构中每个 As 原子价层电子对个数是 4 且含有一个孤电子对,根据价层
电子对互斥理论判断在该化合物中 As 的杂化方式;
第
11
页,共
13
页
�4�
该晶胞中白磷分子个数
� 8 �
1
8 � � �
1
2 � 4
,晶胞体积
� ᦙ
3
�ᦙ
3
,该晶胞密度
�
ᦙ
�
。
本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、化学键等知识点,熟练
掌握原子结构、物质结构、元素周期律即可解答,注意:每个白磷分子中含有 4 个 P 原
子。
11.【答案】苯乙酸乙酯 加成反应或还原反应 羰基 酯
基
� ��2 �
4
【解析】解:
�1�
根据 D 的结构简式可知 D 的名称为苯乙酸乙酯;H 与氢气
在催化剂存在下发生加成反应产生 Prolitane ,与氢气的加成反应也叫还原
反应,
故答案为:苯乙酸乙酯;加成反应或还原反应;
�2�ܧ
结构简式为 ,根据结构简式可知含有的官能团分别为酯基和羰基,
故答案为:羰基;酯基;
�3��
相对分子质量是 92,可以与氯气在光照条件下发生取代反应产生
�7�7��
,则 A 是
甲苯 ,B 是 ,故答案为: ;
�4�� � �
是 脱羧生成 G,反应化学方程式为:
,
故答案为: ;
�5��
结构简式为 ,其同分异构体要求
�
属于芳香化合物,说明含有
苯环;
�
能发生银镜反应,说明含有醛基,
�
能发生水解反应,说明含有酯基,则其
为甲酸形成的酯,可能结构为 、 、 、
第
12
页,共
13
页
,共有 4 种;其中核磁共振氢谱显示为 4 组峰,其峰面积比为 3:
2:2:1,符合要求的该同分异构体的结构简式为 ,
故答案为:4; ;
���
模仿
� � �
转化,由苯和乙醇为原料制备苯甲酸乙酯的合成路线:
,
故答案为: 。
芳香烃 A 的相对分子质量为 92,分子中最大碳原子数目
�
Ǥ2
12 � 7��8
,故 A 的分子式
为
�7�8
,则 A 为 ,A 在光照条件下发生取代反应生成 B 为
.�发生酯化反应生成 D,D 发生取代反应生成 E,E 发生酯的水解反应、酸化得到 F 为
,F 加热脱羧生成 G,G 可以看作是先发生加成反应、再发生消去反
应生成 H,H 发生加成反应或还原反应生成 Prolitane,以此解答该题。
本题考查有机物的合成,为高考常见题型,根据转化中有机物的结构明确的发生的反应,
熟练掌握官能团的性质与转化,题目侧重考查学生对知识的迁移运用能力,是有机化学
常考题型。
12.【答案】
2�� � 2�ᦙ�� � 2�2� � 2�ᦙ���2 � 3�2 �
;97;偏高;E;D;G;保持分
液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,
滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起
的氢气体积误差;
�1 � �2
;实验时的温度和压强
【解析】解:方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为
2�� �
2�ᦙ�� � 2�2� � 2�ᦙ���2 � 3�2 �
,
故答案为:
2�� � 2�ᦙ�� � 2�2� � 2�ᦙ���2 � 3�2 �
;
�1�
含镁为
3�
时,金属铝的含量最高,
1䁨.8�
合金中铝的质量为,
1䁨.8� � �1 � 3�� �
1䁨.8 � Ǥ7��
,则:
2�� � 2�ᦙ�� � 2�2� � 2�ᦙ���2 � 3�2 �54g 2mol
1䁨.8� � Ǥ7� � � 1䁨
�3
� � 4.䁨ᦙ䁪�Ͳ�
所以 54g:
�1䁨.8� � Ǥ7�� � 2ᦙ䁪�
:
�� � 1䁨
�3
� � 4.䁨ᦙ䁪�Ͳ��
,解得:
� � Ǥ7
,
故
���ᦙ��
溶液
� � Ǥ7ᦙ�
,
故答案为:97;
�2�
镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,
故答案为:偏高;
方案二:
�1�
装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛
水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生
成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:
���
接
�ܧ����
接
���
,
第
13
页,共
13
页
故答案为:E、D、G;
�2��
装置中导管 a 的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打
开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气
体体积,从而消除由于加入稀硫酸引起的氢气体积误差,
故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀
硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由
于加入稀硫酸引起的氢气体积误差;
�
滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,收集氢气后滴
定管内液面读数减小,所以测定氢气的体积为
�1 � �2
,
故答案为:
�1 � �2
,
�
由于气体受温度和压强的影响较大,若要确定气体的物质的量,必须知道实验时的
温度和压强,
故答案为:实验时的温度和压强.
方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
�1�
镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢
氧化钠溶液的体积应大于或等于最大值,据此计算;
�2�
镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
方案二:
�1�
装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛
水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢
气的体积,量筒内导管应伸入量筒底部;
�2��
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸
能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加
入稀硫酸引起的氢气体积误差;
�
滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积
�
注意应保持干燥
管与滴定管内液面等高
�
,收集氢气后滴定管内液面上升,读数减小;
�
气体受温度和压强的影响较大,若要确定气体的物质的量,必须知道实验时的温度
和压强.
本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理
解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用
知识分析问题、解决问题的能力.
相关文档
- 四川省成都艺术高级中学2020届高三2021-07-0812页
- 【化学】山东省潍坊市2020届高三高2021-07-0812页
- 北京市2020届高三高考模拟化学试题2021-07-0726页
- 2017-2018学年四川省成都市实验中2021-07-069页
- 山东省济宁市2020届高三高考模拟考2021-07-0613页
- 【化学】北京市2020届高三高考模拟2021-07-0623页
- 山东省聊城市2020届高三高考模拟(二2021-07-059页
- 【化学】陕西省咸阳市2020届高三高2021-07-059页
- 【化学】北京市2020届高三高考模拟2021-07-0524页
- 【化学】贵州省黔东南州2020届高三2021-07-059页