- 205.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应与能量
【学习目标】
1.了解化学反应中的能量变化,并了解放热反应和吸热反应
2.介绍燃料充分燃烧的条件,培养节约能源和环境保护的意识。
3.了解焓、焓变、反应热的定义及相互关系。
理解反应热的涵义,能用盖斯定律进行有关反应热的计算。
4.掌握热化学方程式的书写方法和应用。
5.理解燃烧热并掌握有关燃烧热的计算。
6.理解中和热。
{知识结构}
知识点一: 反应能量变化与反应热
1.化学反应与能量变化的关系
任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量是不相等的,在产生新物质的同时总是伴随着能量的变化。
2、化学反应中能量变化形式
形式较多,通常表现为热量的变化
3、
类型
放热反应
吸热反应
定义
形成原因
与化学键强弱的关系
表示方法
△H
△H
图示
实例
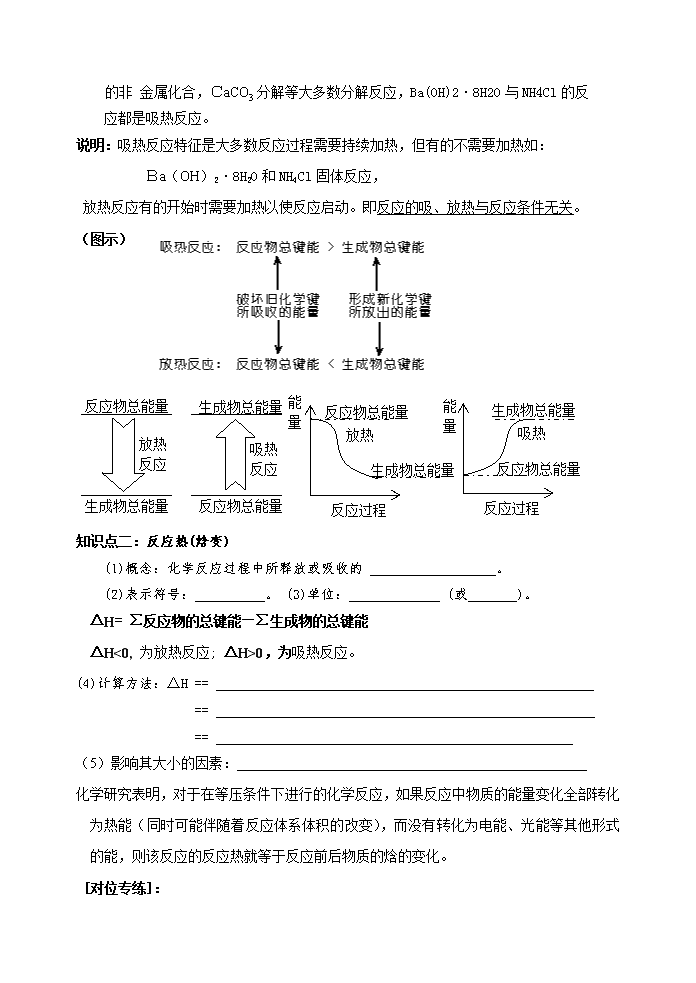
(1)放热反应:即有热量放出的化学反应,其反应物的总能量高于生成物的总能量。
如: 燃料的燃烧、中和反应、生石灰与水化合、金属和酸的反应、铝热反应等
都是放热反应。
(2)吸热反应:即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
如:H2还原CuO的反应,灼热的碳与二氧化碳反应,H2和I2、S、P等不活泼
的非 金属化合,CaCO3分解等大多数分解反应,Ba(OH)2·8H2O与NH4Cl的反
应都是吸热反应。
说明:吸热反应特征是大多数反应过程需要持续加热,但有的不需要加热如:
Ba(OH)2·8H2O和NH4Cl固体反应,
放热反应有的开始时需要加热以使反应启动。即反应的吸、放热与反应条件无关。
(图示)
反应物总能量
反应物总能量
反应物总能量
生成物总能量
生成物总能量
生成物总能量
放热
反应
吸热
反应
反应过程
放热
反应物总能量
生成物总能量
反应过程
吸热
能
量
能
量
知识点二:反应热(焓变)
(1)概念:化学反应过程中所释放或吸收的 。
(2)表示符号: 。 (3)单位: (或 )。
△H= ∑反应物的总键能—∑生成物的总键能
△H<0, 为放热反应; △H>0,为吸热反应。
(4)计算方法:△H ==
==
==
(5)影响其大小的因素:__________________________________________________
化学研究表明,对于在等压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能(同时可能伴随着反应体系体积的改变),而没有转化为电能、光能等其他形式的能,则该反应的反应热就等于反应前后物质的焓的变化。
[对位专练]:
1.下列说法正确的是( )
A.焓是一个物理量,符号为H,单位为mol·L可以测量
B.焓变就是反应热,二者没有区别
C.公式△H--T△S中的△H是反应的焓变
D.焓变△H只有大小,没有正负之分
答案:C
2.下列变化中属于吸热反应的是: ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰( )
A.①② B.②③ C.①④⑤ D.②④
答案:D
3.知化学反应2C(s)+O2(g)2CO(g)、2CO(g)+O22 CO2(g )都是放热反应。据此判断,下列说法中不正确的是 ( )
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32g O2所具有的总能量大于88g CO2所具有的总能量
C.12gC和32gO2所具有的总能量大于44g CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成C0时放出的热量多
答案:A
4. 下列反应属于吸热反应的是:
A. 铜与硫蒸气反应 B. Mg粉与 水反应
C. 干冰升华为气体 D. 硫酸钙高温锻烧
答案:D
5. 下列说法正确的是
A. 需要加热方能发生的反应一定是吸热反应;
B. 放热的反应在常温下一定很易发生;
C. 一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定;
D. 吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量。
答案:C
知识点三:热化学方程式
1.概念:表示参加反应物质的量和 的关系化学方程式。
2.表示意义:2H2(g)+02(g)===2H20(1) △H ===一571.6 kJ·mol—1 表示在
条件下。 H2和 02完全反应生成2 mol 时要 ____
3、书写注意点:
[对位专练]
1. 含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是:
A. NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) DH=+28.7kJ/mol
B. NaOH(aq)+HCL(aq) = NaCl(aq)+H2O(1) DH=-28.7kJ/mol
C. NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) DH=+57.4kJ/mol
D. NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) DH=-57.4kJ/mol
答案:D
2. 分析下面的能量变化示意图,下列热化学方程式正确的是:
A. 2A(g)+B(g)=2C(g); DH=a(a>0)
B. 2A(g)+B(g)=2C(g); DH=a(a<0)
C. 2A+B=2C; DH=a(a<0)
D. 2C=2A+B; DH=a(a>0)
答案:B
3.已知在发射卫星时可用肼(N2H4)作燃料和N02作氧化剂,两者反应生成N2和水蒸气。又知: ①N2(g) + 202(g)====2N02(g) △H ==+67.47 kJ·mol-1
②N2H4(g)+02(g)====N2(g)+2H20(g)△H===--534 kJ·mol-1
写出肼与N02反应的热化学方程式:
答案:N2H4(g)+N02(g)====3/2N2(g)+2H20(g)△H===--567.85 kJ·mol-1
4.用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
CH4(g)+4N02(g)====4N0(g)+C02((g)+2H20(g) △H==--574 kJ·mol-1
CH4(g)+4N0(g)=====2N2(g)+C02(g)+2H20(g) △H==一1160 kJ·mol-1
若用标准状况下4.48 L CH4还原N02至N2,整个过程中转移的电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ
答案: 1.6NA 173.4
5、阿伏加德罗常数值记为NA,则关于C2H2(气)+ O2(气)=2CO2(气) +H2O(液);
DH=-1300kJ/mol的下列说法中,正确的是:
A. 有10NA个电子转移时,吸收1300kJ的能量
B. 有8NA个碳氧共用电子对生成时,放出1300kJ能量
C. 有NA个水分子生成且为液体时,吸收1300kJ能量
D. 有2NA个碳氧双键生成时, 放出1300kJ能量
答案:B
4、应用——反应热大小的比较:
(1) 同一反应生成物状态不同时
如:2H2(g)+O2(g) = 2H2O(1); DH1
2H2(g)+O2(g) = 2H2O(g); DH2
因为气体变液体会放热,故:DH1< DH2
(2) 同一反应反应物状态不同时点
燃如:S(g)+O2(g) = SO2(g); DH1
S(s)+O2(g) = SO2(g); DH2
因为固体变气体会吸热,故: DH1< DH2
(3) 两个相联系的不同反应比较
如: C(s)+O2(g) = CO2(g);DH1
C(s)+1/2O2(g) = CO(g);DH2
可以设计成:C(s) —— CO(g)———CO2(g) 故 DH1< DH2
知识点四:燃烧热和中和热
1、燃烧热的定义:
表示方法:
2、中和热的定义:
表示方法:
3、二者比较:
燃烧热
中和热
相同点
能量变化
放热反应
放热反应
DH
< 0
< 0
不同点
反应物的量
1mol
生成物的量
1mol H2O
注意点
一定是指101kPa时1mol可燃物燃烧生成稳定氧化物时的热效应。C→CO2, H→H2O(l), S→SO2…
稀溶液中,强酸与强碱反应的中和热都相同,均约为57.3kJ/mol
[对位专练]
1. 下列热化学方程式中的DH能表示可燃物燃烧热的是:( )
A. H2(g)+Cl2(g)===2HCl(g); DH=-184.6kJ/mol
B. CH4(g)+2O2(g)===CO2(g); DH=-802.3kJ/mol
C. 2H2(g)+O2(g)===2H2O(g); DH=-571.6kJ/mol
D. CO(g)+1/2O2(g)===CO2(g); DH=-283kJ/mol
答案:D
2. “中和热”是一个在热化学中的重要概念,“中和热”的定义为:在稀溶液里,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫做中和热。以下关于中和热的叙述正确的是:( )
A. 在稀溶液中所有酸和碱反应的中和热都相等
B. 在稀溶液中强酸和强碱反应的中和热都相等
C. 在稀溶液中1mol酸和1mol碱反应放出的热量都相等
D. 将浓硫酸滴入氢氧化钠浓液中刚好生成1mol水时,产生的热量即为中和热
答案:B
知识点五: 盖斯定律
化学反应的反应热只与反应体系的 和 有关,而与反应 无关
如由A到B可以设计如下两个途径:,
途径l:A-→B(△H) 途径二:A--→C—→B(△Hl+△H2)
则焓变△H、△H1、△H2的关系可以表示为
[对位专练]
1、 已知: ① C(s)+O2(g) = 2CO2(g); DH=393.5kJ/mol
② 2CO(g)+O2(g)=== 2CO2(g); DH=-566kJ/mol;
③ TiO2(s)+2C2(g)===TiCl4(g)+O2(g); DH=+141kJ/mol
则TiO2(s)+2Cl2(g)+2C(s) =TiCl4(s)+2CO(g)的DH为: C
A. -313.5kJ/mol B. +313.5kJ/mol C. -80.0kJ/mol D. +80.0kJ/mol
答案:C
2、有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得:
①已知:C(石墨,s)+O2(g)=====C02(g) △H1==一393.5 kJ·mol-1
2H2(g)+ 02(g)===2H20(1) △H2==一571.6 kl·mol-1
2C2H2(g)+502(g)===4C02(g)+2H20(1) △H3===一2599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成lmol C2H2(g)时△H== kJ·mol-1。
②已知3.6 g碳在6.4 g氧气中燃烧至反应物耗尽时放出xkJ热量。单质碳的燃烧热为Y kJ·mol-1,则1 mol C与02反应生成C0的反应热△H= kJ·mol-1。
答案: ①226.8 ②-(5x-0.5y)
知识点六:能源
下列有关能量的说法不正确的是:
A. 化石能源物质内部贮存着大量的能量
B. 吸热反应是由于反应物总能量低于生成物总能量,因而没有利用价值
C. 由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
D. 化学物质中的化学能可以在一定条件下转化为热能、机械能、光能、电能为人类
所利用
答案:B
[随堂检验]
1.中国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉好处在于 ( )
A.增大煤炭燃烧时的燃烧热并形成清洁能源 B.减少炉中杂质气体(S02等)的形成
C.提高煤炭的热效率并减少C0排放 D.使得燃料燃烧充分,从而提高燃料利用率
2.某学生用如下图所示装置进行化学反应X 十2Y====2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升。关于该反应的下列叙述正确的是 ( )
①该反应为放热反应 ②生成物的总能量比反应物的总能量高
③该反应过程可看成是“储存”于X、Y内部的能量转化为热量而释放出来
A. ①②③ B. ①③ C. ①② D. ③
3.根据热化学方程式S(s)+O2(g)===S02(g);△H== --297.23kJ/
mol,分析下列说法中正确的是
A.S(g)+ O2(g)====S02(g)+Q Q值大于297.23 kJ/mol
B.S(g)+ 02(g)====S02(g)+Q Q值小于297.23 kJ/mol
C.1 mol S02的键能总和大于1 molS与1mol 02 的键能总和
D.1 mol S02的键能总和小于1 molS与1mol 02的键能总和
4.已知25.C、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+02(g)===C02(g);△H== --393.51kJ/mol
C(金刚石)+02(g)===C02(g);△H==一395.41 kJ/mol 据此判断下列说法正确的是A.由石墨制备金刚石是吸热反应,等质量时石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应,等质量时石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应,等质量时石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应,等质量时石墨的能量比金刚石的高
7.把煤作为燃料可通过下列两种途径。 途径I:C(s)+O2(g)===C02(g)(放热Ql kJ)
途径Ⅱ先制水煤气: C(s) + H20(g)===== C0(g)+ H2(g)(吸热Q2 kJ),再燃烧水煤气:2CO(g)+02(g)====2C02(g) 2H2(g)+02(g)===2H20(g)(共放热Q3kJ) 试回答:
(1)途径I放出的热量 (填“>”、“=”、“<”)途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是 。
(3)由于制取水煤气的反应里,反应物所具有的总能量 (填“》”、“==”、“<”)生成物所具有的总能量,因此在化学反应里,反应物就需要 能量才能转化为生成物,因此其反应条件为
参考答案
1.CD 2.B 3.AC 4.A 5.C
7. (1) == (2) Q1== Q3 -- Q2 (3) < 吸热 高温
相关文档
- 2020届高考化学一轮复习化学计量在2021-07-0811页
- 2020届高考化学一轮复习化学反应与2021-07-088页
- 2020届高考化学一轮复习化学反应中2021-07-089页
- 2020届高考化学一轮复习化学实验常2021-07-0828页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-088页
- 2020届高考化学一轮复习化学反应与2021-07-0821页
- 2021届高考化学一轮复习化学实验方2021-07-0813页
- 2020届高考化学一轮复习化学反应速2021-07-0815页
- 2020届高考化学一轮复习化学反应与2021-07-0810页
- 2021届高考化学一轮复习化学工艺流2021-07-0812页