- 2.39 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
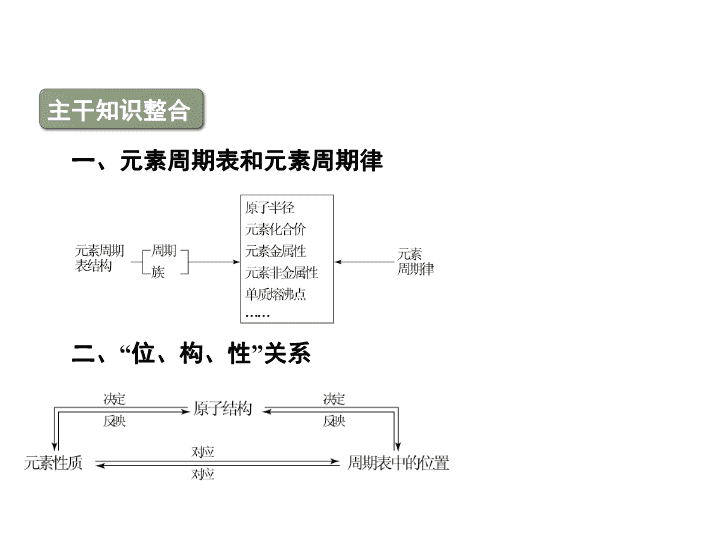
主干知识整合
一、元素周期表和元素周期律
二、“位、构、性”关系
主干知识整合
一、粒子半径大小比较的一般规律
•1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>
r(Fe3+)
•2.电子层结构相同的离子,核电荷数越大,半径越小。
•例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
•3.带相同电荷的离子,电子层数越多,半径越大。
•例:r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+),r(O2-)<r(S2-)<r(Se2-)<r(Te2-)
•4.带电荷、电子层均不同的离子可选一种离子参照比较。例:比较r(K+)与r(Mg2+)可选r(Na+)为参照,可知r(K+)>r(Na+)>
r(Mg2+)
•离子
•半径
•1.电子层数相同时,随原子序数递增,原子半径减小。
•例:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
•2.最外层电子数相同时,随电子层数递增,原子半径增大。
•例:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)
•原子
•半径
二、元素推断题的解题思路
1.元素推断题的解题思路一般为:先确定该元素所在的主族位置,然后再
根据该族元素性质变化规律进行推测判断。
2.确定元素形成的化合物的解题思路一般为:推价态、定元素、想可能、
得形式,从而获得结果。
3.对元素“位、构、性”关系的分析思路一般为:先确定元素所在周期表
中的位置,然后再根据位置推测性质。
三、周期表中部分规律总结
1.最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电
子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素
是稀有气体元素(He例外)。
2.在周期表中,第ⅡA与ⅢA族元素的原子序数差别有以下三种情况:①
第1~3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期
相差25。
3.每一周期排布元素的种类满足以下规律:设n为周期
序数,则奇数周期中为 种,偶数周期中为 种。
4.同主族相邻元素的原子序数差别有以下两种情况:
①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的
数目=下一周期元素的原子序数;②第ⅢA~ⅦA族,上一周
期元素的原子序数+下一周期元素的数目=下一周期元素的
原子序数。
5.设主族元素族序数为a,周期数为b,则有:①a/b<1时,为金属元素,
其最高价氧化物为碱性氧化物,最高价氧化物对应的水化物为碱;②a/b=1时,
为两性元素(H除外),其最高价氧化物为两性氧化物,最高价氧化物对应的水化
物为两性氢氧化物;③a/b>1时,为非金属元素,其最高价氧化物为酸性氧化物,
最高价氧化物对应的水化物为酸。无论是同周期还是同主族元素中,a/b的值越
小,元素的金属性越强,其最高价氧化物对应水化物的碱性就越强;反之,a/b
的值越大,元素的非金属性越强,其最高价氧化物对应水化物的酸性就越强。
6.元素周期表中除第Ⅷ族元素以外,原子序数为奇(或偶)数的元素,元素
所在族的序数及主要化合价也为奇(或偶)数。
7.元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为
非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般
既有金属性,也有非金属性。
8.对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下
角)的两主族元素性质相似,这一规律在第二、三周期元素间尤为明显。
要点热点探究
► 探究点一 简单粒子半径的比较方法
粒子半径比较原则:(1)同种元素,阴离子半径大于其原
子半径,阳离子半径小于其原子半径;(2)同主族元素原子半
径由上到下依次增大,同周期元素原子半径从左至右依次减
小;(3)具有相同电子层结构的离子,核电荷数越大,半径越
小。即比较粒子半径基本的观察顺序是:一层二核三电子。
例1X和Y两元素的阳离子具有相同的电子层结构,
X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元
素的原子核外电子层数相同,Z元素的原子半径小于Y元
素的原子半径。X、Y、Z三种元素原子序数的关系是(
)
A.X>Y>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
【点评】 牢记比较粒子半径大小的规律,逐项分析题给
条件,条理清晰,注意逻辑顺序。最好,每分析完一项,记
录在草稿纸上,然后,进行综合。
D 【解析】 对于电子层结构相同的离子,核电荷数越大,半径越小,
现X元素的阳离子半径大于Y元素的阳离子半径,故核电荷数应是Y>X。Z和Y
的原子核外电子层数相同,则它们在同一周期,随着核电荷数的递增,原子半
径逐渐减小,现Z的原子半径小于Y的原子半径,则核电荷数Z>Y。综合以上关
系得三种元素原子序数的关系为Z>Y>X。
短周期元素A、B、C、D的原子序数依次递增,
它们的原子序数之和为32,且原子最外层电子数之和为10;
A、C原子的最外层电子数之和等于B原子的次外层电子数;
A与C,B与D均为同主族元素。下列叙述正确的是( )
A.四种元素的原子半径:C>D>B>A
B.C元素处于元素周期表中第三周期第ⅡA族
C.最高价氧化物对应的水化物的酸性:B>D
D.B、D的最高价氧化物中,B、D与氧原子之间均为
单键
AC 【解析】 本题的关键是确定四种元素在周期表中的位置。因为A、C原
子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素,
假设B为第二周期元素,则A、C只能是第ⅠA族元素,又因为四种元素的原子序数
逐渐增大,则A只能是氢,C只能是钠。由此推出D是第三周期元素,根据核外电子
排布的规律,假设B、D均属于第x族,则有1+2+x+11+10+x=32,解得x=4。
即B是碳元素,D是硅元素。假设B属于第三周期元素,则A、C两元素属于第ⅣA族,
因为四种元素的原子最外层电子数之和为10,则B、D属于第ⅠA族元素,显然不合
理。
根据四种元素在周期表中的位置可以判断,四种元素的原子半径:C>D>B>
A。碳的非金属性大于硅,故最高价氧化物对应的水化物的酸性:B>D。碳的最高
价氧化物是二氧化碳,分子中碳氧之间是双键。
【点评】 题目给出的信息较多,需要首先对信息有一个整体的把握,然
后,确定关键信息(解题的突破口)——本题最容易确定的是“A、C原子的最外
层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素”,然
后,据此剥茧抽丝,形成答案。
► 探究点二 元素金属性和非金属性强弱的判断方法
金
属
性
比
较
本质 原子越易失电子,金属性越强。
判断依据
1.在金属活动性顺序中位置越靠前,金属性越强
2.单质与水或非氧化性酸反应越剧烈,金属性越强
3.单质还原性越强或离子氧化性越弱,金属性越强
4.最高价氧化物对应水化物的碱性越强,金属性越强
5.若Xn++Y→X+Ym+,则Y比X金属性强
非金
属性
比较
本质 原子越易得电子,非金属性越强
判断方法
1.与H2化合越容易,气态氢化物越稳定,非金属性越强
2.单质氧化性越强,阴离子还原性越弱,非金属性越强
3.最高价氧化物对应水化物的酸性越强,非金属性越强
4.An-+B→Bm-+A,则B比A非金属性强
需要说明的是,除了这些常规的判据之外,还有一些间接的判断方法:例
如,在构成原电池时,一般来说,负极金属的金属性更强。也可以根据金属活动
性顺序判断。根据电解时,在阳极或者阴极上放电的先后顺序来判断等。
例2短周期金属元素甲~戊在元素周期表中的
相对位置如下表所示,下面判断正确的是( )
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
戊丁丙
乙甲
C 【解析】 同周期元素从左到右,原子半径是减小的,故A错;同
主族元素金属性自上而下是增强的,故B错;同周期元素的金属性从左到右
越来越弱,故对应碱的碱性也是减弱的,C正确;同周期元素原子的最外层
电子数从左到右越来越多,故D错。
同周期的三种元素X、Y、Z,已知它们的最高
价含氧酸的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。
则下列叙述不正确的是( )
A.非金属性X>Y>Z
B.X、Y、Z形成的阴离子的还原性逐渐增强
C.原子半径X<Y<Z
D.X、Y、Z的气态氢化物的稳定性逐渐增强
【点评】 本题很好地考查了元素非金属性与其单质及
化合物的关系。
D 【解析】 元素的非金属性越强,最高价含氧酸的
酸性越强,因为酸性HXO4>H2YO4>H3ZO4,所以A正确;元
素的非金属性越强,对应离子的还原能力越弱,所以B正确;
同周期元素非金属性越强,半径越小,所以C正确;元素的
非金属性越强,对应气态氢化物的稳定性越强,所以D错误。
► 探究点三 元素周期表的结构
族
元素周期表的结构 位置与结构的关系
主族
ⅠA族、 ⅡA族ⅢA
族、ⅣA族ⅤA族、
ⅥA族ⅦA族
由长周期元素和短周
期元素共同构成的族
最外层电子数=主族序数=
价电子数
零族 最外层电子数均为8个(He为2个)
副族
ⅡB族、ⅢB族、
ⅣB族、ⅤB族、
ⅥB族、ⅦB族
只由长周期元素构成
的族
最外层电子数一般不等于族序数(第ⅠB族、
ⅡB族除外)最外层电子数一般有1~7个
第Ⅷ族 有三列元素
例3 根据中学化学教材所附元素周期表判断,下列
叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元
素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元
素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与
该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与
该元素原子的M层电子数相等
【点评】 本题考查原子结构与周期表结构的关系。周
期数=电子层数,主族数=最外层电子数。
C 【解析】 A项为H元素。根据最外层电子数=主族
序数,B和D项最外层电子数为1、3、5、7,也为主族序数。
对于C项,如最外层电子数为8,则与说法不符。
► 探究点四 对“位、构、性”三者关系的综合考查
例4 下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序
数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
【点评】 题目比较直白地考查了周期表的结构、元素
的性质等之间的关系,但需要有比较完整的知识结构。
B 【解析】 本题考查元素周期律、元素周期表及物
质结构的知识,可用举例法解答。氦原子最外层电子数为2,
为零族,A项错误;MgCl2中Mg、Cl原子序数之差为5,CO2
中C、O原子序数之差为2,B项正确;由于HF中存在氢键,
故HF的沸点比HCl的高,C项错误;第ⅠA中H元素的氧化物
H2O为分子晶体,其他碱金属元素的氧化物为离子晶体,D
项错误。
► 探究点五 确定“指定的几种元素形成的化合物”的形式
该类题目的主要特点是,给出几种元素的原子结构或
性质特征,判断它们形成化合物的形式。解答该类题目的
方法思路是:推价态、定元素、想可能、得形式。该类题
目也可由化合物形式判断元素的原子序数。
例5 X、Y、Z为短周期元素,这些元素原子的最外
层电子数分别为1、4、6,则由这3种元素组成的化合物
的化学式不可能是( )
A.XYZ B.X2YZ
C.X2YZ2 D.X2YZ3
【点评】 本题考查1~18元素的原子核外电子排布的
特点及核外电子排布规律。
A 【解析】 原子最外层电子数为1、4、6的短周期
元素分别是:“1”——H、Li、Na,“4”——C、Si,
“6”——O、S。可将H、C、O三元素作为代表,它们可组
成的物质有:H2CO3、HCHO、HCOOH等,将其与题中选项对
照即得答案。
若短周期中的两种元素可以形成原子个数比
为2∶3的化合物,则这两种元素的原子序数之差不可能
是( )
A.1 B.3 C.5 D.6
D 【解析】 设两种元素的符号分别为X和Y,则化合物
的化学式为X2Y3,即X为+3价,Y为-2价,在短周期元素
中满足此要求的X元素有5B、7N、13Al,Y元素有8O和16S,
原子序数差值见下表:
本题正确答案为D。
► 探究点一 元素周期表的结构
1.记住元素周期表的18个纵行及对应的族
2.记住元素周期表的边界
3.记住元素周期表的一些特点
(1)短周期元素只有前三周期;
(2)主族中只有ⅡA族元素全部为金属元素;
(3)ⅠA族元素不等同于碱金属元素,H元素不属于碱金属元素;
(4)元素周期表第18列是0族,不是ⅧA族,第8、9、10列是Ⅷ
族,不是ⅧB族;
(5)长周期不一定是18种元素,第六周期有32种元素。
例1 [2011·江苏化学卷] 短周期元素X、Y、Z、W、Q在元
素周期表中的相对位置如图7-1所示。下列说法正确的是(
)
A.元素X与元素Z的最高正化合价
之和的数值等于8
B.原子半径的大小顺序为:
rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外
电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
A 【解析】 由元素的相对位置关系可推得:X为N,Y为O,
Z为Al,W为S,Q为Cl。主族元素的最高正价等于最外层电
子数,N为+5价,Z为+3价,两者之和为8,A对;电子层数
越多,原子半径越大,同一周期元素从左到右原子半径逐渐
减小,故原子半径大小顺序为:rZ>rW>rQ>rX>rY,B错;
O2-和Al3+的离子结构示意图与Ne相同,核外电子数和电
子层数均相同,C错;非金属性S<Cl,则酸性H2SO4<
HClO4,D错。
【点评】 残缺元素周期表类的元素推断往往为给出元素周期
表中短周期元素的一部分,根据文字信息或者周期表结构中
“隐藏”的信息进行推断,如第一周期只有两端有元素、某
元素上方有相邻元素,则必为第三周期元素或Li或Ne等。
如图7-2为周期表中短周期的一部分,若X原子最外
层电子数比次外层电子数少3,则下列说法正确的是( )
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X
C.Y、R形成的化合物YR2能使KMnO4溶液褪色
D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电
子结构
C 【解析】 X原子最外层电子数比次外层电子数少3,则X
为P元素,依此可推出Y、Z、R分别为S、Cl、O元素。
关于元素在周期表中的位置、原子结构和性质的关系,说
法正确的是( )
A.与铝同族的元素,其单质既能与酸反应,又能与碱反应
B.第三周期主族元素的最高正化合价等于它所处的族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.最外层电子数相同的原子属于同一族且化学性质相似
B 【解析】 A项,与铝同族的元素有B、Ga、In、Tl,从上
到下,非金属性减弱,金属性增强,只有Al既能与酸反应,
又能与碱反应,这是Al的特性,而非第ⅢA族元素的共性,
错误;B项,第三周期的Na、Mg、Al、Si、P、S、Cl对应的
最高正价正好都是其最外层电子数,也等于族序数,正确;
C项,短周期元素形成阴、阳离子后大部分都能达到8电子稳
定结构,但H、Li、Be形成的离子最外层是2个电子或没有电
子而例外,错误;D项,最外层电子数相同的原子属于同一
族,只对主族元素而言,且化学性质也不一定相似,例如H
与碱金属元素化学性质相差很多,错误。
► 探究点二 元素周期表中的规律
1.电子排布规律
(1)最外层电子数为1或2的原子可以是ⅠA族、ⅡA族或副族元
素的原子;最外层电子数是3~8的原子一定是主族元素的原子,
且最外层电子数等于主族的族序数。
2.短周期元素原子结构的特殊性
(1)原子核中无中子的原子:H。
(2)最外层只有一个电子的元素:H、Li、Na。
(3)最外层有两个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数2倍的元素:C;三倍的是O;
四倍的是Ne。
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)电子总数为最外层电子数2倍的元素:Be。
(8)次外层电子数是最外层电子数2倍的元素:Li、Si。
(9)内层电子数是最外层电子数2倍的元素:Li、P。
3.序数差规律
(1)同周期相邻主族元素原子的“序数差”规律
①除第ⅡA族和第ⅢA族外,其余同周期相邻元素序数差为1。
②同周期第ⅡA族和第ⅢA族为相邻元素,其原子序数差为:
第二、三周期时相差1,第四、五周期时相差11,第六、七周
期时相差25。
(2)同主族相邻元素的“序数差”规律
①第二、三周期的同族元素原子序数相差8。
②、第三、四周期的同族元素原子序数相差有两种情况:第
ⅠA族、ⅡA族相差8,其他族相差18。
③第四、五周期的同族元素原子序数相差18。
④第五、六周期的同族元素原子序数镧系之前的相差18,镧系
之后的相差32。
⑤第六、七周期的同族元素原子序数相差32。
4.奇偶差规律
元素的原子序数与该元素在周期表中的族序数和该元素的主要
化合价的奇偶性一致。若原子序数为奇数时,主族族序数、元
素的主要化合价均为奇数,反之则均为偶数(但要除去N元素,
有多种价态,Cl元素也有ClO2)。零族元素的原子序数为偶数,
其化合价看做0。
专题七 │ 要点热点探究
需要说明的是,除了这些常规的判据之外,还有一些间接
的判断方法:例如,在构成原电池时,一般来说,负极金属的
金属性更强。根据电解时,在阳极或者阴极上放电的先后顺序
来判断等。
需要特别注意的是,利用原电池原理比较元素金属性时,
不要忽视介质对电极反应的影响。如Al—Mg—NaOH溶液构
成原电池时,Al为负极,Mg为正极;Fe—Cu—HNO3(浓)构
成原电池时,Cu为负极,Fe为正极。
例2 [2011·重庆卷] 下列叙述正确的是( )
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈
中性
C. Li、Na、K的原子半价和密度随原子序数的增加
而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性
逐渐增强
专题七 │ 要点热点探究
D 【解析】 氯气具有强氧化性,铁在氯气中燃烧生成FeCl3,
H+的氧化性较弱,与铁反应生成FeCl2,A项错误。锌与不
足量的稀硫酸反应生成ZnSO4溶液,属于强酸弱碱盐,溶液
显酸性,K与硫酸反应后得到K2SO4为中性,而过量的K继续
与水反应生成KOH,因此最后溶液显碱性,B项错误。Li、
Na、K为同主族元素,从上到下原子半径依次增大,但密度
金属钠大于金属钾,出现反常,C项错误。非金属性越强,其
最高价氧化物对应水化物的酸性越强,C、P、S、Cl的非金
属性依次增强,因此D项正确。
【点评】 元素金属性及非金属性强弱比较是元素推断题中
的主要考查点之一,其考查方式主要为:在推断出元素的基
础上考查元素氢化物的稳定性、元素最高价氧化物对应水化
物的酸碱性、元素对应单质的氧化性或还原性等。
D 【解析】 这张表是短周期元素周期表一部分,则应该
是第二、三两个周期,且X、W质子数之和为23,根据相邻周
期、主族质子数关系计算得,X为N,W为S,Y为F,Z为Si。
N元素可形成+1、+2、+3、+4、+5价的氧化物,其中+4
价的有NO2和N2O4,所以有六种氧化物,A错;F的氢化物的
水溶液是HF酸,是弱酸,B错;W的氢化物是H2S,由于
H2O之间存在氢键,所以H2S的沸点比H2O的沸点低,C错;
Si与F2发生反应的化学方程式为Si+2F2===SiF4,反应物物
质的量之比为1∶ 2,D正确。
某矿石由前20号元素中的四种组成,其化学式为WYZX4。X、Y、Z、
W分布在三个周期,原子序数依次增大,Y、W为金属元素,X原子的最
外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最
外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同一周
期,Z单质是一种良好的半导体。则下列判断正确的是( )
A.Y、Z的氧化物都有两性
B.气态氢化物的稳定性:Z>X
C.原子半径:W>Y>Z>X
D.最高价氧化物对应水化物的碱性:Y>W
C 【解析】 首先推出X和Z分别为O元素和Si元素。W能与
冷水剧烈反应,且原子序数最大,推测W为K或Ca,若W为
Ca,Y、Z原子的最外层电子数之和与X、W原子的最外层电
子数之和相等,推出Y、Z最外层分别有4个和4个电子,而题
中说,Y、Z(Si)位于同一周期,矛盾,故W只能是K,则Y为
铝。
► 探究点三 元素推断题的解题思路
1.元素推断题的解题思路一般为:先确定该元素所在的主
族位置,然后再根据该族元素性质变化规律进行推测判断。
2.确定元素形成的化合物的解题思路一般为:推价态、定
元素、想可能、得形式,从而获得结果。
3.对元素“位、构、性”关系的分析思路一般为:先确定
元素所在周期表中的位置,然后再根据位置推测性质。
例3 有A、B、C三种短周期元素在周期表中相对位置如图
7-4:
(1)A与B形成的液态化合物是常见的重要有机溶剂,则A、B、
C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序
是:________>________>________(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质。标准状况下,X的密度
为3.17 g·L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色
钴玻璃),室温下0.1 mol·L-1 Z水溶液pH=13。X、Y、Z有
如图7-4所示转化关系:
①写出X与Z反应的离子方程式:_________________。
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的化
学 式 _ _ _ _ _ , 丁 的 水 溶 液 p H > 7 的 原 因 :
________________________(用离子方程式表示)。
③将20 mL 0.5 mol·L-1丙溶液逐滴加入20 mL 0.2 mol·L
-1 KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离
子方程式_____________________________。
A、B、C、D、E是核电荷数依次增大的短周期元素,原子半
径按D、E、B、C、A的顺序减小,B和E同主族,下列推断不
正确的是( )
A.A、B、E一定在不同周期
B.D为第二周期元素
C.A、D可能在同一主族
D.C和D的单质可能化合为离子化合物
B 【解析】 由E的核电荷数最大,B和E同主族,则E在B
下一周期相邻,由原子半径E在D、B之间,则D必位于E的
左侧。再由原子半径B>C>A,结合原子序数可知B、C同周
期,且C在B的右侧,而A必为氢元素。故D必为第三周期,
B项错误。
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、
X是金属元素,Y、Z是非金属元素。
回答下列问题:
(1)W、X对应的两种最高价氧化物的水化物可以反应生盐和
水,该反应的离子方程式为_______________________。
(2)X的硝酸盐水溶液显____性,用离子方程式解释原因
___________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学
方程式为_______________________。
(4) W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序
是:_____>______>_______>_______。(填写离子符号)
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混
合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学
方程式________________________。
专题七 │ 要点热点探究
短周期元素W、X、Y、Z的原子序数依次增大,且W、X、
Y+、Z的最外层电子数与其电子层数的比值依次为2、3、4、
2(不考虑零族元素)。下列关于这些元素的叙述错误的是( )
A.X和其他三种元素均可形成至少两种的二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形
分子
C.W、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
专题七 │ 教师备用习题
元素推断题的思维捷径和解答技巧
元素推断题主要考查元素周期表中
“位、构、性”的关系及学生利用物质
结构的性质进行综合推断的能力。该类
题目综合性强,难度较大,所占分值较
高。学生需要掌握短周期所有元素的结
构特点、它们在元素周期表中的位置和
性质以及掌握它们形成的化合物的性质,
在此基础上综合分析,得到答案。
一、元素推断题的一般思路
二、有关推断必备知识与题型分析
题型一由主族元素在周期表中的位置推断
解题指导
1.牢记元素周期表的结构(能区分长短周期、主
副族、每周期的元素数目等)是求解的基础,一定要
“心中有表”。
2.熟悉主族元素在周期表中的特殊位置
①族序数等于周期数的元素:H、Be、Al。
②族序数等于周期数2倍的元素: C、S。
③族序数等于周期数3倍的元素:O。
④周期数是族序数2倍的元素:Li。
⑤周期数是族序数3倍的元素:Na。
⑥最高正价与最低负价代数和为零的短周期元素:
C、Si。
⑦最高正价是最低负价绝对值3倍的短周期元素:
S。
⑧除H外,原子半径最小的元素:F。
⑨最高正价不等于族序数的元素:O、F。
【例1】 短周期元素A、B、C的原子序数依次增大,
其原子的最外层电子数之和为10,A与C在周期表
中位置上下相邻,B原子最外层电子数等于A原子
次外层电子数,下列有关叙述不正确的是
( )
A.A与C可形成共价化合物
B.A的氢化物的稳定性大于C的氢化物的稳定性
C.原子半径AC>A。
答案 C
题型二 由元素及其化合物的性质推断
解题指导 掌握常见元素及其化合物的特性是关
键,解决这一关键的关键在于平时的积累。
(1)形成化合物种类最多的元素、单质是自然
界中硬度最大的物质的元素或气态氢化物中氢的质量
分数最高的元素:C
(2)空气中含量最多的元素或气态氢化物的水
溶液呈碱性的元素:N
(3)地壳中含量最多的元素、氢化物沸点最高
的元素或氢化物在通常情况下呈液态的元素:O
(4)单质最轻的元素:H;最轻的金属单质:Li
(5)单质在常温下呈液态的非金属元素:Br;金
属元素:Hg
(6)最高价氧化物及其水化物既能与强酸反应,
又能与强碱反应的元素:Al
(7)元素的气态氢化物和它的最高价氧化物的
水化物能起化合反应的元素:N;能起氧化还原反应
的元素:S
(8)元素的单质在常温下能与水反应放出气体
的短周期元素:Li、Na、F
【例2】 A、B、C、D、E都是元素周期表中前20号
元素,原子序数依次增大,A是地壳中含量最高的
元素,B、C、D同周期,E和其他元素既不在同周
期也不在同主族,D的氢化物和最高价氧化物的水
化物均为强酸,且B、C、D的最高价氧化物的水
化物两两混合均能发生反应生成盐和水。据此回答
下列问题:
(1)A和D的氢化物中,沸点较低的是 (选
“A”或“D”)。
(2)元素C在元素周期表中位置是 ,B的最高
价氧化物的水化物的电子式为 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、
E三种元素的原子个数比为2∶2∶1,该盐的名称为
。它的水溶液与D的氢化物的水溶液反应可生成D
的单质,该反应的离子方程式为:
。
解析 A是地壳中含量最高的元素,A是氧;D的氢
化物和最高价氧化物的水化物均为强酸,D是氯,
B、C、D三元素在第三周期,它们的最高价氧化
物的水化物两两混合均能发生反应生成盐和水,根
据B、C、D原子序数依次增大,因此B是钠,C是
铝,据A、D、E三种元素形成的盐中,A、D、E
三种元素的原子个数比为2∶2∶1,E为+2价金属Ca。
答案 (1)D (2)第三周期ⅢA族
(3)次氯酸钙 ClO-+2H++Cl-
Cl2↑+H2O题型三 综合利用“位”、“构”、“性”的关
系推断
解题指导 这类题目综合性强,难度较大,但若
对元素周期律的实质和元素周期表的结构知识熟练掌
握,这一类问题便能顺利求解。
【典例3】 根据下表中有关短周期元素性质的数据,
判断下列说法不正确的是 ( )
元素编号
元素性质
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.47 1.60 1.52 1.10 0.99 1.86 0.75 0.82
主
要
化
合
价
最高价 +2 +1 +5 +7 +1 +5 +3
最低价 -2 -3 -1 -3
A.③和⑥、④和⑦分别处于同一主族
B.元素④处于第三周期ⅤA族
C.元素①与元素⑥形成的化合物中不可能存在共价键
D.元素⑧对应的氢氧化物可能具有两性
解析 根据原子半径和主要化合价可以判断出
③④⑥⑦元素分别是Li、P、Na、N,进而推断出
①②⑤⑧元素分别是O、Mg、Cl、B,选项A和B正确;
元素①与元素⑥形成的化合物有Na2O和Na2O2,Na2O2
中既存在离子键又存在非极性共价键,选项C错误;
选项D,由于元素B在周期表中处于金属和非金属交界
线附近,且与Al处于同一族中,它们之间性质有相似
之处,因此选项D正确。
答案 C
迁移应用
1.W、X、Y、Z均为短周期元素,W的最外层电子数与
核外电子总数之比为7∶17;X与W同主族;Y的原子
序数是W和X的原子序数之和的一半;含Z元素的物
质焰色反应为黄色。下列判断正确的是
( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
解析 由题设可判定W为Cl,X为F,Y为Al,Z为Na。
则金属性Na>Al,氢化物沸点HF>HCl,HF分子间存
在氢键。离子还原性Cl->F-,原子半径Na>Al>F,离
子半径F->Na+>Al3+。
答案 B
2.X、Y、Z、M是元素周期表中前
20号元素,其原子序数依次增大,且X、Y、Z相
邻。X的核电荷数是Y的核外电子数的一半,Y与
M可形成化合物M2Y。下列说法正确的是( )
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子
>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
解析 X、Y、Z相邻,X的电荷数为Y的核外电子数
的一半,说明X为氧元素,Y为硫元素,则Z为氯元
素;Y与M可形成化合物M2Y,M为+1价,且在这四种
元素中原子序数最大(前20号元素中)的元素,则
M为钾元素。还原性:H2S>H2O,A项错误;离子半
径:S2->Cl->K+>O2-,B项错误;SO2是含有极性键
的极性分子,K2S中无极性键,C项错误;Cl元素的
最高价氧化物的水化物的化学式是HClO4,D项正确。
答案 D
3.元素X、Y、Z原子序数之和为36,X、Y在同一周期,
X+与Z2-具有相同的核外电子层结构。下列推测不
正确的是 ( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
解析 分析题设信息可知,X、Y、Z分别为Na、
Cl、O三种元素。则同周期中Na的金属性最强,
HClO4的酸性最强,而氧族元素组成的氢化物中H2O
的稳定性最高。离子半径Na+
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页