- 2.95 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一节 醇 酚
第三章 烃的含氧衍生物
据我国《周礼》记载,早在周朝就有酿酒
和制醋作坊,可见人类制造和使用有机物有很
长的历史。
从结构上看,酒、醋、苹果酸、柠檬酸等
有机物,可以看作是烃分子里的氢原子被含有
氧原子的原子团取代而衍生成的,它们被称为
烃的含氧衍生物。
烃的含氧衍生物种类很多,可分为醇、酚、
醛、羧酸和酯等。烃的含氧衍生物的性质由所含
官能团决定。利用有机物的性质,可以合成具有
特定性质而自然界并不存在的有机物,以满足我
们的需要。
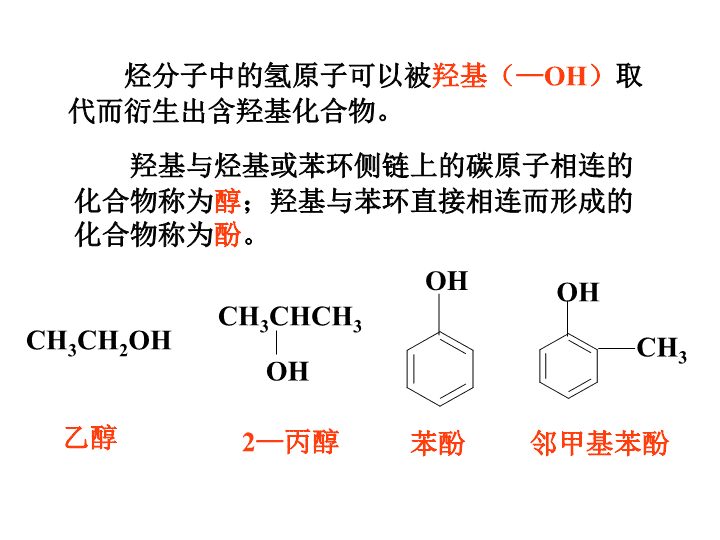
烃分子中的氢原子可以被羟基(—OH)取
代而衍生出含羟基化合物。
羟基与烃基或苯环侧链上的碳原子相连的
化合物称为醇;羟基与苯环直接相连而形成的
化合物称为酚。
CH3CH2OH
CH3CHCH3
OH
乙醇 2—丙醇
OH
苯酚
OH
CH3
邻甲基苯酚
饱和一元醇的命名
(2)编号
(1)选主链
(3)写名称
选最长碳链,且含—OH
从离—OH最近的一端起编
取代基位置— 取代基名称 — 羟基位置— 母
体名称(羟基位置用阿拉伯数字表示;羟基
的个数用“二”、“三”等表示。)
资料卡片
CH2OH
苯甲醇
CH2OH
CH2OH
乙二醇
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或甘油、丙三醇)
CH3—CH2—CH—CH3
OH
CH3—CH—C—OH
CH3
CH2—CH3
CH3
②
③
[练习] 写出下列醇的名称
CH3—CH—CH2—OH
CH3①
2—甲基—1—丙醇
2—丁醇
2,3—二甲基—3—戊醇
一、醇
1.醇的分类
1)根据羟基所连烃基的种类
脂肪醇
脂环醇
芳香醇
饱和
不饱和
CH3CH2OH
CH2=CHCH2OH
OH
CH2OH
2) 根据醇分子结构中羟基的数目,醇可分为一
元醇、二元醇、三元醇……
CH3CH2CH2OH
丙醇(一元醇)
CH2-OH
CH2OH
乙二醇(二元醇)
CH2-OH
CH-OH
CH2OH
丙三醇(三元醇)
乙二醇和丙三醇都是无色、黏稠、有甜味的液
体,都易溶于水和乙醇,是重要的化工原料。
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
乙二醇可用于汽车作防冻剂,丙三醇可用于配
制化妆品。
思考与交流
结论:相对分子质量相近的醇和烷烃相比,醇的沸
点远远高于烷烃。
原因:由于醇分子中羟基的氧原子与另一醇分子羟
基的氢原子间存在着相互吸引作用,这种吸引作用
叫氢键。
甲醇、乙醇、丙醇均可与水以任意比例混溶,
这是因为甲醇、乙醇、丙醇与水形成了氢键。
学与问
乙二醇的沸点高于乙醇,1,2,3—丙三醇的
沸点高于1,2—丙二醇, 1,2—丙二醇的沸点高
于1—丙醇,其原因是:由于羟基数目增多,使得
分子间形成的氢键增多增强。
思考与交流
处理反应釜中金属钠的最安全、合理的方法是
第(3)种方案,向反应釜中慢慢加入乙醇,由于
乙醇与金属钠的反应比水与钠的反应缓和,热效应
小,因此是比较安全,可行的处理方法。
2. 乙醇的结构
从乙烷分子中的
1 个 H 原 子 被 — O H
(羟基)取代衍变成
乙醇
分子式 结构式 结构简式 官能团
C2H6O H—C—C—O—H
H H
H H
CH3CH2OH
或C2H5OH
—OH
(羟基)
3. 乙醇的物理性质
1)无色、透明、有特殊香味的液体;
2)沸点78℃;
3)易挥发;
4)密度比水小;
5)能跟水以任意比互溶;
6)能溶解多种无机物和有机物。
4. 乙醇的化学性质
1)与金属钠反应(取代反应)
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
2)消去反应
脱去—OH和与—OH相邻的碳原子上的1个H
断键位置:
浓硫酸的作用:催化剂和脱水剂
制乙烯实验装置
为何使液体温度迅
速升到170℃?
酒精与浓硫酸
体积比为何 要
为1∶ 3?
放入几片碎
瓷片作用是
什么?
用排水集
气法收集
浓硫酸的作
用是什么?
温度计的
位置?
混合液颜色如何
变化?为什么?
有何杂质气体?
如何除去?
1. 放入几片碎瓷片作用是什么? 防止暴沸
2. 浓硫酸的作用是什么? 催化剂和脱水剂
3. 酒精与浓硫酸体积比为何要为1∶ 3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够
的脱水性,硫酸要用98%的浓硫酸,酒精要用无
水酒精,酒精与浓硫酸体积比以1∶ 3为宜。
4. 温度计的位置? 温度计感温泡要置于反应物的
中央位置因为需要测量的是反应物的温度。
5. 为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下
主要生成乙烯和水,而在140℃时乙醇将以另一
种方式脱水,即分子间脱水,生成乙醚。
6. 混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。
在加热的条件下,无水酒精和浓硫酸混合物的反
应除可生成乙烯等物质以外,浓硫酸还能将无水
酒精氧化生成碳的单质等多种物质,碳的单质使
烧瓶内的液体带上了黑色。
7. 有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反
应制得的乙烯中往往混有H2O、CO2、SO2等气
体。可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
学与问
CH3CH2OHCH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH、乙醇溶液、
加热
C—Br、C—H C—O、C—H
C==C C==C
CH2==CH2、HBr CH2==CH2、H2O
浓硫酸、加热到
170℃
3)取代反应
C2H5OH + HBr C2H5Br + H2O
△
4)氧化反应
2CH3CH2OH+O2 2CH3CHO+2H2O催化剂
有机物分子中加入氧原子或失去氢原子
的反应叫做氧化反应。
CH3CH2OH CH3CHO CH3COOH氧化 氧化
乙醇 乙醛 乙酸
② ①
⑤
③
④
H―C―C―O―H
H H
H H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应(酯化反应)
消去反应
催化氧化
①
燃烧 ⑤
二、酚
1. 定义:羟基跟苯环直接相连的化合物。
2. 结构:
苯环和羟基会相互影响,将决定苯酚的化学性质
OH
3. 物理性质
无色晶体;具有特殊气味;常温下难溶
于水,易溶于乙醇等有机溶剂。650C以上时,
能与水混溶 ;有毒,可用酒精洗涤。
医院常用的“来苏水”消毒剂便是苯酚钠盐的稀溶液。
放置时间长的苯酚往往是粉红
色,因为空气中的氧气就能使
苯酚慢慢地氧化成对-苯醌。
小资料
实验 现象
(1)向盛有少量苯酚晶体的试
管中加入2mL蒸馏水,振荡试
管
(2)向试管中逐滴加入5%的
NaOH溶液,并振荡试管
(3)再向试管中加入稀盐酸
形成浑浊的液体
浑浊的液体变为
澄清透明的液体
澄清透明的液体又
变浑浊
实验3—3
4. 化学性质
1)弱酸性
苯酚能与碱反应,体现出它的弱酸性。因此,
苯酚俗称石炭酸。
ONa
+CO2+H2O
OH
+NaHCO3
说明:苯酚酸性很弱,比碳酸还弱。
2)与溴反应
OH
+ 3Br2
OH
BrBr
Br
↓+3HBr
(可用于苯酚定性检验与定量测定)
①浓溴水与苯酚在苯环上发生取代反应。这说明
羟基对苯环产生了影响,使取代更易进行。
②溴取代苯环上羟基的邻、对位。(与甲苯相似)
③该反应很灵敏,可用于苯酚的定性检验
④不能用该反应来分离苯和苯酚
*3)苯酚的显色反应
遇FeCl3溶液显紫色。这一反应可用于检验
苯酚或Fe3+的存在。
苯酚 苯
反应物
反应条件
取代苯环上
氢原子数
反应速率
结论
原因
溴 水与苯酚反应 液溴与纯苯
不用催化剂 FeBr3作催化剂
一次取代苯环上三个氢原子 一次取代苯环
上一个氢原子
瞬时完成 初始缓慢,后加快
苯酚与溴取代反应比苯容易
酚羟基对苯环影响,使苯环上氢原子变得活泼
苯酚与苯取代反应的比较
学与问
苯酚分子中苯环上连有一羟基,由于羟基对
苯环的影响,使得苯酚分子中苯环上的氢原子比
苯分子中的氢原子更活泼,因此苯酚比苯更易发
生取代反应。
乙醇分子中—OH与乙基相连,—OH上H原
子比水分子中H原子还难电离,因此乙醇不显酸性。
而苯酚分子中的—OH与苯环相连,受苯环影
响,—OH上H原子易电离,使苯酚显示一定酸性。
由此可见:不同的烃基与羟基相连,可以影响物
质的化学性质。
5. 苯酚的用途
苯酚是一种重要的化工原料,可用来制造酚
醛塑料(俗称电木)、合成纤维(如锦纶)、医
药、染料、农药等。粗制的苯酚可用于环境消毒。
纯净的苯酚可配成洗剂和软膏,有杀菌和止痛效
用。药皂中也掺入少量的苯酚。
酚醛树脂的合成
1. 怎样分离苯酚和苯的混合物
加入NaOH溶液→分液→在苯酚钠溶液中加酸或
通入CO2
2. 如何鉴别苯酚
B 利用与浓溴水生成三溴苯酚白色沉淀
A利用与三价铁离子的显色反应
巩固练习
1. 醛基
2. 醛的定义:
:
:
·C:H
O::
结构式
结构简式 不能写成
电子式
分子里由烃基跟醛基相连而构成的化合物。
饱和一元醛的通式: CnH2n+1CHO 或CnH2nO
—CHO —COH
—C — H
O
一、醛基和醛
3. 常见的醛:
甲醛:无色有刺激性气味的气体,它的水溶液
(又称福尔马林)具有杀菌、防腐性能。
苯甲醛肉桂醛 CH2=CH—CHO CHO
1. 物理性质
2. 分子结构:
HC
O
H
H
H
C
结构简式 HC
O
CH3
CH3CHO
甲基+醛基=乙醛
二、乙醛
(课本P56 )
学
与
问
乙醛分子结构中含有两类不同位置的
氢原子,因此在核磁共振氢谱中有两组峰,
峰的面积与氢原子数成正比。因此峰面积
较大或峰高较高的是甲基氢原子,反之,
是醛基上的氢原子。
3. 乙醛的化学性质
(1)氧化反应
a. 银镜反应
CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O
△
资料卡片 银氨溶液的配制
AgOH+2NH3·H2O=Ag(NH3)2 OH+2H2O
AgNO3 + NH3·H2O=AgOH↓+NH4NO3
CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O
b. 与新制氢氧化铜反应
c. 与氧气反应
O
+ O22CH3 —C — H
O
2CH3 —C — OH△
催化剂
Ag++NH3·H2O=AgOH↓+NH4+
AgOH+2NH3·H2O=Ag(NH3)2++OH-+2H2O
(2)加成反应
O
+ H2CH3 —C — H CH3 —CH2— OH△
催化剂
同时也是还原反应
还原反应:加氢或失氧
氧化反应:加氧或失氢
有机的氧化
还原反应
学与问
(1)
(2) 在有机化学反应里,通常还可以从加氢或
去氢来分析氧化还原反应,即加氢就是还原反
应去氢就是氧化反应。
HCHO+4Ag(NH3)2OH →(NH4)2CO3+4Ag↓+6NH3+2H2O
△
HCHO+4Cu(OH)2 → CO2↑+2Cu2O↓+5H2O
△
总结:CH3CH2OH CH3CHO CH3COOH
氧化
还原
氧化
CnH2n+2O CnH2n O CnH2nO2
(3)
乙醛能发生氧化反应是由于醛基上的H原
子受C=O的影响,活性增强,能被氧化剂所氧
化;能发生还原反应是由于醛基上的C=O与
C=C类似,可以与H2发生加成反应。
科学视野
一、羧酸
1. 定义:由烃基与羧基相连构成的有机化合物。
2. 分类:
烃基不同
羧基数目
芳香酸
脂肪酸
一元羧酸
二元羧酸
多元羧酸
3. 乙酸(冰醋酸)
1)物理性质
2)结构
C HO
O
C
H
H
H
∶O
H∶ C∶ C∶ O∶ H
H
H
∷
∶
∶
∶
∶
∶
乙酸又叫醋酸,无色冰状晶体(所以又称冰
醋酸),溶点16.6℃,沸点117.9℃。有刺激性气
味,易溶于水。
科
学
探
究
碳酸钠固体
乙酸溶液
苯
酚
钠
溶
液
乙酸与碳酸钠反应,放出
CO2气体,根据强酸制弱酸的
原理,说明乙酸的酸性比碳酸
强;将产生的CO2气体通入苯
酚钠溶液中,生成苯酚,溶液
变浑浊,说明碳酸酸性比苯酚
强。
Na2CO3+2CH3COOH 2CH3COONa+CO2↑+H2O
3)化学性质
a.乙酸的酸性
b.乙酸的酯化反应
乙酸乙酯
18
O
CH3—C—OH +H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
浓H2SO4
自然界中的有机酸资料卡片
蚁酸(甲酸)
HCOOH 柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH 未成熟的梅子、李子、杏子
等水果中,含有草酸、安息香
酸等成分
草酸
(乙二酸)
COOH
COOH
安息香酸
(苯甲酸)
COOH
二、酯
1. 定义: 羧酸分子羧基中的━OH被 ━OR′
取代后的产物。
2. 简式: RCOOR′
3. 化学性质:(水解反应)
稀H2SO4CH3—C—O—C2H5 + H2O
O
CH3—C—OH+H—O—C2H5
O
CH3—C—OC2H5 + NaOH
O
CH3—CONa + HOC2H5
O
自然界中的有机酯资料卡片
含有:丁酸乙酯
含有:戊酸戊酯
含有:乙酸异戊酯
思考与交流
1)由于乙酸乙酯的沸点
比乙酸、乙醇都低,因此
从反应物中不断蒸出乙酸
乙酯可提高其产率。
2)使用过量的乙醇,可提高乙酸转化为乙酸乙
酯的产率。
根据化学平衡原理,提高乙
酸乙酯产率的措施有:
3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的
转化率。
一、有机合成的过程
利用简单、易得的原料,通过有机反应,
生成具有特定结构和功能的有机化合物。
1. 有机合成的概念
2. 有机合成的任务
有机合成的任务包括目标化合物分子骨架
的构建和官能团的转化。
有机合成过程示意图
基础原料
辅助原料
副产物 副产物
中间体 中间体
辅助原料辅助原料
目标化合物
3、有机合成的过程
思考与交流
1. 引入碳碳双键的三种方法:
卤代烃的消去;醇的消去;炔烃的不完全加成。
2. 引入卤原子的三种方法:
醇(或酚)的取代;烯烃(或炔烃)的加成;
烷烃(或苯及苯的同系物)的取代。
3. 引入羟基的四种方法:
烯烃与水的加成;卤代烃的水解;酯的水解;
醛的还原。
二、有机合成的方法
1. 有机合成的常规方法
(1)官能团的引入
①引入双键(C=C或C=O)
1)某些醇的消去引入C=C
CH3CH2 OH
浓硫酸
170℃
CH2=CH2↑ +H2O
醇
△ CH2=CH2↑+ NaBr+ H2O CH3CH2Br +NaOH
2)卤代烃的消去引入C=C
3)炔烃加成引入C=C
4)醇的氧化引入C=O
②引入卤原子(—X)
1)烃与X2取代
CH4 +Cl2 CH3Cl+ HCl光照
2CH3CH2OH+O2 2CH3CHO+2H2O催化剂
△
CH≡CH + HBr CH2=CHBr催化剂
△
3)醇与HX取代
CH2=CH2+Br2 CH2BrCH2Br
2)不饱和烃与HX或X2加成
③引入羟基(—OH)
1)烯烃与水的加成
CH2=CH2 +H2O CH3CH2OH
催化剂
加热加压
2)醛(酮)与氢气加成
CH3CHO +H2 CH3CH2OH
催化剂
Δ
C2H5OH + HBr C2H5Br + H2O△
3)卤代烃的水解(碱性)
C2H5Br +NaOH C2H5OH + NaBr
水
△
4)酯的水解
稀H2SO4
CH3COOH+C2H5OHCH3COOC2H5 + H2O △
(2)官能团的消除
①通过加成消除不饱和键
②通过消去或氧化或酯化或取代等消除羟基
③通过加成或氧化消除醛基
④通过消去反应或水解反应可消除卤原子
(3)官能团的衍变
2. 正向合成分析法
此法采用正向思维方法,从已知原料入手,
找出合成所需要的直接可间接的中间产物,逐步
推向目标合成有机物。
基础原料 中间体 中间体 目标化合物
正向合成分析法示意图
3. 逆向合成分析法
是将目标化合物倒退一步寻找上一步反应的
中间体,该中间体同辅助原料反应可以得到目标
化合物。
基础原料中间体 中间体目标化合物
逆向合成分析法示意图
所确定的合成路线的各步反应,其反应条件
必须比较温和,并具有较高的产率,所使用物基
础原料和辅助原料应该是低毒性、低污染、易得
和廉价的。
2 C2H5OH
C—OC2H5
C—OC2H5
O
O
C—OH
C—OH
O
O
+
草酸二乙酯的合成
H2C—OH
H2C—OH
H2C—Cl
H2C—Cl
CH2
CH2
C—H
C—H
O
O
复习课
第三章 烃的含氧衍生物
一、烃的各类衍生物的重要性质
类别 通式 官能团 代表性物质 分子结构特点 主要化学性质
卤代
烃 R—
X
—X
卤原
子
溴乙烷
C2H5Br
C—Br
易断裂
1. 取代反应:与NaOH
水溶液反应生成醇。
2. 消去反应:与强碱
的乙醇溶液共热,脱
去卤代氢,生成烯烃。
醇 R—
OH
—OH
羟基
乙醇
C2H5OH
—OH与链
烃基相连,
C—O键和
O—H键易
断裂
1. 跟金属钠反应。
2. 跟氢卤酸反应。
3. 分子间脱水。
4. 分子内脱水。
5. 氧化反应。
6. 酯化反应。
类别 通式 官能团 代表性物
质
分子结构特点 主要化学性质
酚 —OH —OH直接
跟苯环相连
1. 弱酸性:与强碱溶
液反应,生成苯酚盐
和水。
2. 取代反应:跟浓溴
水反应。
3. 显色反应:跟铁盐
反应,生成紫色物质。
醛 R—
CH
O
—
CHO
醛基
乙醛
CH3—
CHO
—CHO具有
不饱和性和
还原性
1. 加成反应:加氢生
成乙醇。
2. 具有还原性:能被
弱氧化剂氧化成羧酸
(如:银镜反应)
OH
类别 通式 官能团 代表性
物质
分子结构特点 主要化学性质
羧酸 R—
CO
OH
—COOH
羧基
乙酸 受C=O双键
影响,O—
H能够电离,
产生H+
1. 具有酸类通性。
2. 能起酯化反应。
酯 R—
CO
OR�
—COOR
�
酯基
乙酸
乙酯
分子中RCO
和OR�之间
的键容易断
裂
发生水解反应,生成
羧酸和醇
二、有机反应的主要类型
1. 取代反应:有机物分子中某些原子或原子团
被其它原子或原子团所代替的反应。
取代反应包括卤代、硝化、磺化、水解、
酯化等反应类型。
①是原子或原子团与另一原子或原子团的交换;
②两种物质反应,生成两种物质,有进有出的;
③该反应前后的有机物的空间结构没有发生变化;
④取代反应总是发生在单键上;
⑤这是饱和化合物的特有反应。
2. 加成反应:有机物分子中未饱和的碳原子
跟其它原子或原子团直接结合生成别的物质
的反应。
加成反应试剂包括H2、X2(卤素)、
HX、HCN等。
①加成反应发生在不饱和碳原子上;
②该反应中加进原子或原子团,只生成一种有机物
相当于化合反应),只进不出。
③加成前后的有机物的结构将发生变化,烯烃变烷
烃,结构由平面形变立体形;炔烃变烯烃,结
构由直线形变平面形;
④加成反应是不饱和化合物的较特有反应,另外,
芳香族化合物也有可能发生加成反应。
3. 消去反应:有机物在一定条件下,从一个
分子中脱去一个小分子(如:H2O、HX、
NH3等)生成不饱和化合物的反应(消去小
分子)。
①消去反应发生在分子内;
②发生在相邻的两个碳原子上;
③消去反应会脱去小分子,即生成小分子;
④消去后生成的有机物会产生双键或叁键;
⑤消去前后的有机物的分子结构变发生变化,它与加
成反应相反,因此,分子结构的变化正好与加成反
应的情况相反。
4. 氧化反应:有机物得氧或失氢的反应。
氧化反应包括:
(1)烃和烃的衍生物的燃烧反应;
(2)烯烃、炔烃、二烯烃、苯的同系物、醇、
醛等与酸性高锰酸钾反应;
(3)醇氧化为醛和酮;
(4)醛氧化为羧酸等反应。
5. 还原反应:有机物加氢或去氧的反应。
6. 加聚反应:通过加成反应聚合成高分子化
合物的反应(加成聚合)。主要为含双键的
单体聚合。
7. 缩合(聚)反应:单体间通过缩合反应生
成高分子化合物,同时生成小分子(H2O、
NH3、HX等)的反应。
缩聚反应主要包括:醇酸缩聚、羟酸缩聚、
氨基酸缩聚等。
8. 酯化反应(属于取代反应):酸(有机
羧酸、无机含氧酸)与醇作用生成酯和水的
反应。
9. 水解反应:有机物在一定条件下跟水作用
生成两种或多种物质的反应。
水解反应包括卤代烃水解、酯水解、糖(除单
糖外)水解、蛋白质水解等。
10. 裂化反应:在一定温度下,把相对分子
质量大、沸点高的长链烃断裂为相对分子质
量小、沸点低的短链烃的反应。
三、有机反应的官能团
有机物 无机物/有机物 反应名称
烷,芳烃,酚 X2 卤代反应
苯的同系物 HNO3 硝化反应
苯的同系物 H2SO4 磺化反应
醇 醇 脱水反应
醇 HX 取代反应
酸 醇 酯化反应
酯 醇 酯交换反应
酯/卤代烃 酸溶液或碱溶液 水解反应
二糖多糖 H2O 水解反应
蛋白质 H2O 水解反应
羧 酸 盐 碱石灰 脱羧反应
1. 发生取代反应的基/官能团
结构变化形式 —— 等 价 替 换
2. 发生加成反应的官能团
官能团 C=C C C -CHO -C=O C6H5-
有 机 物
反应条
件
C
O
-OHC
O
-H C
O
-O-C
O
- -
3. 发生氧化反应的官能团
C=C C C C-OH CHO C6H5-R CH3CH2CH2CH3
试
剂
条
件
产
物
-CH2OH -CHO为脱氢重键式
-CHO -COOH为氧原子插入式
反应条件 常 见 反 应
催化剂
加热加压
乙烯水化、乙烯氧化、丁烷氧化、
氯苯水解、油脂氢化
催化剂
加热
烯炔醛酮加氢、乙醇消去、
乙醇氧化、酯化反应
水浴加热 C6H5NO2制备、银镜反应、树脂制备、
纤维素水解、CH3COOC2H5水解
只用催化剂 苯的溴代、乙醛被空气氧化
只需加热 制CH4、苯的磺化、 R-OH的卤代
R-X水解和消去
不需外加
条件
烯与炔加溴、苯酚的取代
烯炔与苯的同系物氧化、
四、有机反应的条件
五、主要有机物之间的转化关系
—CH2—CH2—n
CH3—CH3 CH2==CH2 CH≡CH
CH3CH2Cl
CH3COOH
CH3CH2OH
CH3CHO
CH3COONa
CH2—CH2— —
Cl Cl
CH2==CH—
Cl
CH==CH— —
Cl Cl
HC—CH— —
Cl Cl
— —Cl Cl
Br
OH
ONa
CH3COOCH2CH3
(1)(2)
(3)(4)
(5)(6) (8)(7)
(9) (10)(11)
(12)
(13)
(14)
(15) (16)
(17)
(18)
(19)
(20)
(21)
(22)
(23)
(24)
(25)
OH
Br Br
Br
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页