- 877.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时达标作业12 硫及其化合物
基础题
1.如图有关硫元素循环的说法不合理的是( )
A.煤、石油中的硫元素燃烧时能生成SO2
B.动物尸体腐败过程产生的H2S气体会进入大气
C.循环过程中硫元素既发生氧化反应又发生还原反应
D.大气中的硫元素会全部转化成H2SO4随雨水降到土壤里
2.二氧化硫能使溴水褪色,说明二氧化硫具有( )
A.还原性 B.氧化性
C.漂白性 D.酸性
3.最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症。下列有关H2S的说法正确的是( )
A.H2S属于非电解质
B.人体内H2S可由含硫蛋白质降解产生
C.大量吸入H2S对人体无害
D.H2S只有还原性没有氧化性
4.在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是( )
A.一定会有SO
B.含有SO和Ag+
C.可能含有SO、Ag+、SO中的一种、两种
D.可能含有SO或CO
5.X(盐)和Y(酸)反应,可放出有气味的气体Z,Z跟过量NaOH溶液反应又得到X,Z氧化的最终产物为气体W,气体W溶于水又得到Y,则X和Y是( )
①Na2S和稀H2SO4 ②Na2SO3和盐酸 ③Na2S和盐酸 ④Na2SO3和稀H2SO4
8
A.只有① B.①② C.②③ D.①④
6.将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是( )
A.该实验表明SO2有漂白性
B.白色沉淀为BaSO3
C.该实验表明FeCl3有还原性
D.反应后溶液酸性增强
7.下列叙述Ⅰ和叙述Ⅱ均正确且有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
H2有还原性,浓硫酸有强氧化性
不能用浓硫酸干燥H2
B
CuS难溶于水和硫酸
反应H2S+CuSO4===CuS↓+H2SO4可以发生
C
浓H2SO4有吸水性
浓H2SO4可用于干燥氨气
D
SO2具有酸性和漂白性
向紫色石蕊溶液中通入SO2,溶液先变红再褪色
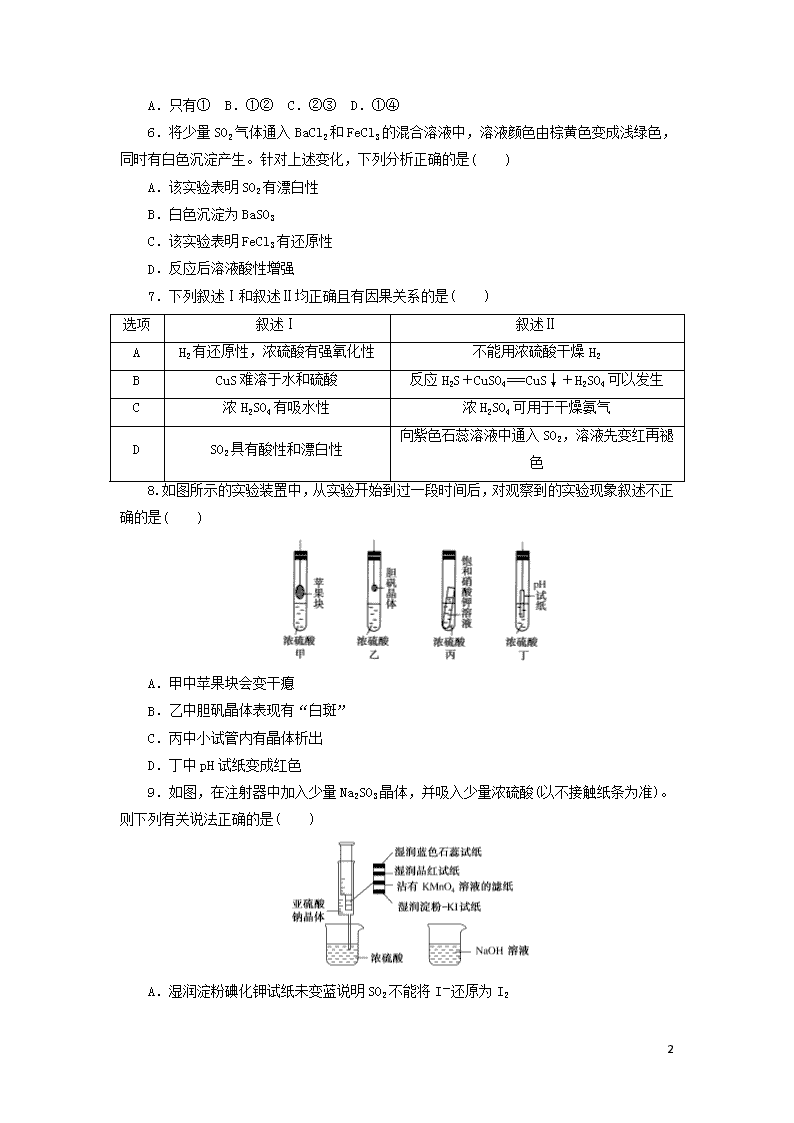
8.如图所示的实验装置中,从实验开始到过一段时间后,对观察到的实验现象叙述不正确的是( )
A.甲中苹果块会变干瘪
B.乙中胆矾晶体表现有“白斑”
C.丙中小试管内有晶体析出
D.丁中pH试纸变成红色
9.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
A.湿润淀粉碘化钾试纸未变蓝说明SO2不能将I-还原为I2
8
B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染
D.蓝色石蕊试纸先变红后褪色
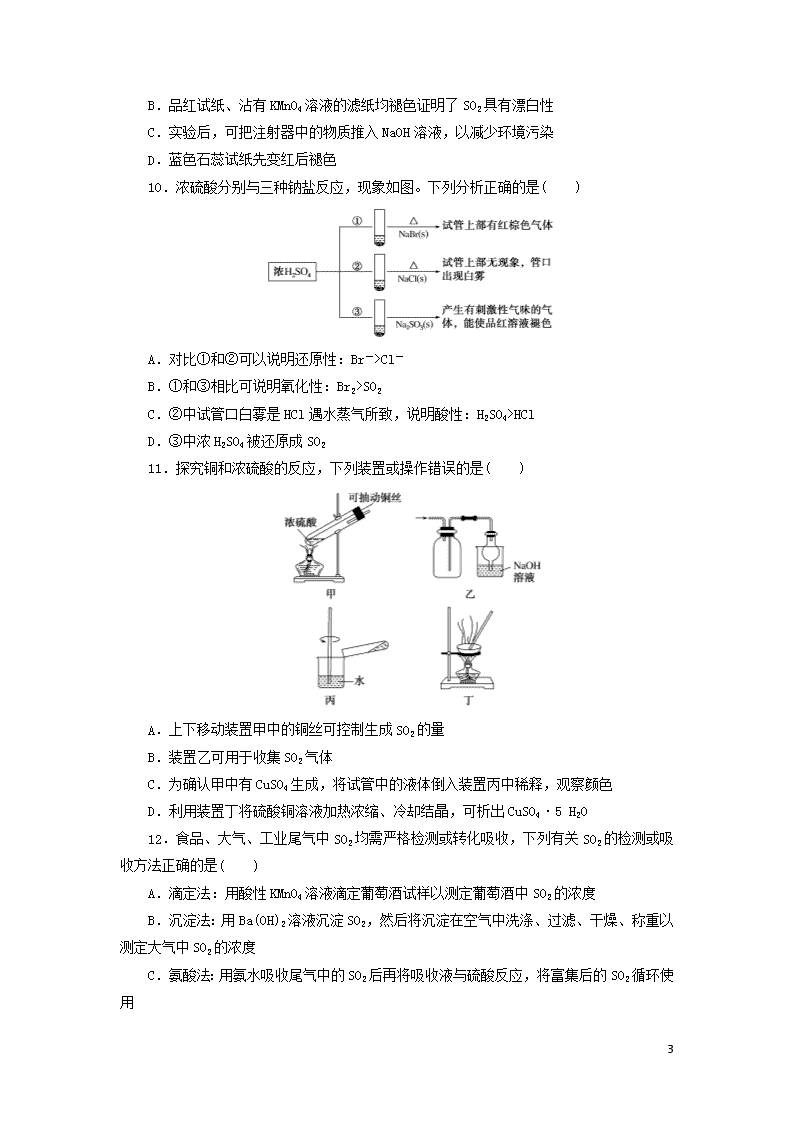
10.浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是( )
A.对比①和②可以说明还原性:Br->Cl-
B.①和③相比可说明氧化性:Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl
D.③中浓H2SO4被还原成SO2
11.探究铜和浓硫酸的反应,下列装置或操作错误的是( )
A.上下移动装置甲中的铜丝可控制生成SO2的量
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,将试管中的液体倒入装置丙中稀释,观察颜色
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5 H2O
12.食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是( )
A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
8
D.石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
能力题
13.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应,下列说法正确的是( )
A.溶液B中发生的反应为2SO2+O2===2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO
D.此工艺的优点之一是物质能循环利用
14.某硫酸厂废气中SO2的回收利用方案如图所示,下列说法不正确的是( )
A.X中可能含有2种盐
B.a是SO3
C.Y中含有(NH4)2SO4
D.(NH4)2S2O8中S元素的化合价不可能为+7
15.如图是某煤发电厂处理废气的装置示意图。下列说法错误的是( )
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为2SO2+2CaCO3+O2===2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标
16.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
8
(1)装置B中试剂X是________,装置D中盛放NaOH溶液的作用是
________________________________________________________________________
________________________________________________________________________。
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是
________________________________________________________________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为
________________________________________________________________________;
发生反应的离子方程式是
________________________________________________________________________。
课时达标作业12 硫及其化合物
1.解析:D项,大气中的硫元素部分转化成H2SO3随雨水降到土壤里,错误。
答案:D
2.解析:二氧化硫能使溴水褪色,是由于发生反应:Br2+SO2+2H2O===H2SO4+2HBr。在该反应中二氧化硫的S元素的化合价升高,失去电子,表现还原性。故答案选A。
8
答案:A
3.解析:酸碱盐均属于电解质,硫化氢是酸,故属于电解质,故A错误;蛋白质中含有S元素,S元素降解后的产物是硫化氢,故B正确;硫化氢气体有毒,不能大量吸入人体,故C错误;硫化氢中S原子为-2价,具有还原性,H原子为+1价,具有氧化性,故D错误。
答案:B
4.解析:A项错误,不能排除Ag+、SO的干扰;B项错误,因为溶液中SO与Ag+反应不能大量共存;C项正确,因为不能排除Ag+、SO的干扰;D项错误,由“加入稀硝酸,沉淀不溶解”可以判断不可能含有CO。
答案:C
5.解析:①Na2S和稀H2SO4反应生成H2S气体,H2S与过量NaOH溶液反应生成Na2S;H2S与O2反应先生成SO2,在催化剂作用下继续被氧化,最终生成SO3,SO3溶于水生成H2SO4,符合题中转化关系。②Na2SO3和盐酸反应生成SO2气体,SO2与过量NaOH溶液反应生成Na2SO3;SO2在催化剂作用下被O2氧化生成SO3,SO3溶于水生成H2SO4,不符合题中转化关系。③Na2S和盐酸反应生成H2S气体,H2S与过量NaOH溶液反应生成Na2S;H2S与O2反应先生成SO2,继续被氧化,最终生成SO3,SO3溶于水生成H2SO4,不符合题中转化关系。④Na2SO3和稀H2SO4反应生成SO2气体,SO2与过量NaOH溶液反应生成Na2SO3;SO2在催化剂作用下被O2氧化生成SO3,SO3溶于水生成H2SO4,符合题中转化关系。
答案:D
6.解析:二氧化硫的漂白性是指二氧化硫和水反应生成的亚硫酸与有色物质结合为不稳定的无色物质,此反应中二氧化硫作还原剂,故A错误;二氧化硫被氧化为硫酸,生成的沉淀为硫酸钡,故B错误;反应中溶液由棕黄色变成浅绿色,三价铁变化为二价铁,该实验表明FeCl3具有氧化性,故C错误;反应后生成硫酸,酸性增强,故D正确。
答案:D
7.解析:氢气与浓硫酸不反应,可以用浓硫酸干燥氢气,A错误;因为CuS难溶于水和硫酸,所以H2S+CuSO4===CuS↓+H2SO4可以发生,B正确;浓硫酸具有酸性,氨气具有碱性、二者能发生化学反应,C错误;二氧化硫的水溶液具有酸性,二氧化硫具有漂白性,是因为二氧化硫能与有色物质结合生成无色物质,SO2能使石蕊溶液变红,但不能使石蕊溶液褪色,D错误。
答案:B
8.解析:A项,浓硫酸具有吸水性,会使苹果块中水分逐渐减少而变得干瘪,正确;B项,浓硫酸具有吸水性,能使胆矾晶体表面失去部分结晶水,观察到蓝色晶体表面出现“白斑”,正确;C项,浓硫酸具有吸水性,使饱和KNO3溶液中溶剂减少,析出KNO3晶体,正确;D项,pH试纸的成分是纤维素,放入浓硫酸中易被脱水炭化,表面变成黑色,错误。
8
答案:D
9.解析:湿润淀粉碘化钾试纸未变蓝说明SO2不能将I-氧化为I2,A项错误;品红试纸褪色证明SO2具有漂白性,沾有KMnO4溶液的滤纸褪色是证明SO2具有还原性,B项错误;SO2气体有毒,所以实验后,可把注射器中的物质推入NaOH溶液进行吸收,以减少环境污染,C项正确;SO2仅能使蓝色石蕊试纸变红,D项错误。
答案:C
10.解析:A项,反应①生成的红棕色气体是溴蒸气,反应②白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气;B项,反应③生成的是二氧化硫气体,是非氧化还原反应;C项,白雾说明氯化氢易挥发,该反应原理不是“强酸制弱酸”,而是“高沸点酸制低沸点酸”;D项,反应③生成的是二氧化硫气体,是非氧化还原反应。
答案:A
11.解析:可控制铜丝与溶液接触面积来控制反应速率,故A不符合题意;二氧化硫的密度比空气的大,因此用装置乙收集二氧化硫时,应长进短出,故B符合题意;将试管中的液体倒入装置丙中,若变蓝,则有硫酸铜生成,故C不符合题意;利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出硫酸铜晶体,故D不符合题意。
答案:B
12.解析:A项,葡萄酒中的乙醇能被酸性高锰酸钾溶液氧化,对SO2的检测有干扰;B项,大气中的CO2能被Ba(OH)2溶液沉淀,对SO2的检测有干扰;C项,氨水吸收SO2生成(NH4)2SO3或NH4HSO3,(NH4)2SO3或NH4HSO3与硫酸反应能产生SO2,SO2可以循环使用;D项,石灰石吸收SO2,需要在高温下才能进行。
答案:C
13.解析:酸性Fe2(SO4)3溶液能吸收SO2,反应的离子方程式为2Fe3++SO2+2H2O===2Fe2++SO+4H+,溶液B中通入空气发生反应4Fe2++O2+4H+===4Fe3++2H2O,氧化性:O2>Fe3+>SO,A、C两项错误;溶液C中含有Fe2(SO4)3,可用KSCN溶液检验Fe3+,B项错误;Fe2(SO4)3可循环利用,D项正确。
答案:D
14.解析:X中含有亚硫酸铵或亚硫酸氢铵中的一种或两种盐,故A项正确;气体a为二氧化硫,故B项错误;X中加过量硫酸生成硫酸铵或硫酸氢铵,故C项正确;S元素的最高化合价是+6,不可能为+7,故D项正确。
答案:B
15.解析:装置内发生的反应有SO2与CaO的化合,CaCO3的分解反应以及CaSO3被氧气氧化为CaSO4的反应,没有发生置换反应。
答案:B
16.解析:装置A中制备二氧化硫,X干燥二氧化硫,C中SO2与Na2O2
8
反应生成氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气。E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气。
(1)装置B中试剂X干燥二氧化硫,盛放试剂是浓硫酸,装置D中盛放NaOH溶液的作用是吸收未反应的SO2,防止污染空气。
(2)检验SO2与Na2O2反应是否有氧气生成的方法是将带火星的木条放在D试管口处,看木条是否复燃。
(3)能说明I-还原性弱于SO2的现象为E中溶液蓝色褪去,发生反应的离子方程式是SO2+I2+2H2O===2I-+SO+4H+。
答案:(1)浓硫酸 吸收未反应的SO2,防止污染空气
(2)将带火星的木条放在D试管口处,看木条是否复燃
(3)E中溶液蓝色褪去 SO2+I2+2H2O===2I-+SO+4H+
8
相关文档
- 2021高考化学一轮复习课时达标作业2021-07-086页
- 2021高考化学一轮复习课时达标作业2021-07-078页
- 2021高考化学一轮复习课时达标作业2021-07-077页
- 2021高考化学一轮复习课时达标作业2021-07-069页
- 2021高考化学一轮复习课时达标作业2021-07-069页
- 2021高考化学一轮复习课时达标作业2021-07-069页
- 2021高考化学一轮复习课时达标作业2021-07-069页
- 2021高考化学一轮复习课时达标作业2021-07-058页
- 2021高考化学一轮复习课时达标作业2021-07-058页
- 2021高考化学一轮复习课时达标作业2021-07-058页