- 1.50 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第三章 烃的含氧衍生物
第一节 醇 酚
第1课时 醇
一、醇类的概念、分类和命名
1.概念
羟基与烃基或苯环侧链上的碳原子相连的化合物。官能团为羟基(—OH)。
2.分类
3.命名
二、醇的性质
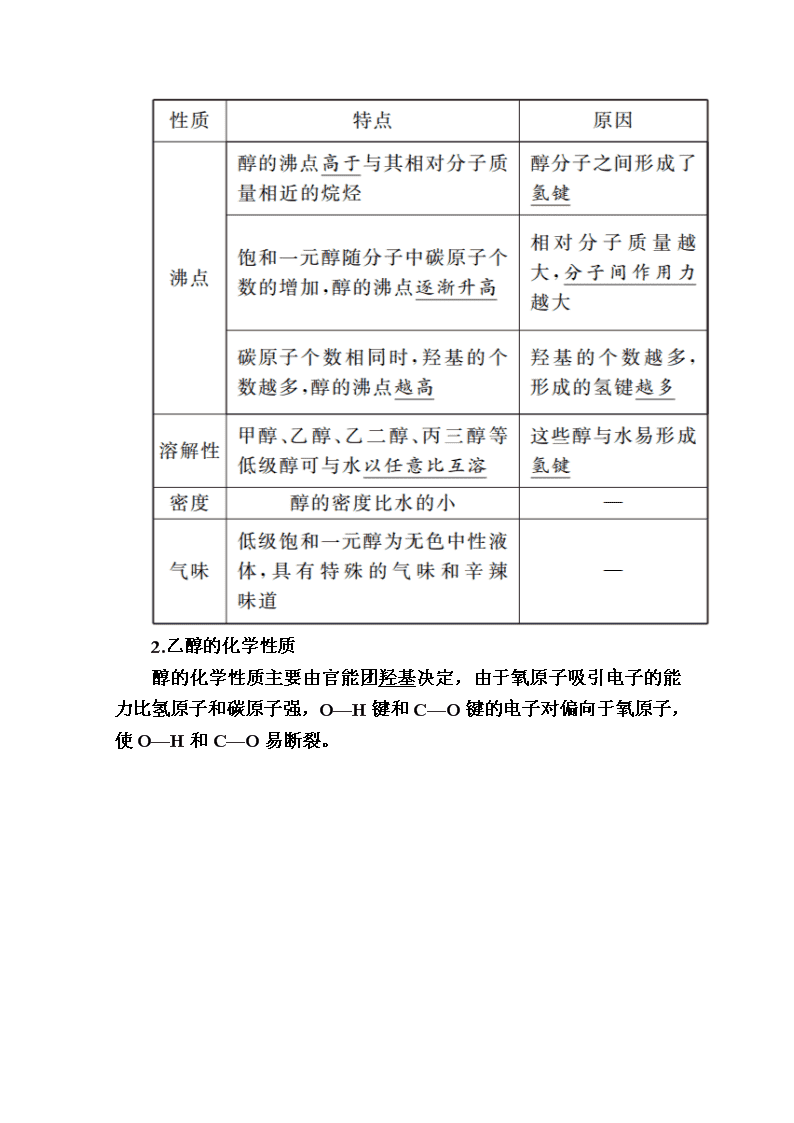
1.物理性质
2.乙醇的化学性质
醇的化学性质主要由官能团羟基决定,由于氧原子吸引电子的能力比氢原子和碳原子强,O—H键和C—O键的电子对偏向于氧原子,使O—H和C—O易断裂。
三、几种常见的醇
探究点一 乙醇的消去反应的实验
实验装置
实验步骤
①将浓硫酸与乙醇按体积比3∶1混合,即将15 mL浓硫酸缓缓加入到盛5 mL 95%乙醇的烧杯中,再倒入长颈圆底烧瓶中,并加入碎瓷片防止暴沸。
②加热混合溶液,迅速升温到170 ℃,将气体通入KMnO4
酸性溶液或溴的四氯化碳溶液中,观察。
实验现象
KMnO4酸性溶液或溴的四氯化碳溶液褪色。
实验结论
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
注意事项
①浓硫酸的作用是催化剂和脱水剂,为保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,浓硫酸和无水酒精的体积比以3∶1为宜。
②将浓硫酸与无水酒精混合时,将浓硫酸沿容器内壁慢慢倒入已盛在容器内的无水酒精中,并用玻璃棒不断搅拌无水酒精和浓硫酸的混合物。
③由于反应物都是液体而无固体,所以要向烧瓶中加入碎瓷片,以防液体受热时暴沸。
④控制温度迅速升到170 ℃。
无水酒精和浓硫酸混合物在170 ℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
⑤混合液颜色的变化
烧瓶中的液体逐渐变黑。浓硫酸有多种特性,在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质并进一步反应生成CO2、SO2等多种物质,碳的单质使烧瓶内的液体带上了黑色。
1.将甲醇、丙醇与浓硫酸混合共热,有可能生成哪些有机产物?
提示:丙醇与浓硫酸共热时,可能发生分子内脱水生成丙烯;还可能发生丙醇与丙醇、丙醇与甲醇、甲醇与甲醇的分子间脱水生成丙醚、甲丙醚、甲醚。
2.实验中NaOH的作用是什么?
提示:除去混在乙烯中的CO2和SO2以及挥发出的乙醇等杂质。
【例1】 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
请回答:
(1)烧瓶中碎瓷片的作用是________,装置中的明显错误是
________________________________________________________________________。
(2)实验步骤:①_________________________________________ ________________________;
②在各装置中注入相应的试剂(如图所示);③________________________;实验时,烧瓶中液体混合物逐渐变黑。
(3)能够说明乙烯具有还原性的现象是________________________________________________________________________;
装置甲的作用是________________________________________________________________________________________________________________________________________________;
若无甲装置,是否也能检验乙烯具有还原性,简述其理由:_______________________________________________________________________________________________________________________________________________。
【思路分析】
【解析】 (2)①制取气体的装置的气密性必须良好,实验前需要检查。③实验室制乙烯的反应条件是使反应混合物的温度迅速升至170 ℃,而减少乙醚的生成。
(3)乙烯具有还原性是根据氧化剂KMnO4酸性溶液褪色来判断的。由于烧瓶中混合物变黑,则说明生成了碳,联想浓H2SO4具有强氧化性,推出在乙烯中含还原性气体SO2,由于SO2也会使KMnO4酸性溶液褪色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净SO2,则装置甲的作用是除去SO2。
【答案】 (1)防止暴沸 温度计水银球没有插入反应液中央 (2)组装仪器,检查装置的气密性 加热,使温度迅速升到170 ℃ (3)乙中KMnO4酸性溶液紫色褪去 除去乙烯中混有的SO2、CO2等酸性气体以及挥发出的乙醇等杂质 不能,SO2具有还原性,也可以使KMnO4酸性溶液褪色
实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
(1)写出制备乙烯的化学反应方程式:CH3CH2OH
CH2===CH2↑+H2O,实验中,混合浓硫酸与乙醇的方法是将浓硫酸慢慢加入另一种物质中;加热F装置时必须使液体温度迅速升至170_℃。
(2)写出浓硫酸与酒精直接反应生成上述无机副产物的化学反应方程式:CH3CH2OH+6H2SO4(浓)―→2CO2↑+6SO2↑+9H2O。
(3)为实现上述实验目的,装置的连接顺序为F→A→B→E→C→D。(各装置限用一次)
(4)当D中观察到有淡黄色沉淀生成,表明C中发生的是取代反应;若D中没有出现前面所描述的现象时,表明C中发生的是加成反应。
解析:混合浓硫酸与乙醇,相当于稀释浓硫酸,故应将浓硫酸缓慢加入到乙醇中;加热时应使溶液迅速升温到170 ℃。为得到纯净的乙烯,应用NaOH溶液除去SO2、CO2(并用澄清石灰水检验是否除尽)及挥发出的乙醇等杂质,然后用浓H2SO4干燥。乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr遇AgNO3溶液会产生淡黄色沉淀。
探究点二 醇的消去反应和催化氧化反应
一、醇的消去反应
1.反应条件:浓硫酸、加热(需迅速升温至170 ℃)。
2.反应规律(结构特点):醇分子中,与—OH相连的C原子含有邻位C原子且邻位C原子上有H原子时,才能发生消去反应,从而形成不饱和键。
(3)无邻碳不反应:
只有一个碳原子的醇[如甲醇(CH3OH)]不能发生消去反应。
二、醇的催化氧化
1.反应条件:铜或银作催化剂加热。
1.溴乙烷与乙醇都可看作乙烷的取代产物,二者发生消去反应时有何异同?
提示:
2.醇与酸性KMnO4溶液反应的规律是什么?
提示:
【例2】 已知化合物甲、乙、丙有如下转化关系。
甲(C4H10O)乙(C4H8)丙(C4H8Br2)
回答下列问题:
(1)甲中官能团的名称是________,甲属于________,甲可能的结构有________种,其中可被催化氧化为醛的有________种。
(2)甲→乙的反应类型为________,反应条件①为________;乙→丙的反应类型为________,反应条件②为________。
(3)丙的结构简式不可能是________。
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
【思路分析】 先书写C4H10O的属于醇类的同分异构体;再根据消去反应和催化氧化反应的规律以及烯烃加成反应的特点解题。
【解析】
【答案】 (1)羟基 醇 4 2 (2)消去反应 浓硫酸、加热 加成反应 溴水或溴的CCl4溶液 (3)B
下列物质既能发生消去反应生成相应的烯烃,又能被氧化生成相应的醛的是( B )
A.CH3OH
B.CH2OHCH2CH3
C.(CH3)3COH
D.(CH3)2C(OH)CH2CH3
解析:醇发生消去反应时都是—OH与羟基相连的碳原子的邻位碳原子上的氢原子结合,脱水生成不饱和键;醇的催化氧化实质上是羟基碳上的一个H与—OH上的H一起失去,产物可能是醛或酮。由上述规律可知,A中物质不能发生消去反应,C、D中物质不能被氧化,B中物质发生消去反应生成丙烯,发生氧化反应生成丙醛。故正确答案为B。
1.下列说法正确的是( C )
A.醇均可溶于水
B.分子中碳原子数目越多的醇,沸点一定越高
C.甲醇和乙醇混合加热最多可得到三种醚
D.乙醇在一定条件下与HCl反应时断裂的是O—H键
解析:A项,高级醇一般不溶于水。B项,醇沸点的高低不仅与分子中碳原子数目有关,也与羟基数目有关。C项,可得到甲醚、乙醚和甲乙醚。D项,乙醇中断裂的是C—O键。
2.今有四种有机物:①丙三醇;②丙烷;③乙二醇;④乙醇。它们的沸点由高到低排列正确的是( C )
A.①②③④ B.④③②①
C.①③④② D.①③②④
解析:本题主要考查醇的沸点变化规律,醇的羟基之间易形成较强的相互作用,故醇的沸点比同碳原子数的烃要高,醇中碳原子数越多,其沸点越高,碳原子数相同的醇,所含羟基数目越多,其沸点越高,乙醇和丙烷的相对分子质量相近,但乙醇分子间存在氢键,物质的沸点大,所以物质的沸点乙醇大于丙烷,故选C项。
3.下列关于丙醇的叙述中,不正确的是( D )
A.1丙醇与氧气的混合气体通过赤热的铜,可生成CH3CH2CHO
B.1丙醇可与HI溶液发生取代反应
C.2丙醇在浓硫酸条件下能发生消去反应,生成一种烯烃
D.1丙醇、2丙醇、丙醚互为同分异构体
解析:在铜或银催化作用下,醇和O2反应欲生成醛,醇分子中与—OH相连的碳原子上必须有两个氢原子,1丙醇满足此条件,其氧化后能生成醛,A正确;醇可与氢卤酸发生取代反应,B正确;2丙醇在浓硫酸条件下只能生成丙烯,C正确;丙醚分子中有6个碳原子,与1丙醇、2丙醇分子式不同,它们不可能为同分异构体,D不正确。
4.A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子里羟基数之比是( D )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
解析:不同物质的量的三种醇生成了等量的氢气,说明不同物质的量的三种醇含有等量的羟基。设醇A、B、C分子内的—OH数分别为a、b、c,则3a=6b=2c,a∶b∶c=2∶1∶3。
5.将浓硫酸和分子式为C4H10O的醇共热,所得到的有机产物有( B )
A.14种 B.13种
C.8种 D.7种
解析:分子式为C4H10O的醇共有四种:
6.乙醇在与浓硫酸混合共热的反应过程中,受反应条件的影响,可发生两类不同的反应类型:
其中的A可能是( A )
A.乙烯 B.乙醇
C.乙二醇 D.乙酸
解析:四个选项中只有乙烯是烃且满足题意。
7.分子式为C7H16
O的饱和一元醇的同分异构体有多种,在下列该醇的同分异构体中,
(1)可以发生消去反应,生成两种单烯烃的是C;
(2)可以发生催化氧化生成醛的是D;
(3)不能发生催化氧化的是B;
(4)能被催化氧化为酮的有2种;
(5)能使KMnO4酸性溶液褪色的有3种。
解析:(1)因该醇发生消去反应时,生成两种单烯烃,这表明连有—OH的α碳原子的相邻碳原子上应连有氢原子,且以—OH所连碳为中心,分子不对称。(2)~(4)连有—OH的碳上有2个氢原子时可被氧化为醛,有一个氢原子时可被氧化为酮,不含氢原子时不能发生催化氧化。(5)连有—OH的碳上有氢原子时,可被KMnO4酸性溶液氧化为羧酸或酮,它们都会使KMnO4酸性溶液褪色。
8.按要求填写下列空格:
(1)饱和一元醇的通式为CnH2n+1OH。当n=3时,才出现同类同分异构体,当n=4时属于醇类的同分异构体有4种,其中氧化后生成醛的醇有2种。
对此加以分析得出如下结论:
①—OH所在的碳原子上若有2个能被氧化的H原子,这样的醇能被氧化成醛。
②—OH所在的碳原子上若有1个能被氧化的H原子,这样的醇能被氧化成酮。
③—OH所在碳原子上已经没有能被氧化的H原子,这样的醇不能被氧化。
(3)相同物质的量的乙醇、乙二醇、丙三醇分别与足量的金属钠反应,在相同条件下放出的氢气最多的是丙三醇。